Approches psychologiques et neurophysiologique
2008
| ANALYSE |
7-
Hypothèses neurophysiologiques
Bien que l’existence de joueurs pathologiques ait été décrite dès 1929 dans les Annales médico-psychologiques (Doupouy et Chatagnon, 1929 ) et même dès 1902 (France, 1902
) et même dès 1902 (France, 1902 ), la notion de jeu pathologique – et son lien éventuel avec un processus addictif – n’est apparue dans la littérature scientifique que vers la fin des années 1980 (American Psychiatric Association, Diagnostic and Statistical Manual of mental disorders, DSM-III-R, 1987
), la notion de jeu pathologique – et son lien éventuel avec un processus addictif – n’est apparue dans la littérature scientifique que vers la fin des années 1980 (American Psychiatric Association, Diagnostic and Statistical Manual of mental disorders, DSM-III-R, 1987 ). Le joueur excessif a tout d’abord été considéré comme ayant des troubles des impulsions puis cette pathologie s’est trouvée incluse progressivement dans le groupe des addictions sans substances. C’est également à cette époque que Aviel Goodman a suggéré que la meilleure méthode pour étudier les troubles addictifs serait, non pas de considérer chacun d’entre eux comme une entité isolée, mais plutôt de « rechercher une origine ou un mécanisme communs aux addictions qui s’exprimeraient par une multitude d’expressions comportementales » (Goodman, 1990
). Le joueur excessif a tout d’abord été considéré comme ayant des troubles des impulsions puis cette pathologie s’est trouvée incluse progressivement dans le groupe des addictions sans substances. C’est également à cette époque que Aviel Goodman a suggéré que la meilleure méthode pour étudier les troubles addictifs serait, non pas de considérer chacun d’entre eux comme une entité isolée, mais plutôt de « rechercher une origine ou un mécanisme communs aux addictions qui s’exprimeraient par une multitude d’expressions comportementales » (Goodman, 1990 ). Toujours à cette même époque, en 1988, une équipe italienne a montré que toutes les substances psychoactives qui déclenchent une pharmacodépendance chez l’Homme, comme l’amphétamine, la cocaïne, la morphine ou l’alcool, ont en commun la propriété de libérer une substance, la dopamine, dans une zone du cerveau de rongeur, le noyau accumbens (Di Chiara et Imperato, 1988
). Toujours à cette même époque, en 1988, une équipe italienne a montré que toutes les substances psychoactives qui déclenchent une pharmacodépendance chez l’Homme, comme l’amphétamine, la cocaïne, la morphine ou l’alcool, ont en commun la propriété de libérer une substance, la dopamine, dans une zone du cerveau de rongeur, le noyau accumbens (Di Chiara et Imperato, 1988 ). Qui plus est, en 1954, deux américains, Olds et Milner
). Qui plus est, en 1954, deux américains, Olds et Milner , avaient montré que la stimulation électrique d’une zone profonde du cerveau du rat, l’aire tegmentale ventrale, activait un circuit dit « de la récompense ». Ce circuit, composé de plusieurs structures cérébrales, fonctionne comme un baromètre qui indique à tout instant à l’animal ou à l’individu l’état psychique et physique dans lequel il se trouve. Olds et Milner ont montré que l’activation électrique de ce circuit à partir de l’aire tegmentale ventrale induisait chez l’animal un état de satisfaction si puissant qu’il en négligeait de se nourrir.
, avaient montré que la stimulation électrique d’une zone profonde du cerveau du rat, l’aire tegmentale ventrale, activait un circuit dit « de la récompense ». Ce circuit, composé de plusieurs structures cérébrales, fonctionne comme un baromètre qui indique à tout instant à l’animal ou à l’individu l’état psychique et physique dans lequel il se trouve. Olds et Milner ont montré que l’activation électrique de ce circuit à partir de l’aire tegmentale ventrale induisait chez l’animal un état de satisfaction si puissant qu’il en négligeait de se nourrir.
 ) et même dès 1902 (France, 1902
) et même dès 1902 (France, 1902 ), la notion de jeu pathologique – et son lien éventuel avec un processus addictif – n’est apparue dans la littérature scientifique que vers la fin des années 1980 (American Psychiatric Association, Diagnostic and Statistical Manual of mental disorders, DSM-III-R, 1987
), la notion de jeu pathologique – et son lien éventuel avec un processus addictif – n’est apparue dans la littérature scientifique que vers la fin des années 1980 (American Psychiatric Association, Diagnostic and Statistical Manual of mental disorders, DSM-III-R, 1987 ). Le joueur excessif a tout d’abord été considéré comme ayant des troubles des impulsions puis cette pathologie s’est trouvée incluse progressivement dans le groupe des addictions sans substances. C’est également à cette époque que Aviel Goodman a suggéré que la meilleure méthode pour étudier les troubles addictifs serait, non pas de considérer chacun d’entre eux comme une entité isolée, mais plutôt de « rechercher une origine ou un mécanisme communs aux addictions qui s’exprimeraient par une multitude d’expressions comportementales » (Goodman, 1990
). Le joueur excessif a tout d’abord été considéré comme ayant des troubles des impulsions puis cette pathologie s’est trouvée incluse progressivement dans le groupe des addictions sans substances. C’est également à cette époque que Aviel Goodman a suggéré que la meilleure méthode pour étudier les troubles addictifs serait, non pas de considérer chacun d’entre eux comme une entité isolée, mais plutôt de « rechercher une origine ou un mécanisme communs aux addictions qui s’exprimeraient par une multitude d’expressions comportementales » (Goodman, 1990 ). Toujours à cette même époque, en 1988, une équipe italienne a montré que toutes les substances psychoactives qui déclenchent une pharmacodépendance chez l’Homme, comme l’amphétamine, la cocaïne, la morphine ou l’alcool, ont en commun la propriété de libérer une substance, la dopamine, dans une zone du cerveau de rongeur, le noyau accumbens (Di Chiara et Imperato, 1988
). Toujours à cette même époque, en 1988, une équipe italienne a montré que toutes les substances psychoactives qui déclenchent une pharmacodépendance chez l’Homme, comme l’amphétamine, la cocaïne, la morphine ou l’alcool, ont en commun la propriété de libérer une substance, la dopamine, dans une zone du cerveau de rongeur, le noyau accumbens (Di Chiara et Imperato, 1988 ). Qui plus est, en 1954, deux américains, Olds et Milner
). Qui plus est, en 1954, deux américains, Olds et Milner , avaient montré que la stimulation électrique d’une zone profonde du cerveau du rat, l’aire tegmentale ventrale, activait un circuit dit « de la récompense ». Ce circuit, composé de plusieurs structures cérébrales, fonctionne comme un baromètre qui indique à tout instant à l’animal ou à l’individu l’état psychique et physique dans lequel il se trouve. Olds et Milner ont montré que l’activation électrique de ce circuit à partir de l’aire tegmentale ventrale induisait chez l’animal un état de satisfaction si puissant qu’il en négligeait de se nourrir.
, avaient montré que la stimulation électrique d’une zone profonde du cerveau du rat, l’aire tegmentale ventrale, activait un circuit dit « de la récompense ». Ce circuit, composé de plusieurs structures cérébrales, fonctionne comme un baromètre qui indique à tout instant à l’animal ou à l’individu l’état psychique et physique dans lequel il se trouve. Olds et Milner ont montré que l’activation électrique de ce circuit à partir de l’aire tegmentale ventrale induisait chez l’animal un état de satisfaction si puissant qu’il en négligeait de se nourrir.Il se trouve que l’aire tegmentale ventrale n’est autre que la structure cérébrale contenant les corps cellulaires des neurones dopaminergiques qui innervent l’avant du cerveau. La dopamine et les cellules dopaminergiques qui stimulent le circuit de la récompense semblent donc se trouver au centre de toutes les explications neurophysiologiques des processus de plaisir. Enfin, l’ensemble de ces résultats a conduit à considérer que puisque toutes les drogues qui entraînent une addiction procurent, au moins lors des premières prises, du plaisir, la dopamine, responsable du plaisir, pourrait être le neuromédiateur dont la libération intense provoquerait la pharmacodépendance.
À partir du syllogisme selon lequel « la dopamine est responsable des processus addictifs » et « le jeu pathologique est analogue à un processus addictif », les recherches ont été tout naturellement dirigées vers les liens qui pouvaient exister entre la transmission dopaminergique et le jeu pathologique.
Données neurophysiologiques
Les données qui ont été obtenues en lien avec le jeu pathologique concernent donc essentiellement les neurones dopaminergiques. Des études génétiques et biochimiques ont cependant permis de mettre en évidence le rôle d’autres ensembles neuronaux, tels que les neurones noradrénergiques et sérotoninergiques.
Traitement de la maladie de Parkinson et jeu pathologique
La maladie de Parkinson est un trouble neurologique qui regroupe trois symptômes : une akinésie (difficulté dans l’initiation d’un mouvement) et deux autres qui ne sont pas nécessairement présents de façon simultanée, une hypertonie plastique (résistance continue à l’étirement d’un membre) et un tremblement de repos. Dès 1960, il fût observé chez les patients parkinsoniens décédés qu’une grande partie de leurs neurones dopaminergiques avait subi une dégénérescence. On sait maintenant que cette dégénérescence dopaminergique est accompagnée d’une disparition des neurones noradrénergiques qui est au moins égale sinon supérieure à celle des neurones dopaminergiques (Zarow et coll., 2003 ). Les traitements chimiothérapiques les plus usuels consistent à tenter de rétablir, au moins partiellement, une transmission dopaminergique, soit en donnant le précurseur de la dopamine et de la noradrénaline, la L-DOPA, soit en donnant des produits qui stimulent les récepteurs dopaminergiques, des agonistes des récepteurs de type D2 ou D2/D3.
). Les traitements chimiothérapiques les plus usuels consistent à tenter de rétablir, au moins partiellement, une transmission dopaminergique, soit en donnant le précurseur de la dopamine et de la noradrénaline, la L-DOPA, soit en donnant des produits qui stimulent les récepteurs dopaminergiques, des agonistes des récepteurs de type D2 ou D2/D3.
 ). Les traitements chimiothérapiques les plus usuels consistent à tenter de rétablir, au moins partiellement, une transmission dopaminergique, soit en donnant le précurseur de la dopamine et de la noradrénaline, la L-DOPA, soit en donnant des produits qui stimulent les récepteurs dopaminergiques, des agonistes des récepteurs de type D2 ou D2/D3.
). Les traitements chimiothérapiques les plus usuels consistent à tenter de rétablir, au moins partiellement, une transmission dopaminergique, soit en donnant le précurseur de la dopamine et de la noradrénaline, la L-DOPA, soit en donnant des produits qui stimulent les récepteurs dopaminergiques, des agonistes des récepteurs de type D2 ou D2/D3.Les premières publications du développement d’un jeu excessif chez des malades parkinsoniens à la suite de leur traitement ont paru en 2000. Seedat et coll. (2000 ) et Molina et coll. (2000
) et Molina et coll. (2000 ) ont montré que lorsque les malades parkinsoniens traités par un agoniste dopaminergique développaient une pathologie liée au jeu, l’arrêt du traitement ou l’administration d’un antagoniste dopaminergique permettait de faire disparaître ce trouble. Depuis cette date, plus d’une quinzaine de publications ont confirmé qu’un (faible) pourcentage de malades parkinsoniens traités par des agonistes dopaminergiques devenaient des joueurs excessifs (Gschwandtner et coll., 2001
) ont montré que lorsque les malades parkinsoniens traités par un agoniste dopaminergique développaient une pathologie liée au jeu, l’arrêt du traitement ou l’administration d’un antagoniste dopaminergique permettait de faire disparaître ce trouble. Depuis cette date, plus d’une quinzaine de publications ont confirmé qu’un (faible) pourcentage de malades parkinsoniens traités par des agonistes dopaminergiques devenaient des joueurs excessifs (Gschwandtner et coll., 2001 ; Czernecki et coll., 2002
; Czernecki et coll., 2002 ; Driver-Dunckley et coll., 2003
; Driver-Dunckley et coll., 2003 ; Montastruc et coll., 2003
; Montastruc et coll., 2003 ; Avanzi et coll., 2004
; Avanzi et coll., 2004 ; Brand et coll., 2004
; Brand et coll., 2004 ; Kurlan, 2004
; Kurlan, 2004 ; Aarsland et coll., 2005
; Aarsland et coll., 2005 ; Dodd et coll., 2005
; Dodd et coll., 2005 ; Perretta et coll., 2005
; Perretta et coll., 2005 ; Avanzi et coll., 2006
; Avanzi et coll., 2006 ; -Drapier et coll., 2006
; -Drapier et coll., 2006 ; Imamura et coll., 2006
; Imamura et coll., 2006 ; Voon et coll., 2006
; Voon et coll., 2006 ; Weintraub et coll., 2006
; Weintraub et coll., 2006 ; O’Sullivan et Lees, 2007
; O’Sullivan et Lees, 2007 ; Sevincok et coll., 2007
; Sevincok et coll., 2007 ; Voon et coll., 2007
; Voon et coll., 2007 ). Ces travaux ont également montré que ces effets indésirables du traitement sont plus fréquents lorsque le malade parkinsonien est jeune, la prévalence étant de toute façon très variable puisqu’elle se situe, selon les études, entre 0,045 % et 8 % des malades traités. Il est d’autre part intéressant de noter que ce ne sont pas les malades traités par la L-DOPA qui développent la pathologie mais ceux qui ont reçu des agonistes dopaminergiques de type D2 et particulièrement D2/D3, le pramipexole étant le produit dont les effets indésirables sont les plus fréquents. Notons que si l’on additionne tous les cas qui ont présenté ces troubles ayant donné lieu à ces publications, le nombre de joueurs excessifs dépasse à peine la trentaine. Enfin, il faut remarquer que depuis le début de l’année 2007, quinze nouvelles publications continuent à confirmer le lien entre le traitement de la maladie de Parkinson par les agonistes dopaminergiques et le jeu excessif.
). Ces travaux ont également montré que ces effets indésirables du traitement sont plus fréquents lorsque le malade parkinsonien est jeune, la prévalence étant de toute façon très variable puisqu’elle se situe, selon les études, entre 0,045 % et 8 % des malades traités. Il est d’autre part intéressant de noter que ce ne sont pas les malades traités par la L-DOPA qui développent la pathologie mais ceux qui ont reçu des agonistes dopaminergiques de type D2 et particulièrement D2/D3, le pramipexole étant le produit dont les effets indésirables sont les plus fréquents. Notons que si l’on additionne tous les cas qui ont présenté ces troubles ayant donné lieu à ces publications, le nombre de joueurs excessifs dépasse à peine la trentaine. Enfin, il faut remarquer que depuis le début de l’année 2007, quinze nouvelles publications continuent à confirmer le lien entre le traitement de la maladie de Parkinson par les agonistes dopaminergiques et le jeu excessif.
 ) et Molina et coll. (2000
) et Molina et coll. (2000 ) ont montré que lorsque les malades parkinsoniens traités par un agoniste dopaminergique développaient une pathologie liée au jeu, l’arrêt du traitement ou l’administration d’un antagoniste dopaminergique permettait de faire disparaître ce trouble. Depuis cette date, plus d’une quinzaine de publications ont confirmé qu’un (faible) pourcentage de malades parkinsoniens traités par des agonistes dopaminergiques devenaient des joueurs excessifs (Gschwandtner et coll., 2001
) ont montré que lorsque les malades parkinsoniens traités par un agoniste dopaminergique développaient une pathologie liée au jeu, l’arrêt du traitement ou l’administration d’un antagoniste dopaminergique permettait de faire disparaître ce trouble. Depuis cette date, plus d’une quinzaine de publications ont confirmé qu’un (faible) pourcentage de malades parkinsoniens traités par des agonistes dopaminergiques devenaient des joueurs excessifs (Gschwandtner et coll., 2001 ; Czernecki et coll., 2002
; Czernecki et coll., 2002 ; Driver-Dunckley et coll., 2003
; Driver-Dunckley et coll., 2003 ; Montastruc et coll., 2003
; Montastruc et coll., 2003 ; Avanzi et coll., 2004
; Avanzi et coll., 2004 ; Brand et coll., 2004
; Brand et coll., 2004 ; Kurlan, 2004
; Kurlan, 2004 ; Aarsland et coll., 2005
; Aarsland et coll., 2005 ; Dodd et coll., 2005
; Dodd et coll., 2005 ; Perretta et coll., 2005
; Perretta et coll., 2005 ; Avanzi et coll., 2006
; Avanzi et coll., 2006 ; -Drapier et coll., 2006
; -Drapier et coll., 2006 ; Imamura et coll., 2006
; Imamura et coll., 2006 ; Voon et coll., 2006
; Voon et coll., 2006 ; Weintraub et coll., 2006
; Weintraub et coll., 2006 ; O’Sullivan et Lees, 2007
; O’Sullivan et Lees, 2007 ; Sevincok et coll., 2007
; Sevincok et coll., 2007 ; Voon et coll., 2007
; Voon et coll., 2007 ). Ces travaux ont également montré que ces effets indésirables du traitement sont plus fréquents lorsque le malade parkinsonien est jeune, la prévalence étant de toute façon très variable puisqu’elle se situe, selon les études, entre 0,045 % et 8 % des malades traités. Il est d’autre part intéressant de noter que ce ne sont pas les malades traités par la L-DOPA qui développent la pathologie mais ceux qui ont reçu des agonistes dopaminergiques de type D2 et particulièrement D2/D3, le pramipexole étant le produit dont les effets indésirables sont les plus fréquents. Notons que si l’on additionne tous les cas qui ont présenté ces troubles ayant donné lieu à ces publications, le nombre de joueurs excessifs dépasse à peine la trentaine. Enfin, il faut remarquer que depuis le début de l’année 2007, quinze nouvelles publications continuent à confirmer le lien entre le traitement de la maladie de Parkinson par les agonistes dopaminergiques et le jeu excessif.
). Ces travaux ont également montré que ces effets indésirables du traitement sont plus fréquents lorsque le malade parkinsonien est jeune, la prévalence étant de toute façon très variable puisqu’elle se situe, selon les études, entre 0,045 % et 8 % des malades traités. Il est d’autre part intéressant de noter que ce ne sont pas les malades traités par la L-DOPA qui développent la pathologie mais ceux qui ont reçu des agonistes dopaminergiques de type D2 et particulièrement D2/D3, le pramipexole étant le produit dont les effets indésirables sont les plus fréquents. Notons que si l’on additionne tous les cas qui ont présenté ces troubles ayant donné lieu à ces publications, le nombre de joueurs excessifs dépasse à peine la trentaine. Enfin, il faut remarquer que depuis le début de l’année 2007, quinze nouvelles publications continuent à confirmer le lien entre le traitement de la maladie de Parkinson par les agonistes dopaminergiques et le jeu excessif.Deux travaux très récents (Tippmann-Peikert et coll., 2007 ; Ondo et Lai, 2008
; Ondo et Lai, 2008 ) ne se sont pas limités à la maladie de Parkinson. Plus précisément, l’étude de Ondo et Lai indique que chez 300 patients souffrant de maladie de Parkinson, du syndrome des jambes sans repos ou des deux troubles associés, et traités par des agonistes dopaminergiques, 20 % ont remarqué que leur impulsivité avait augmenté mais seulement 4 % de façon désagréable ; parmi ceux dont l’impulsivité avait augmenté, 45 % sont devenus des joueurs excessifs, 40 % sont devenus des acheteurs compulsifs et 15 % des hypersexuels. Ce qui paraît intéressant dans cette étude est qu’elle montre que le jeu pathologique n’est qu’une des expressions comportementales d’une impulsivité peu contrôlée due à une transmission dopaminergique artificiellement exacerbée par un agoniste dopaminergique. S’il semble clair que le jeu excessif peut être associé à une impulsivité non contrôlée, il ne faudrait pas en conclure que le jeu pathologique est dû à un excès de dopamine. En effet, il est intéressant de noter que la L-DOPA, qui est à la fois précurseur de la dopamine et de la noradrénaline, n’induit que très peu, voire pas du tout, de jeu excessif chez les parkinsoniens alors que ce sont les agonistes dopaminergiques assez sélectifs qui le font. Ces résultats suggèrent que c’est le déséquilibre entre les transmissions dopaminergique et noradrénergique, induit par une stimulation dopaminergique exagérée sur des récepteurs déafférentés par la dégénérescence des fibres dopaminergiques, qui serait responsable du jeu excessif.
) ne se sont pas limités à la maladie de Parkinson. Plus précisément, l’étude de Ondo et Lai indique que chez 300 patients souffrant de maladie de Parkinson, du syndrome des jambes sans repos ou des deux troubles associés, et traités par des agonistes dopaminergiques, 20 % ont remarqué que leur impulsivité avait augmenté mais seulement 4 % de façon désagréable ; parmi ceux dont l’impulsivité avait augmenté, 45 % sont devenus des joueurs excessifs, 40 % sont devenus des acheteurs compulsifs et 15 % des hypersexuels. Ce qui paraît intéressant dans cette étude est qu’elle montre que le jeu pathologique n’est qu’une des expressions comportementales d’une impulsivité peu contrôlée due à une transmission dopaminergique artificiellement exacerbée par un agoniste dopaminergique. S’il semble clair que le jeu excessif peut être associé à une impulsivité non contrôlée, il ne faudrait pas en conclure que le jeu pathologique est dû à un excès de dopamine. En effet, il est intéressant de noter que la L-DOPA, qui est à la fois précurseur de la dopamine et de la noradrénaline, n’induit que très peu, voire pas du tout, de jeu excessif chez les parkinsoniens alors que ce sont les agonistes dopaminergiques assez sélectifs qui le font. Ces résultats suggèrent que c’est le déséquilibre entre les transmissions dopaminergique et noradrénergique, induit par une stimulation dopaminergique exagérée sur des récepteurs déafférentés par la dégénérescence des fibres dopaminergiques, qui serait responsable du jeu excessif.
 ; Ondo et Lai, 2008
; Ondo et Lai, 2008 ) ne se sont pas limités à la maladie de Parkinson. Plus précisément, l’étude de Ondo et Lai indique que chez 300 patients souffrant de maladie de Parkinson, du syndrome des jambes sans repos ou des deux troubles associés, et traités par des agonistes dopaminergiques, 20 % ont remarqué que leur impulsivité avait augmenté mais seulement 4 % de façon désagréable ; parmi ceux dont l’impulsivité avait augmenté, 45 % sont devenus des joueurs excessifs, 40 % sont devenus des acheteurs compulsifs et 15 % des hypersexuels. Ce qui paraît intéressant dans cette étude est qu’elle montre que le jeu pathologique n’est qu’une des expressions comportementales d’une impulsivité peu contrôlée due à une transmission dopaminergique artificiellement exacerbée par un agoniste dopaminergique. S’il semble clair que le jeu excessif peut être associé à une impulsivité non contrôlée, il ne faudrait pas en conclure que le jeu pathologique est dû à un excès de dopamine. En effet, il est intéressant de noter que la L-DOPA, qui est à la fois précurseur de la dopamine et de la noradrénaline, n’induit que très peu, voire pas du tout, de jeu excessif chez les parkinsoniens alors que ce sont les agonistes dopaminergiques assez sélectifs qui le font. Ces résultats suggèrent que c’est le déséquilibre entre les transmissions dopaminergique et noradrénergique, induit par une stimulation dopaminergique exagérée sur des récepteurs déafférentés par la dégénérescence des fibres dopaminergiques, qui serait responsable du jeu excessif.
) ne se sont pas limités à la maladie de Parkinson. Plus précisément, l’étude de Ondo et Lai indique que chez 300 patients souffrant de maladie de Parkinson, du syndrome des jambes sans repos ou des deux troubles associés, et traités par des agonistes dopaminergiques, 20 % ont remarqué que leur impulsivité avait augmenté mais seulement 4 % de façon désagréable ; parmi ceux dont l’impulsivité avait augmenté, 45 % sont devenus des joueurs excessifs, 40 % sont devenus des acheteurs compulsifs et 15 % des hypersexuels. Ce qui paraît intéressant dans cette étude est qu’elle montre que le jeu pathologique n’est qu’une des expressions comportementales d’une impulsivité peu contrôlée due à une transmission dopaminergique artificiellement exacerbée par un agoniste dopaminergique. S’il semble clair que le jeu excessif peut être associé à une impulsivité non contrôlée, il ne faudrait pas en conclure que le jeu pathologique est dû à un excès de dopamine. En effet, il est intéressant de noter que la L-DOPA, qui est à la fois précurseur de la dopamine et de la noradrénaline, n’induit que très peu, voire pas du tout, de jeu excessif chez les parkinsoniens alors que ce sont les agonistes dopaminergiques assez sélectifs qui le font. Ces résultats suggèrent que c’est le déséquilibre entre les transmissions dopaminergique et noradrénergique, induit par une stimulation dopaminergique exagérée sur des récepteurs déafférentés par la dégénérescence des fibres dopaminergiques, qui serait responsable du jeu excessif.Très récemment, un travail qui confirme cette hypothèse de déséquilibre dû à la stimulation spécifique de certains récepteurs au détriment d’autres vient de paraître (Frank et coll., 2007 ). Cette équipe propose que les ganglions de la base possèdent deux populations neuronales qui ont des effets opposés sur les afférences corticales. Une activation des neurones « Go » facilite l’exécution d’une réponse corticale, alors qu’une activation des neurones « No-Go » supprime les réponses. La dopamine libérée agirait par l’intermédiaire des récepteurs D1 (Go) pour apprendre et rechercher les actions récompensantes, alors que la stimulation des récepteurs D2 (No-Go) faciliterait l’apprentissage de l’aspect non récompensant de certaines réponses. Le noyau sous-thalamique permettrait de maintenir temporairement un contrôle évitant une réponse trop rapide en cas de décision conflictuelle (Frank et coll., 2007
). Cette équipe propose que les ganglions de la base possèdent deux populations neuronales qui ont des effets opposés sur les afférences corticales. Une activation des neurones « Go » facilite l’exécution d’une réponse corticale, alors qu’une activation des neurones « No-Go » supprime les réponses. La dopamine libérée agirait par l’intermédiaire des récepteurs D1 (Go) pour apprendre et rechercher les actions récompensantes, alors que la stimulation des récepteurs D2 (No-Go) faciliterait l’apprentissage de l’aspect non récompensant de certaines réponses. Le noyau sous-thalamique permettrait de maintenir temporairement un contrôle évitant une réponse trop rapide en cas de décision conflictuelle (Frank et coll., 2007 ). Dans le cas particulier du jeu pathologique chez les parkinsoniens traités par des agonistes dopaminergiques, la stimulation permanente des récepteurs D2 conduirait à rendre ces récepteurs inefficaces. Cette hypothèse expliquerait que la stimulation spécifique et continue des récepteurs D2 par les agonistes dopaminergiques entraîne une incapacité à apprendre les conséquences négatives d’un choix. L’impulsivité qui en découle n’apparaîtrait pas lors d’un traitement avec la L-DOPA parce qu’elle stimule de façon naturelle à la fois les récepteurs D1 et D2.
). Dans le cas particulier du jeu pathologique chez les parkinsoniens traités par des agonistes dopaminergiques, la stimulation permanente des récepteurs D2 conduirait à rendre ces récepteurs inefficaces. Cette hypothèse expliquerait que la stimulation spécifique et continue des récepteurs D2 par les agonistes dopaminergiques entraîne une incapacité à apprendre les conséquences négatives d’un choix. L’impulsivité qui en découle n’apparaîtrait pas lors d’un traitement avec la L-DOPA parce qu’elle stimule de façon naturelle à la fois les récepteurs D1 et D2.
 ). Cette équipe propose que les ganglions de la base possèdent deux populations neuronales qui ont des effets opposés sur les afférences corticales. Une activation des neurones « Go » facilite l’exécution d’une réponse corticale, alors qu’une activation des neurones « No-Go » supprime les réponses. La dopamine libérée agirait par l’intermédiaire des récepteurs D1 (Go) pour apprendre et rechercher les actions récompensantes, alors que la stimulation des récepteurs D2 (No-Go) faciliterait l’apprentissage de l’aspect non récompensant de certaines réponses. Le noyau sous-thalamique permettrait de maintenir temporairement un contrôle évitant une réponse trop rapide en cas de décision conflictuelle (Frank et coll., 2007
). Cette équipe propose que les ganglions de la base possèdent deux populations neuronales qui ont des effets opposés sur les afférences corticales. Une activation des neurones « Go » facilite l’exécution d’une réponse corticale, alors qu’une activation des neurones « No-Go » supprime les réponses. La dopamine libérée agirait par l’intermédiaire des récepteurs D1 (Go) pour apprendre et rechercher les actions récompensantes, alors que la stimulation des récepteurs D2 (No-Go) faciliterait l’apprentissage de l’aspect non récompensant de certaines réponses. Le noyau sous-thalamique permettrait de maintenir temporairement un contrôle évitant une réponse trop rapide en cas de décision conflictuelle (Frank et coll., 2007 ). Dans le cas particulier du jeu pathologique chez les parkinsoniens traités par des agonistes dopaminergiques, la stimulation permanente des récepteurs D2 conduirait à rendre ces récepteurs inefficaces. Cette hypothèse expliquerait que la stimulation spécifique et continue des récepteurs D2 par les agonistes dopaminergiques entraîne une incapacité à apprendre les conséquences négatives d’un choix. L’impulsivité qui en découle n’apparaîtrait pas lors d’un traitement avec la L-DOPA parce qu’elle stimule de façon naturelle à la fois les récepteurs D1 et D2.
). Dans le cas particulier du jeu pathologique chez les parkinsoniens traités par des agonistes dopaminergiques, la stimulation permanente des récepteurs D2 conduirait à rendre ces récepteurs inefficaces. Cette hypothèse expliquerait que la stimulation spécifique et continue des récepteurs D2 par les agonistes dopaminergiques entraîne une incapacité à apprendre les conséquences négatives d’un choix. L’impulsivité qui en découle n’apparaîtrait pas lors d’un traitement avec la L-DOPA parce qu’elle stimule de façon naturelle à la fois les récepteurs D1 et D2.La stimulation du noyau sous-thalamique a récemment été développée pour traiter certains des troubles de la maladie de Parkinson. Cette stimulation a semblé donner lieu à l’apparition chez un patient d’une pathologie de jeu excessif (Smeding et coll., 2007 ). Il faut cependant noter que ce patient était traité par un agoniste des récepteurs dopaminergiques et qu’une observation montrant le contraire de ce résultat avait été publiée précédemment pour deux autres patients (Witjas et coll., 2005
). Il faut cependant noter que ce patient était traité par un agoniste des récepteurs dopaminergiques et qu’une observation montrant le contraire de ce résultat avait été publiée précédemment pour deux autres patients (Witjas et coll., 2005 ).
).
 ). Il faut cependant noter que ce patient était traité par un agoniste des récepteurs dopaminergiques et qu’une observation montrant le contraire de ce résultat avait été publiée précédemment pour deux autres patients (Witjas et coll., 2005
). Il faut cependant noter que ce patient était traité par un agoniste des récepteurs dopaminergiques et qu’une observation montrant le contraire de ce résultat avait été publiée précédemment pour deux autres patients (Witjas et coll., 2005 ).
).C’est encore avec l’idée que la dopamine est impliquée dans le jeu excessif que Stojanov et coll. (2003 ) ont analysé l’inhibition du réflexe de sursaut chez les joueurs pathologiques. Cet index est souvent utilisé en clinique ; l’inhibition de ce réflexe est en particulier diminuée chez les patients schizophrènes. Stojanow et coll. interprètent la diminution de ce réflexe qu’ils ont constatée chez les joueurs comme une augmentation de l’activité dopaminergique. Notons cependant que le réflexe initial des joueurs excessifs (avant d’avoir testé l’inhibition) est supérieur à celui des témoins, ce qui suggère, comme le mentionnent les auteurs, qu’une augmentation de la réactivité des systèmes noradrénergiques peut également expliquer leurs résultats.
) ont analysé l’inhibition du réflexe de sursaut chez les joueurs pathologiques. Cet index est souvent utilisé en clinique ; l’inhibition de ce réflexe est en particulier diminuée chez les patients schizophrènes. Stojanow et coll. interprètent la diminution de ce réflexe qu’ils ont constatée chez les joueurs comme une augmentation de l’activité dopaminergique. Notons cependant que le réflexe initial des joueurs excessifs (avant d’avoir testé l’inhibition) est supérieur à celui des témoins, ce qui suggère, comme le mentionnent les auteurs, qu’une augmentation de la réactivité des systèmes noradrénergiques peut également expliquer leurs résultats.
 ) ont analysé l’inhibition du réflexe de sursaut chez les joueurs pathologiques. Cet index est souvent utilisé en clinique ; l’inhibition de ce réflexe est en particulier diminuée chez les patients schizophrènes. Stojanow et coll. interprètent la diminution de ce réflexe qu’ils ont constatée chez les joueurs comme une augmentation de l’activité dopaminergique. Notons cependant que le réflexe initial des joueurs excessifs (avant d’avoir testé l’inhibition) est supérieur à celui des témoins, ce qui suggère, comme le mentionnent les auteurs, qu’une augmentation de la réactivité des systèmes noradrénergiques peut également expliquer leurs résultats.
) ont analysé l’inhibition du réflexe de sursaut chez les joueurs pathologiques. Cet index est souvent utilisé en clinique ; l’inhibition de ce réflexe est en particulier diminuée chez les patients schizophrènes. Stojanow et coll. interprètent la diminution de ce réflexe qu’ils ont constatée chez les joueurs comme une augmentation de l’activité dopaminergique. Notons cependant que le réflexe initial des joueurs excessifs (avant d’avoir testé l’inhibition) est supérieur à celui des témoins, ce qui suggère, comme le mentionnent les auteurs, qu’une augmentation de la réactivité des systèmes noradrénergiques peut également expliquer leurs résultats.Indicateurs selon lesquels le jeu excessif est dû à un défaut de dopamine
Une étude récente en IRM (imagerie par résonance magnétique) fonctionnel a indiqué qu’un jeu de pari avec une récompense monétaire active le système de récompense méso-limbique aussi bien chez les joueurs excessifs que chez les témoins (Reuter et coll., 2005 ). Cette étude a montré que l’activation induite par le jeu était plus faible chez les joueurs excessifs que chez les témoins et que plus la pathologie était lourde, moins le système méso-limbique était activé. Les auteurs en ont conclu que les joueurs excessifs souffraient d’un syndrome de déficit de récompense (Syndrome Deficiency Reward) (Blum et coll., 2000
). Cette étude a montré que l’activation induite par le jeu était plus faible chez les joueurs excessifs que chez les témoins et que plus la pathologie était lourde, moins le système méso-limbique était activé. Les auteurs en ont conclu que les joueurs excessifs souffraient d’un syndrome de déficit de récompense (Syndrome Deficiency Reward) (Blum et coll., 2000 ; Comings et Blum, 2000
; Comings et Blum, 2000 ). Bien que ce travail le suggère par analogie avec les théories de la pharmacodépendance, la technique utilisée ne permet pas d’impliquer sans ambiguïté la dopamine. Une autre étude a montré que le jeu dans un casino entraîne chez les joueurs excessifs et non excessifs une augmentation de l’activité de l’axe hypothalamo-hypophysaire, avec une augmentation des taux sanguins de noradrénaline, de dopamine, de cortisol et du rythme cardiaque (Meyer et coll., 2004
). Bien que ce travail le suggère par analogie avec les théories de la pharmacodépendance, la technique utilisée ne permet pas d’impliquer sans ambiguïté la dopamine. Une autre étude a montré que le jeu dans un casino entraîne chez les joueurs excessifs et non excessifs une augmentation de l’activité de l’axe hypothalamo-hypophysaire, avec une augmentation des taux sanguins de noradrénaline, de dopamine, de cortisol et du rythme cardiaque (Meyer et coll., 2004 ). Les augmentations des catécholamines et du rythme cardiaque étaient plus importantes chez les joueurs excessifs. Zack et Poulos (2004
). Les augmentations des catécholamines et du rythme cardiaque étaient plus importantes chez les joueurs excessifs. Zack et Poulos (2004 ) ont montré que la D-amphétamine, qui augmente la libération de noradrénaline et de dopamine, induit une envie de jouer chez les joueurs excessifs, indiquant donc, d’après ces auteurs, un tronc commun entre les effets récompensants des psychostimulants et ceux du jeu excessif. Ces mêmes auteurs ont montré que l’halopéridol, un antagoniste des récepteurs dopaminergiques de type D2 et également des récepteurs α1-adrénergiques et 5-HT2 sérotoninergiques, augmentait le plaisir et l’envie de jouer chez les joueurs excessifs (Zack et Poulos, 2007
) ont montré que la D-amphétamine, qui augmente la libération de noradrénaline et de dopamine, induit une envie de jouer chez les joueurs excessifs, indiquant donc, d’après ces auteurs, un tronc commun entre les effets récompensants des psychostimulants et ceux du jeu excessif. Ces mêmes auteurs ont montré que l’halopéridol, un antagoniste des récepteurs dopaminergiques de type D2 et également des récepteurs α1-adrénergiques et 5-HT2 sérotoninergiques, augmentait le plaisir et l’envie de jouer chez les joueurs excessifs (Zack et Poulos, 2007 ). Bien que ces expériences mettent l’accent sur l’aspect « dopaminergique » des produits utilisés (amphétamine, halopéridol...), elles ne permettent pas d’exclure l’intervention d’autres neurotransmissions monoaminergiques ou non monoaminergiques.
). Bien que ces expériences mettent l’accent sur l’aspect « dopaminergique » des produits utilisés (amphétamine, halopéridol...), elles ne permettent pas d’exclure l’intervention d’autres neurotransmissions monoaminergiques ou non monoaminergiques.
 ). Cette étude a montré que l’activation induite par le jeu était plus faible chez les joueurs excessifs que chez les témoins et que plus la pathologie était lourde, moins le système méso-limbique était activé. Les auteurs en ont conclu que les joueurs excessifs souffraient d’un syndrome de déficit de récompense (Syndrome Deficiency Reward) (Blum et coll., 2000
). Cette étude a montré que l’activation induite par le jeu était plus faible chez les joueurs excessifs que chez les témoins et que plus la pathologie était lourde, moins le système méso-limbique était activé. Les auteurs en ont conclu que les joueurs excessifs souffraient d’un syndrome de déficit de récompense (Syndrome Deficiency Reward) (Blum et coll., 2000 ; Comings et Blum, 2000
; Comings et Blum, 2000 ). Bien que ce travail le suggère par analogie avec les théories de la pharmacodépendance, la technique utilisée ne permet pas d’impliquer sans ambiguïté la dopamine. Une autre étude a montré que le jeu dans un casino entraîne chez les joueurs excessifs et non excessifs une augmentation de l’activité de l’axe hypothalamo-hypophysaire, avec une augmentation des taux sanguins de noradrénaline, de dopamine, de cortisol et du rythme cardiaque (Meyer et coll., 2004
). Bien que ce travail le suggère par analogie avec les théories de la pharmacodépendance, la technique utilisée ne permet pas d’impliquer sans ambiguïté la dopamine. Une autre étude a montré que le jeu dans un casino entraîne chez les joueurs excessifs et non excessifs une augmentation de l’activité de l’axe hypothalamo-hypophysaire, avec une augmentation des taux sanguins de noradrénaline, de dopamine, de cortisol et du rythme cardiaque (Meyer et coll., 2004 ). Les augmentations des catécholamines et du rythme cardiaque étaient plus importantes chez les joueurs excessifs. Zack et Poulos (2004
). Les augmentations des catécholamines et du rythme cardiaque étaient plus importantes chez les joueurs excessifs. Zack et Poulos (2004 ) ont montré que la D-amphétamine, qui augmente la libération de noradrénaline et de dopamine, induit une envie de jouer chez les joueurs excessifs, indiquant donc, d’après ces auteurs, un tronc commun entre les effets récompensants des psychostimulants et ceux du jeu excessif. Ces mêmes auteurs ont montré que l’halopéridol, un antagoniste des récepteurs dopaminergiques de type D2 et également des récepteurs α1-adrénergiques et 5-HT2 sérotoninergiques, augmentait le plaisir et l’envie de jouer chez les joueurs excessifs (Zack et Poulos, 2007
) ont montré que la D-amphétamine, qui augmente la libération de noradrénaline et de dopamine, induit une envie de jouer chez les joueurs excessifs, indiquant donc, d’après ces auteurs, un tronc commun entre les effets récompensants des psychostimulants et ceux du jeu excessif. Ces mêmes auteurs ont montré que l’halopéridol, un antagoniste des récepteurs dopaminergiques de type D2 et également des récepteurs α1-adrénergiques et 5-HT2 sérotoninergiques, augmentait le plaisir et l’envie de jouer chez les joueurs excessifs (Zack et Poulos, 2007 ). Bien que ces expériences mettent l’accent sur l’aspect « dopaminergique » des produits utilisés (amphétamine, halopéridol...), elles ne permettent pas d’exclure l’intervention d’autres neurotransmissions monoaminergiques ou non monoaminergiques.
). Bien que ces expériences mettent l’accent sur l’aspect « dopaminergique » des produits utilisés (amphétamine, halopéridol...), elles ne permettent pas d’exclure l’intervention d’autres neurotransmissions monoaminergiques ou non monoaminergiques.Études génétiques
D’une façon générale, les auteurs considèrent que les facteurs non héréditaires jouent un rôle prépondérant dans la pathologie du joueur excessif et un certain nombre d’études tentent, malgré l’utilisation de cohortes relativement petites, d’analyser les interactions entre gènes et environnement (Lesieur et coll., 1986 ; Black et coll., 2006
; Black et coll., 2006 ). Ces études sont d’autant plus délicates qu’il existe de fortes comorbidités entre le jeu excessif et d’autres pathologies comme les troubles bipolaires, la dépression (Potenza, 2005
). Ces études sont d’autant plus délicates qu’il existe de fortes comorbidités entre le jeu excessif et d’autres pathologies comme les troubles bipolaires, la dépression (Potenza, 2005 ), ou l’abus d’alcool ou de tabac (Lesieur et coll., 1986
), ou l’abus d’alcool ou de tabac (Lesieur et coll., 1986 ; Krueger et coll., 2002
; Krueger et coll., 2002 ; Black et coll., 2006
; Black et coll., 2006 ; voir chapitre sur les comorbidités). Les liens génétiques qui ont pu être montrés sont donc entachés du fait que les effets mesurés ne sont pas nécessairement liés au jeu excessif mais à une autre pathologie fortement associée. Notons enfin que, même si des liens génétiques peuvent être statistiquement impliqués dans un trouble tel que le jeu excessif, il ne saurait être question d’une relation linéaire (un polymorphisme génétique responsable de jeu excessif) mais, au maximum, d’une vulnérabilité.
; voir chapitre sur les comorbidités). Les liens génétiques qui ont pu être montrés sont donc entachés du fait que les effets mesurés ne sont pas nécessairement liés au jeu excessif mais à une autre pathologie fortement associée. Notons enfin que, même si des liens génétiques peuvent être statistiquement impliqués dans un trouble tel que le jeu excessif, il ne saurait être question d’une relation linéaire (un polymorphisme génétique responsable de jeu excessif) mais, au maximum, d’une vulnérabilité.
 ; Black et coll., 2006
; Black et coll., 2006 ). Ces études sont d’autant plus délicates qu’il existe de fortes comorbidités entre le jeu excessif et d’autres pathologies comme les troubles bipolaires, la dépression (Potenza, 2005
). Ces études sont d’autant plus délicates qu’il existe de fortes comorbidités entre le jeu excessif et d’autres pathologies comme les troubles bipolaires, la dépression (Potenza, 2005 ), ou l’abus d’alcool ou de tabac (Lesieur et coll., 1986
), ou l’abus d’alcool ou de tabac (Lesieur et coll., 1986 ; Krueger et coll., 2002
; Krueger et coll., 2002 ; Black et coll., 2006
; Black et coll., 2006 ; voir chapitre sur les comorbidités). Les liens génétiques qui ont pu être montrés sont donc entachés du fait que les effets mesurés ne sont pas nécessairement liés au jeu excessif mais à une autre pathologie fortement associée. Notons enfin que, même si des liens génétiques peuvent être statistiquement impliqués dans un trouble tel que le jeu excessif, il ne saurait être question d’une relation linéaire (un polymorphisme génétique responsable de jeu excessif) mais, au maximum, d’une vulnérabilité.
; voir chapitre sur les comorbidités). Les liens génétiques qui ont pu être montrés sont donc entachés du fait que les effets mesurés ne sont pas nécessairement liés au jeu excessif mais à une autre pathologie fortement associée. Notons enfin que, même si des liens génétiques peuvent être statistiquement impliqués dans un trouble tel que le jeu excessif, il ne saurait être question d’une relation linéaire (un polymorphisme génétique responsable de jeu excessif) mais, au maximum, d’une vulnérabilité.Les mêmes difficultés sont rencontrées lors des études utilisant une approche moléculaire ; les recherches se sont dirigées vers le principe qui consiste à définir des gènes candidats présentant des polymorphismes et à mesurer si certains polymorphismes sont plus associés au jeu excessif que d’autres. Compte tenu de « l’hypothèse dopaminergique », ce sont surtout les gènes des récepteurs dopaminergiques qui ont servi de gènes candidats et qui ont donc été analysés. Les premiers résultats intéressants ont été obtenus par Comings et coll. (1996 ) qui ont montré que la possession de l’allèle TaqA1 du récepteur dopaminergique de type D2 rendait plus vulnérable au jeu pathologique. Posséder l’allèle TaqA1 de ce récepteur est également associé à une densité moins importante de récepteurs de ce type. Nous retrouvons ici l’hypothèse selon laquelle une plus faible transmission dopaminergique pourrait conduire à un déficit de récompense et à des troubles addictifs (Cohen et coll., 2005
) qui ont montré que la possession de l’allèle TaqA1 du récepteur dopaminergique de type D2 rendait plus vulnérable au jeu pathologique. Posséder l’allèle TaqA1 de ce récepteur est également associé à une densité moins importante de récepteurs de ce type. Nous retrouvons ici l’hypothèse selon laquelle une plus faible transmission dopaminergique pourrait conduire à un déficit de récompense et à des troubles addictifs (Cohen et coll., 2005 ). Notons cependant que cet allèle TaqA1 est plus fréquemment retrouvé chez les joueurs ayant une forme plus sévère de jeu excessif, et chez ceux qui ont des conduites d’abus ou de dépendance à l’alcool ou à d’autres substances toxicomanogènes (Slutske et coll., 2000
). Notons cependant que cet allèle TaqA1 est plus fréquemment retrouvé chez les joueurs ayant une forme plus sévère de jeu excessif, et chez ceux qui ont des conduites d’abus ou de dépendance à l’alcool ou à d’autres substances toxicomanogènes (Slutske et coll., 2000 ). Comings et coll. (1997
). Comings et coll. (1997 ) ont retrouvé un lien entre un allèle du récepteur D1 et les comportements addictifs, le syndrome de Gilles de La Tourette, le fumeur et le jeu excessif. L’effet est encore plus significatif si l’on tient compte dans l’analyse de ces groupes de la nature de l’allèle du récepteur D2 qui est associé à celui du récepteur D1. Notons que cette interaction entre les allèles du récepteur D1 et ceux du récepteur D2 a été retrouvée par Miller et coll. (1999
) ont retrouvé un lien entre un allèle du récepteur D1 et les comportements addictifs, le syndrome de Gilles de La Tourette, le fumeur et le jeu excessif. L’effet est encore plus significatif si l’on tient compte dans l’analyse de ces groupes de la nature de l’allèle du récepteur D2 qui est associé à celui du récepteur D1. Notons que cette interaction entre les allèles du récepteur D1 et ceux du récepteur D2 a été retrouvée par Miller et coll. (1999 ) à partir d’une population de 414 individus, comme étant fortement associée à l’âge de la première relation sexuelle. Les auteurs indiquent cependant que cette association est plus forte chez les hommes que chez les femmes. Le récepteur dopaminergique D4 a été associé au jeu pathologique par l’intermédiaire du trait de personnalité de la recherche de nouveauté (Cloninger et coll., 1994
) à partir d’une population de 414 individus, comme étant fortement associée à l’âge de la première relation sexuelle. Les auteurs indiquent cependant que cette association est plus forte chez les hommes que chez les femmes. Le récepteur dopaminergique D4 a été associé au jeu pathologique par l’intermédiaire du trait de personnalité de la recherche de nouveauté (Cloninger et coll., 1994 ; Ebstein et coll., 1996
; Ebstein et coll., 1996 ). Perez de Castro et coll. (1997
). Perez de Castro et coll. (1997 ), en étudiant dans une population de 68 sujets le polymorphisme du récepteur dopaminergique D4, ont montré une association avec le jeu pathologique qui est plus forte chez les femmes que chez les hommes. Le récepteur D4 possède un polymorphisme avec sept allèles différents correspondant à 2, 3, 4, 5, 6, 7 et 8 répétitions de paires de bases dans une de ses boucles cytoplasmiques. En étudiant ces différents allèles sur une plus grande cohorte, Comings et coll. (1999
), en étudiant dans une population de 68 sujets le polymorphisme du récepteur dopaminergique D4, ont montré une association avec le jeu pathologique qui est plus forte chez les femmes que chez les hommes. Le récepteur D4 possède un polymorphisme avec sept allèles différents correspondant à 2, 3, 4, 5, 6, 7 et 8 répétitions de paires de bases dans une de ses boucles cytoplasmiques. En étudiant ces différents allèles sur une plus grande cohorte, Comings et coll. (1999 ) n’ont pas obtenu de différence vis-à-vis du jeu excessif entre ceux qui portent les 7 allèles et ceux qui ne les portent pas. Néanmoins, un effet significatif a été obtenu en considérant ceux qui possèdent les allèles de 5 à 8 par rapport à ceux qui ne les possèdent pas. Cette étude, qui a analysé 737 sujets, conclut prudemment que « le rôle du gène du récepteur D4 dans les comportements impulsifs, compulsifs et addictifs est plus complexe que le simple fait de porter ou non les 7 allèles ». Enfin, une étude très récente a indiqué une plus grande impulsivité lorsque les présences de l’allèle TaqA1 du récepteur dopaminergique de type D2 et d’un variant du récepteur D4 étaient associées (Eisenberg et coll., 2007
) n’ont pas obtenu de différence vis-à-vis du jeu excessif entre ceux qui portent les 7 allèles et ceux qui ne les portent pas. Néanmoins, un effet significatif a été obtenu en considérant ceux qui possèdent les allèles de 5 à 8 par rapport à ceux qui ne les possèdent pas. Cette étude, qui a analysé 737 sujets, conclut prudemment que « le rôle du gène du récepteur D4 dans les comportements impulsifs, compulsifs et addictifs est plus complexe que le simple fait de porter ou non les 7 allèles ». Enfin, une étude très récente a indiqué une plus grande impulsivité lorsque les présences de l’allèle TaqA1 du récepteur dopaminergique de type D2 et d’un variant du récepteur D4 étaient associées (Eisenberg et coll., 2007 ).
).
 ) qui ont montré que la possession de l’allèle TaqA1 du récepteur dopaminergique de type D2 rendait plus vulnérable au jeu pathologique. Posséder l’allèle TaqA1 de ce récepteur est également associé à une densité moins importante de récepteurs de ce type. Nous retrouvons ici l’hypothèse selon laquelle une plus faible transmission dopaminergique pourrait conduire à un déficit de récompense et à des troubles addictifs (Cohen et coll., 2005
) qui ont montré que la possession de l’allèle TaqA1 du récepteur dopaminergique de type D2 rendait plus vulnérable au jeu pathologique. Posséder l’allèle TaqA1 de ce récepteur est également associé à une densité moins importante de récepteurs de ce type. Nous retrouvons ici l’hypothèse selon laquelle une plus faible transmission dopaminergique pourrait conduire à un déficit de récompense et à des troubles addictifs (Cohen et coll., 2005 ). Notons cependant que cet allèle TaqA1 est plus fréquemment retrouvé chez les joueurs ayant une forme plus sévère de jeu excessif, et chez ceux qui ont des conduites d’abus ou de dépendance à l’alcool ou à d’autres substances toxicomanogènes (Slutske et coll., 2000
). Notons cependant que cet allèle TaqA1 est plus fréquemment retrouvé chez les joueurs ayant une forme plus sévère de jeu excessif, et chez ceux qui ont des conduites d’abus ou de dépendance à l’alcool ou à d’autres substances toxicomanogènes (Slutske et coll., 2000 ). Comings et coll. (1997
). Comings et coll. (1997 ) ont retrouvé un lien entre un allèle du récepteur D1 et les comportements addictifs, le syndrome de Gilles de La Tourette, le fumeur et le jeu excessif. L’effet est encore plus significatif si l’on tient compte dans l’analyse de ces groupes de la nature de l’allèle du récepteur D2 qui est associé à celui du récepteur D1. Notons que cette interaction entre les allèles du récepteur D1 et ceux du récepteur D2 a été retrouvée par Miller et coll. (1999
) ont retrouvé un lien entre un allèle du récepteur D1 et les comportements addictifs, le syndrome de Gilles de La Tourette, le fumeur et le jeu excessif. L’effet est encore plus significatif si l’on tient compte dans l’analyse de ces groupes de la nature de l’allèle du récepteur D2 qui est associé à celui du récepteur D1. Notons que cette interaction entre les allèles du récepteur D1 et ceux du récepteur D2 a été retrouvée par Miller et coll. (1999 ) à partir d’une population de 414 individus, comme étant fortement associée à l’âge de la première relation sexuelle. Les auteurs indiquent cependant que cette association est plus forte chez les hommes que chez les femmes. Le récepteur dopaminergique D4 a été associé au jeu pathologique par l’intermédiaire du trait de personnalité de la recherche de nouveauté (Cloninger et coll., 1994
) à partir d’une population de 414 individus, comme étant fortement associée à l’âge de la première relation sexuelle. Les auteurs indiquent cependant que cette association est plus forte chez les hommes que chez les femmes. Le récepteur dopaminergique D4 a été associé au jeu pathologique par l’intermédiaire du trait de personnalité de la recherche de nouveauté (Cloninger et coll., 1994 ; Ebstein et coll., 1996
; Ebstein et coll., 1996 ). Perez de Castro et coll. (1997
). Perez de Castro et coll. (1997 ), en étudiant dans une population de 68 sujets le polymorphisme du récepteur dopaminergique D4, ont montré une association avec le jeu pathologique qui est plus forte chez les femmes que chez les hommes. Le récepteur D4 possède un polymorphisme avec sept allèles différents correspondant à 2, 3, 4, 5, 6, 7 et 8 répétitions de paires de bases dans une de ses boucles cytoplasmiques. En étudiant ces différents allèles sur une plus grande cohorte, Comings et coll. (1999
), en étudiant dans une population de 68 sujets le polymorphisme du récepteur dopaminergique D4, ont montré une association avec le jeu pathologique qui est plus forte chez les femmes que chez les hommes. Le récepteur D4 possède un polymorphisme avec sept allèles différents correspondant à 2, 3, 4, 5, 6, 7 et 8 répétitions de paires de bases dans une de ses boucles cytoplasmiques. En étudiant ces différents allèles sur une plus grande cohorte, Comings et coll. (1999 ) n’ont pas obtenu de différence vis-à-vis du jeu excessif entre ceux qui portent les 7 allèles et ceux qui ne les portent pas. Néanmoins, un effet significatif a été obtenu en considérant ceux qui possèdent les allèles de 5 à 8 par rapport à ceux qui ne les possèdent pas. Cette étude, qui a analysé 737 sujets, conclut prudemment que « le rôle du gène du récepteur D4 dans les comportements impulsifs, compulsifs et addictifs est plus complexe que le simple fait de porter ou non les 7 allèles ». Enfin, une étude très récente a indiqué une plus grande impulsivité lorsque les présences de l’allèle TaqA1 du récepteur dopaminergique de type D2 et d’un variant du récepteur D4 étaient associées (Eisenberg et coll., 2007
) n’ont pas obtenu de différence vis-à-vis du jeu excessif entre ceux qui portent les 7 allèles et ceux qui ne les portent pas. Néanmoins, un effet significatif a été obtenu en considérant ceux qui possèdent les allèles de 5 à 8 par rapport à ceux qui ne les possèdent pas. Cette étude, qui a analysé 737 sujets, conclut prudemment que « le rôle du gène du récepteur D4 dans les comportements impulsifs, compulsifs et addictifs est plus complexe que le simple fait de porter ou non les 7 allèles ». Enfin, une étude très récente a indiqué une plus grande impulsivité lorsque les présences de l’allèle TaqA1 du récepteur dopaminergique de type D2 et d’un variant du récepteur D4 étaient associées (Eisenberg et coll., 2007 ).
).Le problème de la très forte comorbidité entre le jeu excessif et plusieurs pathologies a été analysé un peu plus précisément dans un article de Comings et coll. (2001 ). Au cours de leur étude de 31 gènes candidats, ils ont interrogé par questionnaire les 139 joueurs excessifs qu’ils avaient recrutés afin de savoir s’ils « abusaient de substances ». Seuls 81 (58 %) ont répondu au questionnaire. Parmi ces réponses, 43 (53 %) avaient un problème d’addiction. Ce problème ne se posait pas pour les témoins car ils avaient été sélectionnés comme n’ayant pas de problème d’addiction. Parmi les 31 gènes candidats, 5 (récepteur D2, récepteur D4, transporteur de la dopamine, tryptophane hydroxylase, récepteur alpha2C-adrénergique) ont montré une association claire (p<0,01) avec le jeu excessif. Mais parmi ces 5 gènes candidats, seuls trois d’entre eux (récepteur D2, récepteur D4 et tryptophane hydroxylase) restaient significatifs si l’on ne considère que les joueurs excessifs sans addiction. Il aurait été intéressant de compléter cette étude en analysant les joueurs excessifs ne souffrant ni de dépression ni de troubles bipolaires. Rien ne permet d’assurer que la significativité des trois gènes restants se serait maintenue.
). Au cours de leur étude de 31 gènes candidats, ils ont interrogé par questionnaire les 139 joueurs excessifs qu’ils avaient recrutés afin de savoir s’ils « abusaient de substances ». Seuls 81 (58 %) ont répondu au questionnaire. Parmi ces réponses, 43 (53 %) avaient un problème d’addiction. Ce problème ne se posait pas pour les témoins car ils avaient été sélectionnés comme n’ayant pas de problème d’addiction. Parmi les 31 gènes candidats, 5 (récepteur D2, récepteur D4, transporteur de la dopamine, tryptophane hydroxylase, récepteur alpha2C-adrénergique) ont montré une association claire (p<0,01) avec le jeu excessif. Mais parmi ces 5 gènes candidats, seuls trois d’entre eux (récepteur D2, récepteur D4 et tryptophane hydroxylase) restaient significatifs si l’on ne considère que les joueurs excessifs sans addiction. Il aurait été intéressant de compléter cette étude en analysant les joueurs excessifs ne souffrant ni de dépression ni de troubles bipolaires. Rien ne permet d’assurer que la significativité des trois gènes restants se serait maintenue.
 ). Au cours de leur étude de 31 gènes candidats, ils ont interrogé par questionnaire les 139 joueurs excessifs qu’ils avaient recrutés afin de savoir s’ils « abusaient de substances ». Seuls 81 (58 %) ont répondu au questionnaire. Parmi ces réponses, 43 (53 %) avaient un problème d’addiction. Ce problème ne se posait pas pour les témoins car ils avaient été sélectionnés comme n’ayant pas de problème d’addiction. Parmi les 31 gènes candidats, 5 (récepteur D2, récepteur D4, transporteur de la dopamine, tryptophane hydroxylase, récepteur alpha2C-adrénergique) ont montré une association claire (p<0,01) avec le jeu excessif. Mais parmi ces 5 gènes candidats, seuls trois d’entre eux (récepteur D2, récepteur D4 et tryptophane hydroxylase) restaient significatifs si l’on ne considère que les joueurs excessifs sans addiction. Il aurait été intéressant de compléter cette étude en analysant les joueurs excessifs ne souffrant ni de dépression ni de troubles bipolaires. Rien ne permet d’assurer que la significativité des trois gènes restants se serait maintenue.
). Au cours de leur étude de 31 gènes candidats, ils ont interrogé par questionnaire les 139 joueurs excessifs qu’ils avaient recrutés afin de savoir s’ils « abusaient de substances ». Seuls 81 (58 %) ont répondu au questionnaire. Parmi ces réponses, 43 (53 %) avaient un problème d’addiction. Ce problème ne se posait pas pour les témoins car ils avaient été sélectionnés comme n’ayant pas de problème d’addiction. Parmi les 31 gènes candidats, 5 (récepteur D2, récepteur D4, transporteur de la dopamine, tryptophane hydroxylase, récepteur alpha2C-adrénergique) ont montré une association claire (p<0,01) avec le jeu excessif. Mais parmi ces 5 gènes candidats, seuls trois d’entre eux (récepteur D2, récepteur D4 et tryptophane hydroxylase) restaient significatifs si l’on ne considère que les joueurs excessifs sans addiction. Il aurait été intéressant de compléter cette étude en analysant les joueurs excessifs ne souffrant ni de dépression ni de troubles bipolaires. Rien ne permet d’assurer que la significativité des trois gènes restants se serait maintenue.Signalons enfin que quelques autres gènes ont été impliqués dans le jeu pathologique. Nous ne citerons que les principaux : le gène du transporteur de la sérotonine (Perez de Castro et coll., 1999 ; Devor et coll., 1999
; Devor et coll., 1999 ) ainsi que ceux des monoamines oxydases (Ibanez et coll., 2000
) ainsi que ceux des monoamines oxydases (Ibanez et coll., 2000 ; Perez de Castro et coll., 2002
; Perez de Castro et coll., 2002 ; Ruchkin et coll., 2005
; Ruchkin et coll., 2005 ).
).
 ; Devor et coll., 1999
; Devor et coll., 1999 ) ainsi que ceux des monoamines oxydases (Ibanez et coll., 2000
) ainsi que ceux des monoamines oxydases (Ibanez et coll., 2000 ; Perez de Castro et coll., 2002
; Perez de Castro et coll., 2002 ; Ruchkin et coll., 2005
; Ruchkin et coll., 2005 ).
).Études biochimiques
Comme pour les études précédentes, c’est la dopamine qui a eu la faveur d’analyses des taux de métabolites dans le système nerveux central chez les joueurs excessifs et les témoins. Une diminution de la dopamine et une augmentation des métabolites tels que l’acide 3,4-dihydroxy-phénylacétique (DOPAC) et l’acide homovanillique (HVA) ont été trouvées dans le liquide céphalorachidien chez les joueurs excessifs (Bergh et coll., 1997 ) mais ces résultats furent remis en question lorsqu’ils ont été corrigés par le débit (Nordin et Eklundh, 1998
) mais ces résultats furent remis en question lorsqu’ils ont été corrigés par le débit (Nordin et Eklundh, 1998 ; Nordin et Sjödin, 2006
; Nordin et Sjödin, 2006 ).
).
 ) mais ces résultats furent remis en question lorsqu’ils ont été corrigés par le débit (Nordin et Eklundh, 1998
) mais ces résultats furent remis en question lorsqu’ils ont été corrigés par le débit (Nordin et Eklundh, 1998 ; Nordin et Sjödin, 2006
; Nordin et Sjödin, 2006 ).
).Les systèmes sérotoninergiques sont couramment impliqués dans ce qui a trait à l’impulsivité (Staner et Mendlewicz, 1998 ; Brewer et Potenza, 2007
; Brewer et Potenza, 2007 ) ; pourtant, aucune différence de niveaux de sérotonine ni d’acide 5-hydroxy-indole-acétique (5-HIAA) n’a été détectée dans les liquides céphalorachidiens des joueurs excessifs. En fait, si ces données sont corrigées par le débit, qui est plus faible chez les joueurs excessifs, les taux de 5-HIAA apparaissent plus bas. La méta-chlorophénylpiperazine (m-CPP), un métabolite de la trazodone, agit comme un agoniste partiel sérotoninergique et présente une bonne affinité pour les récepteurs sérotoninergiques (en particulier le récepteur 5-HT2C qui est impliqué dans différents aspects de l’humeur, l’anxiété et de la fonction endocrine) (Kennett et Curzon, 1988
) ; pourtant, aucune différence de niveaux de sérotonine ni d’acide 5-hydroxy-indole-acétique (5-HIAA) n’a été détectée dans les liquides céphalorachidiens des joueurs excessifs. En fait, si ces données sont corrigées par le débit, qui est plus faible chez les joueurs excessifs, les taux de 5-HIAA apparaissent plus bas. La méta-chlorophénylpiperazine (m-CPP), un métabolite de la trazodone, agit comme un agoniste partiel sérotoninergique et présente une bonne affinité pour les récepteurs sérotoninergiques (en particulier le récepteur 5-HT2C qui est impliqué dans différents aspects de l’humeur, l’anxiété et de la fonction endocrine) (Kennett et Curzon, 1988 ). L’administration de m-CPP a entraîné une sensation plus agréable et une plus grande augmentation des niveaux de prolactine (un processus généralement considéré comme dû à la stimulation des récepteurs 5-HT1A/2A/2C) chez les joueurs excessifs par rapport aux témoins (Pallanti et coll., 2006
). L’administration de m-CPP a entraîné une sensation plus agréable et une plus grande augmentation des niveaux de prolactine (un processus généralement considéré comme dû à la stimulation des récepteurs 5-HT1A/2A/2C) chez les joueurs excessifs par rapport aux témoins (Pallanti et coll., 2006 ). Cette réponse subjective est identique à celle rapportée pour d’autres pathologies en lien avec l’impulsivité et la compulsion, comme la personnalité antisociale (Moss et coll., 1990
). Cette réponse subjective est identique à celle rapportée pour d’autres pathologies en lien avec l’impulsivité et la compulsion, comme la personnalité antisociale (Moss et coll., 1990 ), borderline (Hollander et coll., 1994
), borderline (Hollander et coll., 1994 ) et les dépendances à la cocaïne (Buydens-Branchey et coll., 1997
) et les dépendances à la cocaïne (Buydens-Branchey et coll., 1997 ) ou à l’alcool (Benkelfat et coll., 1991
) ou à l’alcool (Benkelfat et coll., 1991 ).
).
 ; Brewer et Potenza, 2007
; Brewer et Potenza, 2007 ) ; pourtant, aucune différence de niveaux de sérotonine ni d’acide 5-hydroxy-indole-acétique (5-HIAA) n’a été détectée dans les liquides céphalorachidiens des joueurs excessifs. En fait, si ces données sont corrigées par le débit, qui est plus faible chez les joueurs excessifs, les taux de 5-HIAA apparaissent plus bas. La méta-chlorophénylpiperazine (m-CPP), un métabolite de la trazodone, agit comme un agoniste partiel sérotoninergique et présente une bonne affinité pour les récepteurs sérotoninergiques (en particulier le récepteur 5-HT2C qui est impliqué dans différents aspects de l’humeur, l’anxiété et de la fonction endocrine) (Kennett et Curzon, 1988
) ; pourtant, aucune différence de niveaux de sérotonine ni d’acide 5-hydroxy-indole-acétique (5-HIAA) n’a été détectée dans les liquides céphalorachidiens des joueurs excessifs. En fait, si ces données sont corrigées par le débit, qui est plus faible chez les joueurs excessifs, les taux de 5-HIAA apparaissent plus bas. La méta-chlorophénylpiperazine (m-CPP), un métabolite de la trazodone, agit comme un agoniste partiel sérotoninergique et présente une bonne affinité pour les récepteurs sérotoninergiques (en particulier le récepteur 5-HT2C qui est impliqué dans différents aspects de l’humeur, l’anxiété et de la fonction endocrine) (Kennett et Curzon, 1988 ). L’administration de m-CPP a entraîné une sensation plus agréable et une plus grande augmentation des niveaux de prolactine (un processus généralement considéré comme dû à la stimulation des récepteurs 5-HT1A/2A/2C) chez les joueurs excessifs par rapport aux témoins (Pallanti et coll., 2006
). L’administration de m-CPP a entraîné une sensation plus agréable et une plus grande augmentation des niveaux de prolactine (un processus généralement considéré comme dû à la stimulation des récepteurs 5-HT1A/2A/2C) chez les joueurs excessifs par rapport aux témoins (Pallanti et coll., 2006 ). Cette réponse subjective est identique à celle rapportée pour d’autres pathologies en lien avec l’impulsivité et la compulsion, comme la personnalité antisociale (Moss et coll., 1990
). Cette réponse subjective est identique à celle rapportée pour d’autres pathologies en lien avec l’impulsivité et la compulsion, comme la personnalité antisociale (Moss et coll., 1990 ), borderline (Hollander et coll., 1994
), borderline (Hollander et coll., 1994 ) et les dépendances à la cocaïne (Buydens-Branchey et coll., 1997
) et les dépendances à la cocaïne (Buydens-Branchey et coll., 1997 ) ou à l’alcool (Benkelfat et coll., 1991
) ou à l’alcool (Benkelfat et coll., 1991 ).
).Une autre ligne de recherche considère qu’une dysfonction noradrénergique est très claire dans la pathologie du jeu excessif. Ce type de recherche s’appuie sur des études psychologiques sur la recherche de sensations, sur des travaux qui analysent les relations entre l’extraversion et l’éveil et la psychobiologie du jeu excessif (Roy et coll., 1989 ). Les premières recherches concernaient les activations comparées des systèmes autonomes chez des joueurs occasionnels, réguliers et excessifs. Les auteurs ont trouvé que les activations des systèmes autonomes étaient d’autant plus importantes que les joueurs se rapprochaient de la pathologie. Les théories de Zuckerman sur le rôle de la noradrénaline en tant que substrat biologique des processus d’activation corticale et d’alerte vont également dans le même sens (Zuckerman, 1993
). Les premières recherches concernaient les activations comparées des systèmes autonomes chez des joueurs occasionnels, réguliers et excessifs. Les auteurs ont trouvé que les activations des systèmes autonomes étaient d’autant plus importantes que les joueurs se rapprochaient de la pathologie. Les théories de Zuckerman sur le rôle de la noradrénaline en tant que substrat biologique des processus d’activation corticale et d’alerte vont également dans le même sens (Zuckerman, 1993 ). Il a été trouvé que les joueurs excessifs ont une augmentation de leurs métabolites noradrénergiques urinaires ainsi qu’une augmentation de noradrénaline et de 3-méthoxy-4-hydroxy-phénylglycol (MHPG) dans leur liquide céphalorachidien (Roy et coll., 1988
). Il a été trouvé que les joueurs excessifs ont une augmentation de leurs métabolites noradrénergiques urinaires ainsi qu’une augmentation de noradrénaline et de 3-méthoxy-4-hydroxy-phénylglycol (MHPG) dans leur liquide céphalorachidien (Roy et coll., 1988 ). Ces mêmes auteurs ont montré plus tard une corrélation entre l’extraversion et la fonction noradrénergique (Roy et coll., 1989
). Ces mêmes auteurs ont montré plus tard une corrélation entre l’extraversion et la fonction noradrénergique (Roy et coll., 1989 ). Une étude qui a utilisé la réponse de l’excrétion d’hormone de croissance en réponse à la clonidine, un agoniste alpha2-adrénergique, a montré que cette excrétion était plus importante chez les joueurs excessifs que chez les témoins (De Caria et coll., 1997
). Une étude qui a utilisé la réponse de l’excrétion d’hormone de croissance en réponse à la clonidine, un agoniste alpha2-adrénergique, a montré que cette excrétion était plus importante chez les joueurs excessifs que chez les témoins (De Caria et coll., 1997 ).
).
 ). Les premières recherches concernaient les activations comparées des systèmes autonomes chez des joueurs occasionnels, réguliers et excessifs. Les auteurs ont trouvé que les activations des systèmes autonomes étaient d’autant plus importantes que les joueurs se rapprochaient de la pathologie. Les théories de Zuckerman sur le rôle de la noradrénaline en tant que substrat biologique des processus d’activation corticale et d’alerte vont également dans le même sens (Zuckerman, 1993
). Les premières recherches concernaient les activations comparées des systèmes autonomes chez des joueurs occasionnels, réguliers et excessifs. Les auteurs ont trouvé que les activations des systèmes autonomes étaient d’autant plus importantes que les joueurs se rapprochaient de la pathologie. Les théories de Zuckerman sur le rôle de la noradrénaline en tant que substrat biologique des processus d’activation corticale et d’alerte vont également dans le même sens (Zuckerman, 1993 ). Il a été trouvé que les joueurs excessifs ont une augmentation de leurs métabolites noradrénergiques urinaires ainsi qu’une augmentation de noradrénaline et de 3-méthoxy-4-hydroxy-phénylglycol (MHPG) dans leur liquide céphalorachidien (Roy et coll., 1988
). Il a été trouvé que les joueurs excessifs ont une augmentation de leurs métabolites noradrénergiques urinaires ainsi qu’une augmentation de noradrénaline et de 3-méthoxy-4-hydroxy-phénylglycol (MHPG) dans leur liquide céphalorachidien (Roy et coll., 1988 ). Ces mêmes auteurs ont montré plus tard une corrélation entre l’extraversion et la fonction noradrénergique (Roy et coll., 1989
). Ces mêmes auteurs ont montré plus tard une corrélation entre l’extraversion et la fonction noradrénergique (Roy et coll., 1989 ). Une étude qui a utilisé la réponse de l’excrétion d’hormone de croissance en réponse à la clonidine, un agoniste alpha2-adrénergique, a montré que cette excrétion était plus importante chez les joueurs excessifs que chez les témoins (De Caria et coll., 1997
). Une étude qui a utilisé la réponse de l’excrétion d’hormone de croissance en réponse à la clonidine, un agoniste alpha2-adrénergique, a montré que cette excrétion était plus importante chez les joueurs excessifs que chez les témoins (De Caria et coll., 1997 ).
).Enfin, notons que les taux de béta-endorphines (des opiacés endogènes) semblent plus élevés dans le sang des joueurs excessifs (Shinohara et coll., 1999 ). En lien avec cette observation, la naltrexone, un antagoniste des récepteurs opiacés, a montré une supériorité au placebo dans une étude sur le traitement du jeu excessif (Kim et Grant, 2001
). En lien avec cette observation, la naltrexone, un antagoniste des récepteurs opiacés, a montré une supériorité au placebo dans une étude sur le traitement du jeu excessif (Kim et Grant, 2001 ).
).
 ). En lien avec cette observation, la naltrexone, un antagoniste des récepteurs opiacés, a montré une supériorité au placebo dans une étude sur le traitement du jeu excessif (Kim et Grant, 2001
). En lien avec cette observation, la naltrexone, un antagoniste des récepteurs opiacés, a montré une supériorité au placebo dans une étude sur le traitement du jeu excessif (Kim et Grant, 2001 ).
).Hypothèses neurophysiologiques
Quelles sont donc les hypothèses neurophysiologiques que l’on peut faire compte tenu des données disponibles à ce jour ?
Le jeu excessif est généralement considéré comme une « addiction sans drogues », avec l’idée que le risque de devenir dépendant au jeu en s’y adonnant s’apparenterait à celui que court un usager de drogues vis-à-vis de la pharmacodépendance. Cette question nous paraît centrale dans une réflexion sur le jeu excessif ; le jeu est-il une drogue au même titre que les psychostimulants, les opiacés, l’alcool ou le tabac ?
Nous avons vu que dans les mécanismes de consommation de drogues, le système dopaminergique est déterminant dans la mesure où il modifie le fonctionnement d’un ensemble neuronal particulier, le « circuit de la récompense » qui relaie toutes les informations externes et internes de l’organisme et permet au sujet de reconnaître, par l’intermédiaire de perceptions extérieures, l’existence de satisfactions potentielles de toutes sortes : nourriture, chaleur, plaisir sexuel… Les neurones dopaminergiques ne font pas partie à proprement parler du circuit de la récompense, mais leur activation stimule ce circuit et provoque une sensation de satisfaction. Les résultats des recherches neurobiologiques de ces dernières années ont convaincu la majeure partie de la communauté scientifique que la dopamine était fondamentale dans tous les événements associés au plaisir.
L’étape qui reste encore peu étudiée est celle de l’intervention de la dopamine dans la pharmacodépendance. Il est en effet tentant de considérer que c’est le plaisir que procure la drogue qui justifie que le consommateur ne puisse plus s’en passer. Ce serait le plaisir, et donc la dopamine, qui pousserait le toxicomane à rechercher la consommation de son produit. En fait, les cliniciens ont observé depuis longtemps que les toxicomanes perdent assez rapidement le plaisir associé à la consommation de drogues au profit de la recherche d’un état qui ressemble plus à un soulagement nécessaire voire indispensable. Les anglo-saxons parlent du passage de « liking » (aimer) à « wanting » (vouloir). On sait que la vulnérabilité du toxicomane sevré vis-à-vis d’une reprise de consommation peut durer plusieurs mois voire plusieurs années. Or, jusqu’à présent, tous les index biochimiques mesurés chez l’animal à la suite d’administrations répétées de drogues revenaient à la normale au bout de quelques jours ou au plus tard au bout d’un mois après la dernière consommation.
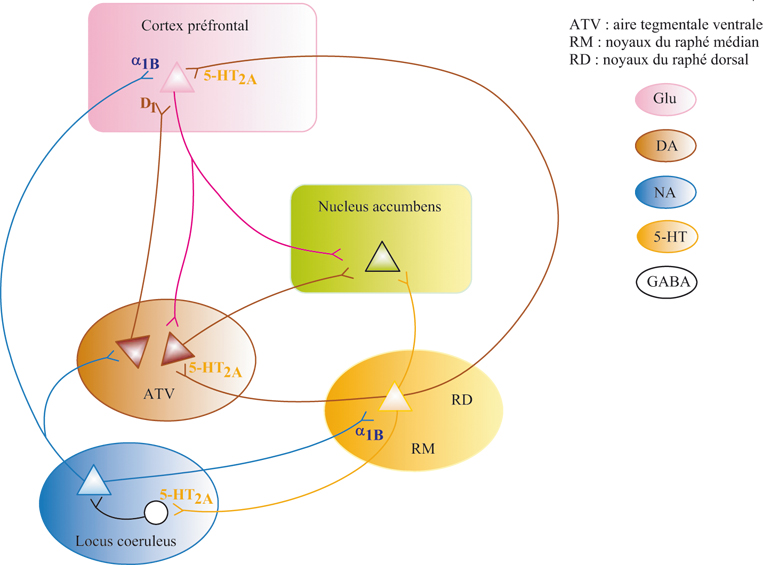
En étudiant d’autres modulateurs que la dopamine, à savoir la noradrénaline et la sérotonine, il a été montré que ces deux derniers systèmes se régulaient l’un l’autre (étaient couplés) chez les animaux normaux, c’est-à-dire chez ceux qui n’ont jamais consommé de drogues. Ce couplage correspond à une interaction entre les neurones noradrénergiques et sérotoninergiques telle que les deux ensembles neuronaux s’activent ou se limitent mutuellement en fonction des stimuli externes que perçoit l’animal ou l’individu (Salomon et coll., 2006 ). Après quatre injections d’amphétamine, de cocaïne, de morphine ou d’alcool, les systèmes noradrénergique et sérotoninergique sont découplés et chaque ensemble neuronal devient autonome et hyper-réactif (Salomon et coll., 2006
). Après quatre injections d’amphétamine, de cocaïne, de morphine ou d’alcool, les systèmes noradrénergique et sérotoninergique sont découplés et chaque ensemble neuronal devient autonome et hyper-réactif (Salomon et coll., 2006 ; Lanteri et coll., 2007
; Lanteri et coll., 2007 ) (voir figure 7.1
) (voir figure 7.1 ). De façon particulièrement intéressante, cette hyper-réactivité se maintient pendant des mois chez des animaux qui n’ont plus accès à la drogue. Le découplage obtenu par l’amphétamine par exemple, semble difficilement réversible. En cela au moins, ce phénomène paraît lié aux observations faites chez l’humain toxicomane sevré depuis une longue période : sa sensibilité au produit reste présente et tous les efforts de celui qui est un ancien toxicomane visent à ne pas reprendre du produit. En cas de reprise, les observations montrent, dans la majorité des cas, un retour rapide à une consommation abusive et à une réapparition des sensations de « craving ». C’est ce découplage – et l’hyper-réactivité incontrôlable qu’il induit – entre les systèmes noradrénergique et sérotoninergique qui est responsable du malaise que ressentent les toxicomanes (Tassin, 2008
). De façon particulièrement intéressante, cette hyper-réactivité se maintient pendant des mois chez des animaux qui n’ont plus accès à la drogue. Le découplage obtenu par l’amphétamine par exemple, semble difficilement réversible. En cela au moins, ce phénomène paraît lié aux observations faites chez l’humain toxicomane sevré depuis une longue période : sa sensibilité au produit reste présente et tous les efforts de celui qui est un ancien toxicomane visent à ne pas reprendre du produit. En cas de reprise, les observations montrent, dans la majorité des cas, un retour rapide à une consommation abusive et à une réapparition des sensations de « craving ». C’est ce découplage – et l’hyper-réactivité incontrôlable qu’il induit – entre les systèmes noradrénergique et sérotoninergique qui est responsable du malaise que ressentent les toxicomanes (Tassin, 2008 ). Reprendre de la drogue permettrait un recouplage artificiel de ces neurones, créant ainsi un soulagement temporaire susceptible d’expliquer la rechute. La drogue serait la façon la plus immédiate de répondre au malaise.
). Reprendre de la drogue permettrait un recouplage artificiel de ces neurones, créant ainsi un soulagement temporaire susceptible d’expliquer la rechute. La drogue serait la façon la plus immédiate de répondre au malaise.
 ). Après quatre injections d’amphétamine, de cocaïne, de morphine ou d’alcool, les systèmes noradrénergique et sérotoninergique sont découplés et chaque ensemble neuronal devient autonome et hyper-réactif (Salomon et coll., 2006
). Après quatre injections d’amphétamine, de cocaïne, de morphine ou d’alcool, les systèmes noradrénergique et sérotoninergique sont découplés et chaque ensemble neuronal devient autonome et hyper-réactif (Salomon et coll., 2006 ; Lanteri et coll., 2007
; Lanteri et coll., 2007 ) (voir figure 7.1
) (voir figure 7.1 ). De façon particulièrement intéressante, cette hyper-réactivité se maintient pendant des mois chez des animaux qui n’ont plus accès à la drogue. Le découplage obtenu par l’amphétamine par exemple, semble difficilement réversible. En cela au moins, ce phénomène paraît lié aux observations faites chez l’humain toxicomane sevré depuis une longue période : sa sensibilité au produit reste présente et tous les efforts de celui qui est un ancien toxicomane visent à ne pas reprendre du produit. En cas de reprise, les observations montrent, dans la majorité des cas, un retour rapide à une consommation abusive et à une réapparition des sensations de « craving ». C’est ce découplage – et l’hyper-réactivité incontrôlable qu’il induit – entre les systèmes noradrénergique et sérotoninergique qui est responsable du malaise que ressentent les toxicomanes (Tassin, 2008
). De façon particulièrement intéressante, cette hyper-réactivité se maintient pendant des mois chez des animaux qui n’ont plus accès à la drogue. Le découplage obtenu par l’amphétamine par exemple, semble difficilement réversible. En cela au moins, ce phénomène paraît lié aux observations faites chez l’humain toxicomane sevré depuis une longue période : sa sensibilité au produit reste présente et tous les efforts de celui qui est un ancien toxicomane visent à ne pas reprendre du produit. En cas de reprise, les observations montrent, dans la majorité des cas, un retour rapide à une consommation abusive et à une réapparition des sensations de « craving ». C’est ce découplage – et l’hyper-réactivité incontrôlable qu’il induit – entre les systèmes noradrénergique et sérotoninergique qui est responsable du malaise que ressentent les toxicomanes (Tassin, 2008 ). Reprendre de la drogue permettrait un recouplage artificiel de ces neurones, créant ainsi un soulagement temporaire susceptible d’expliquer la rechute. La drogue serait la façon la plus immédiate de répondre au malaise.
). Reprendre de la drogue permettrait un recouplage artificiel de ces neurones, créant ainsi un soulagement temporaire susceptible d’expliquer la rechute. La drogue serait la façon la plus immédiate de répondre au malaise. | Figure 7.1 Schéma des interactions entre les neurones monoaminergiques ascendants et les systèmes glutamatergiques descendants |
La question qui se pose maintenant est de savoir si le découplage qui est obtenu avec la cocaïne, la morphine, l’amphétamine ou l’alcool peut être obtenu par le jeu. Deux éléments développés au cours de cette expertise collective nous font penser que le jeu ne peut déclencher ce processus biochimique que de façon rare :
• d’une part, il est bien montré que la très grande majorité des joueurs excessifs souffre de pathologies associées. Il est donc possible que ce soit ces pathologies, y compris la présence d’addiction à des produits comme le tabac et l’alcool, qui se développeraient parallèlement au symptôme de joueur excessif et expliqueraient que le jeu prenne une forme pathologique ;
• d’autre part, il semble admis que pour un même pourcentage de personnes ayant essayé le cannabis ou le jeu (de l’ordre de 50 % de la population), la proportion de joueurs pathologiques est de 1 %, c’est-à-dire bien inférieure à celle de fumeurs abusifs de cannabis qui est pourtant considéré comme ayant un faible potentiel addictif. Le « potentiel addictif » du jeu, si tant est qu’on puisse le mesurer, serait donc assez faible.
Les psychiatres nous indiquent qu’il existe des joueurs pathologiques n’ayant aucune addiction ni aucun autre trouble psychique associés. On ne peut donc exclure que le simple fait de s’adonner au jeu puisse, comme le ferait une drogue d’abus, entraîner des modifications du fonctionnement du système nerveux central telles que celles que nous venons de décrire. Une des hypothèses qui pourrait être proposée ici serait que, chez certaines personnes, le stress et l’angoisse que peut engendrer le jeu augmentent de façon chronique la sécrétion de glucocorticoïdes et reproduisent, en absence de produit, des activations neuronales et un découplage analogues à ce qui est obtenu avec les drogues addictives. L’action facilitatrice des glucocorticoïdes sur la prise de substances psychoactives est en effet parfaitement documentée (voir revue Van Craenenbroeck et coll., 2005 ) et, comme dans les cas de toxicomanie avec drogues, des événements traumatisants vécus au cours de l’enfance facilitent le développement d’un comportement de jeu pathologique (Scherrer et coll., 2007
) et, comme dans les cas de toxicomanie avec drogues, des événements traumatisants vécus au cours de l’enfance facilitent le développement d’un comportement de jeu pathologique (Scherrer et coll., 2007 ). Des recherches pré-cliniques mériteraient d’être envisagées afin d’étudier si des situations de stress chronique ou la sécrétion de molécules endogènes comme les glucocorticoïdes peuvent, à elles seules, reproduire les effets neurochimiques que produisent les drogues d’abus.
). Des recherches pré-cliniques mériteraient d’être envisagées afin d’étudier si des situations de stress chronique ou la sécrétion de molécules endogènes comme les glucocorticoïdes peuvent, à elles seules, reproduire les effets neurochimiques que produisent les drogues d’abus.
 ) et, comme dans les cas de toxicomanie avec drogues, des événements traumatisants vécus au cours de l’enfance facilitent le développement d’un comportement de jeu pathologique (Scherrer et coll., 2007
) et, comme dans les cas de toxicomanie avec drogues, des événements traumatisants vécus au cours de l’enfance facilitent le développement d’un comportement de jeu pathologique (Scherrer et coll., 2007 ). Des recherches pré-cliniques mériteraient d’être envisagées afin d’étudier si des situations de stress chronique ou la sécrétion de molécules endogènes comme les glucocorticoïdes peuvent, à elles seules, reproduire les effets neurochimiques que produisent les drogues d’abus.
). Des recherches pré-cliniques mériteraient d’être envisagées afin d’étudier si des situations de stress chronique ou la sécrétion de molécules endogènes comme les glucocorticoïdes peuvent, à elles seules, reproduire les effets neurochimiques que produisent les drogues d’abus.
En conclusion, les efforts qui ont été réalisés jusqu’à présent pour mieux comprendre le ou les processus conduisant au jeu pathologique ont insisté sur le fait que ce syndrome correspond à celui d’une « addiction sans drogues ». Par analogie avec les connaissances sur les addictions dues aux drogues, les recherches se sont focalisées sur les neurones dopaminergiques. Bien que les observations, devenues classiques, des malades parkinsoniens ayant déclenché ce syndrome à la suite d’un traitement avec des agonistes dopaminergiques conduisent à incriminer les systèmes dopaminergiques liés à la récompense, il semble que l’émergence de cette pathologie soit non spécifique : la stimulation excessive des récepteurs déafférentés entraînerait une perte de contrôle des impulsions et s’exprimerait sous différentes formes, dont le jeu pathologique. Enfin, la très forte comorbidité (alcoolo-dépendance, tabaco-dépendance, troubles bipolaires…) observée avec le jeu excessif conduit à penser que jouer de façon exagérée serait plutôt l’expression que la cause d’un trouble pathologique. Des recherches pré-cliniques impliquant le rôle du stress dans le jeu pourraient apporter des indications sur cette dernière hypothèse.
Bibliographie
[1] aarsland d, alves g, larsen jp. Disorders of motivation, sexual conduct, and sleep in Parkinson’s disease.
Adv Neurol. 2005;
96:56- 64

[2]american psychiatric association. Diagnostic and statistical manual of mental disorders.
DSM-III-R;
Washington DC: APA. 1987;


[3] avanzi m, uber e, bonfa f. Pathological gambling in two patients on dopamine replacement therapy for Parkinson’s disease.
Neurol Sci. 2004;
25:98- 101

[4] avanzi m, baratti m, cabrini s, uber e, brighetti g, bonfa f. Prevalence of pathological gambling in patients with Parkinson’s disease.
Mov Disord. 2006;
21:2068- 2072

[5] benkelfat c, murphy dl, hill jl, george dt, nutt d, linnoila m. Ethanol like properties of the serotonergic partial agonist m-chlorophenylpiperazine in chronic alcoholic patients.
Arch Gen Psychiatry. 1991;
48:383

[6] bergh c, eklundh t, sodersten p, nordin c. Altered dopamine function in pathological gambling.
Psychol Med. 1997;
27:473- 475

[7] black dw, blum n, letuchy e, carney doebbeling c, forman-hoffman vl, doebbeling bn. Borderline personality disorder and traits in veterans: psychiatric comorbidity, healthcare utilization, and quality of life along a continuum of severity.
CNS Spectr. 2006;
11:680- 689

[8] blum k, braverman er, holder jm, lubar jf, monastra vj, et coll.. Reward deficiency syndrome: a biogenetic model for the diagnosis and treatment of impulsive, addictive, and compulsive behaviors.
J Psychoactive Drugs. 2000;
32 (Suppl):1- 112

[9] brand m, labudda k, kalbe e, hilker r, emmans d, et coll.. Decision-making impairments in patients with Parkinson’s disease.
Behav Neurol. 2004;
15:77- 85

[10] brewer ja, potenza mn. The neurobiology and genetics of impulse control disorders: Relationships to drug addictions.
Biochem Pharmacol. 2007;
75:63- 75

[11] buydens-branchey l, branchey m, fergeson p, hudson j, mckernin c. The meta-chlorophenylpiperazine challenge test in cocaine addicts: hormonal and psychological responses.
Biol Psychiatry. 1997;
41:1071- 1086

[12] cloninger cr, przybeck tr, svrakic dm, wetzel rd. The temperament and character inventory (TCI): a guide for its development and use.
Center for Psychobiology of Personality. St. Louis:1994;


[13] cohen mx, young j, baek jm, kessler c, ranganath c. Individual differences in extraversion and dopamine genetics predict neural reward responses.
Brain Res Cogn Brain Res. 2005;
25:851- 861

[14] comings de, blum k. Reward deficiency syndrome: genetic aspects of behavioral disorders.
Prog Brain Res. 2000;
126:325- 341

[15] comings de, rosenthal rj, lesieur hr, rugle lj, muhleman d, et coll.. A study of the dopamine D2 receptor gene in pathological gambling.
Pharmacogenetics. 1996;
6:223- 234

[16] comings de, gade r, wu s, chiu c, dietz g, et coll.. Studies of the potential role of the dopamine D1 receptor gene in addictive behaviors.
Mol Psychiatry. 1997;
2:44- 56

[17] comings de, gonzalez n, wu s, gade r, muhleman d, et coll.. Studies of the 48 bp repeat polymorphism of the DRD4 gene in impulsive, compulsive, addictive behaviors: Tourette syndrome, ADHD, pathological gambling, and substance abuse.
Am J Med Genet. 1999;
88:358- 368

[18] comings de, gade-andavolu r, gonzalez n, wu s, muhleman d, et coll.. The additive effect of neurotransmitter genes in pathological gambling.
Clin Genet. 2001;
60:107- 116

[19] czernecki v, pillon b, houeto jl, pochon jb, levy r, dubois b. Motivation, reward, and Parkinson’s disease: influence of dopatherapy.
Neuropsychologia. 2002;
40:2257- 2267

[20] de caria c, hollander e, nora r, stein d, simeon d, cohen i. Gambling: biological/genetic treatment, government and gambling concerns : neurobiology of pathological gambling.
Presented at the 150th Annual Meeting of the American Psychiatric Association. May 1997;
San Diego:

[21] devor ej, magee hj, dill-devor rm, gabel j, black dw. Serotonin transporter gene (5-HTT) polymorphisms and compulsive buying.
Am J Med Genet. 1999;
88:123- 125

[22] di chiara g, imperato a. Drugs abused by humans preferentially increase synaptic dopamine concentrations in the mesolimbic system of freely moving rats.
Proc Natl Acad Sci USA. 1988;
85:5274- 5278

[23] dodd ml, klos kj, bower jh, geda ye, josephs ka, ahlskog je. Pathological gambling caused by drugs used to treat Parkinson disease.
Arch Neurol. 2005;
62:1377- 1381

[24] doupouy r, chatagnon p. Le joueur, esquisse psychologique.
Annales médico-psychologiques. 1929;
12:102- 112

[25] drapier d, drapier s, sauleau p, derkinderen p, damier p, et coll.. Pathological gambling secondary to dopaminergic therapy in Parkinson’s disease.
Psychiatry Res. 2006;
144:241- 244

[26] driver-dunckley e, samanta j, stacy m. Pathological gambling associated with dopamine agonist therapy in Parkinson’s disease.
Neurology. 2003;
61:422- 423

[27] ebstein rp, novick o, umansky r, priel b, osher y, et coll.. Dopamine D4 receptor (D4DR) exon III polymorphism associated with the human personality trait of Novelty Seeking.
Nat Genet. 1996;
12:78- 80

[28] eisenberg dt, mackillop j, modi m, beauchemin j, dang d, et coll.. Examining impulsivity as an endophenotype using a behavioral approach: a DRD2 TaqI A and DRD4 48-bp VNTR association study.
Behav Brain Funct. 2007;
3:2

[29] france cj. The gambling impulse (l’impulsion au jeu de hasard).
Am J Psychol. 1902 XIII;
3:364- 408

[30] frank mj, samanta j, moustafa aa, sherman sj. Hold your horses: Impulsivity, deep brain stimulation, and medication in parkinsonism.
Science. 2007;
318:1309- 1312

[32] gschwandtner u, aston j, renaud s, fuhr p. Pathologic gambling in patients with Parkinson’s disease.
Clin Neuropharmacol. 2001;
24:170- 172

[33] hollander e, de caria c, stein d, simeon d, cohen l, hwang m, islam m. Behavioral response to m-CPP.
Biol Psychiatry. 1994;
35:426- 427

[34] ibanez a, de castro ip, fernandez-piqueras j, blanco c, saiz-ruiz j. Pathological gambling and DNA polymorphic markers at MAO-A and MAO-B genes.
Mol Psychiatry. 2000;
5:105- 109

[35] imamura a, uitti rj, wszolek zk. Dopamine agonist therapy for Parkinson disease and pathological gambling.
Parkinsonism Relat Disord. 2006;
12:506- 508

[36] kennett ga, curzon g. Evidence that mCPP may have behavioural effects mediated by central 5-HT1C receptors.
Br J Pharmacol. 1988;
94:137- 147

[37] kim sw, grant je. Personality dimensions in pathological gambling disorder and obsessive-compulsive disorder.
Psychiatry Res. 2001;
104:205- 212

[38] krueger rf, hicks bm, patrick cg, carlson rs, iacono wg, mcgue m. Etiologic connections among substance dependence, antisocial disorder and desinhibited personality: modelling the externalizing spectrum.
Journal of abnormal Psychology. 2002;
111:411- 424

[40] lanteri c, salomon l, torrens y, glowinski j, tassin jp. Drugs of abuse specifically sensitize noradrenergic and serotonergic neurons via a non-dopaminergic mechanism.
Neuropsychopharmacology. 2007 Sep 5 [Epub ahead of print];


[41] lesieur hr, blume sb, zoppa rm. Alcoholism, drug abuse, and gambling.
Alcohol Clin Exp Res. 1986;
10:33- 38

[42] meyer g, schwertfeger j, exton ms, janssen oe, knapp w, et coll.. Neuroendocrine response to casino gambling in problem gamblers.
Psychoneuroendocrinology. 2004;
29:1272- 1280

[43] miller wb, pasta dj, macmurray j, chiu c, wu h. Comings DE Dopamine receptor genes are associated with age at first sexual intercourse.
J Biosoc Sci. 1999;
31:43- 54

[44] molina ja, sainz-artiga mj, fraile a, jimenez-jimenez fj, villanueva c, et coll.. Pathologic gambling in Parkinson’s disease: a behavioral manifestation of pharmacologic treatment?.
Mov Disord. 2000;
15:869- 872

[45] montastruc jl, schmitt l, bagheri h. Pathological gambling behavior in a patient with Parkinson’s disease treated with levodopa and bromocriptine.
Rev Neurol (Paris). 2003;
159:441- 443

[46] moss hb, yao jk, panzak gl. Serotonergic responsivity and behavioral dimensions in antisocial personality disorder with substance abuse.
Biol Psychiatry. 1990;
28:325- 338

[47] nordin c, eklundh t. Tapping time at lumbar puncture is longer in pathological male gamblers than in healthy male controls.
J Psychiatr Res. 1998;
32:421- 422

[48] nordin c, sjodin i. CSF monoamine patterns in pathological gamblers and healthy controls.
J Psychiatr Res. 2006;
40:454- 459

[49] o’sullivan ss, lees aj. Pathological gambling in Parkinson’s disease.
Lancet Neurol. 2007;
6:384- 386

[50] olds j, milner p. Positive reinforcement produced by electrical stimulation of septal area and other regions of rat brain.
J Comp Physiol Psychol. 1954;
47:419- 427

[51] ondo wg, lai d. Predictors of impulsivity and reward seeking behavior with dopamine agonists.
Parkinson and related disorders. 2008;
14:28- 32

[52] pallanti s, bernardi s, quercioli l, decaria c, hollander e. Serotonin dysfunction in pathological gamblers: increased prolactin response to oral m-CPP versus placebo.
Cns Spectr. 2006;
11:956- 964

[53] perez de castro i, ibanez a, torres p, saiz-ruiz j, fernandez-piqueras j. Genetic association study between pathological gambling and a functional DNA polymorphism at the D4 receptor gene.
Pharmacogenetics. 1997;
7:345- 348

[54] perez de castro i, ibanez a, saiz-ruiz j, fernandez-piqueras j. Genetic contribution to pathological gambling: possible association between a functional DNA polymorphism at the serotonin transporter gene (5-HTT) and affected men.
Pharmacogenetics. 1999;
9:397- 400

[55] perez de castro i, ibanez a, saiz-ruiz j, fernandez-piqueras j. Concurrent positive association between pathological gambling and functional DNA polymorphisms at the MAO-A and the 5-HT transporter genes.
Mol Psychiatry. 2002;
7:927- 928

[56] perretta jg, pari g, beninger rj. Effects of Parkinson disease on two putative nondeclarative learning tasks: probabilistic classification and gambling.
Cogn Behav Neurol. 2005;
18:185- 192

[57] potenza mn. Advancing treatment strategies for pathological gambling.
J Gambl Stud. 2005;
21:91- 100

[58] reuter j, raedler t, rose m, hand i, gläscher j, büchel c. Pathological gambling is linked to reduced activation of the mesolimbic reward system.
Nat Neurosci. 2005;
8:147- 148

[59] roy a, adinoff b, roehrich l, lamparski d, custer r, et coll.. Pathological gambling. A psychobiological study.
Arch Gen Psychiatry. 1988;
45:369- 373

[60] roy a, dejong j, ferraro t, adinoff b, gold p, et coll.. CSF GABA and neuropeptides in pathological gamblers and normal controls.
Psychiatry Res. 1989;
30:137- 144

[61] ruchkin vv, koposov ra, af klinteberg b, oreland l, grigorenko el. Platelet MAO-B, personality, and psychopathology.
J Abnorm Psychol. 2005;
114:477- 482

[62] salomon l, lanteri c, glowinski j, tassin jp. Behavioral sensitization to amphetamine results from an uncoupling between noradrenergic and serotonergic neurons.
Proc Natl Acad Sci USA. 2006;
103:7476- 7581

[63] scherrer jf, xian h, kapp jm, waterman b, shah kr, et coll.. Association between exposure to childhood and lifetime traumatic events and lifetime pathological gambling in a twin cohort.
J Nerv Ment Dis. 2007;
195:72- 78

[64] seedat s, kesler s, niehaus dj, stein dj. Pathological gambling behaviour: emergence secondary to treatment of Parkinson’s disease with dopaminergic agents.
Depress Anxiety. 2000;
11:185- 186

[65] sevincok l, akoglu a, akyol a. Quetiapine in a case with Parkinson disease and pathological gambling.
J Clin Psychopharmacol. 2007;
27:107- 108

[66] shinohara k, yanagisawa a, kagota y, gomi a, nemoto k, et coll.. Physiological changes in Pachinko players; beta-endorphin, catecholamines, immune system substances and heart rate.
Appl Human Sci. 1999;
18:37- 42

[67] slutske ws, eisen s, true wr, lyons mj, goldberg j, tsuang m. Common genetic vulnerability for pathological gambling and alcohol dependence in men.
Arch Gen Psychiatry. 2000;
57:666- 673

[68] smeding hm, goudriaan ae, foncke em, schuurman pr, speelman jd, schmand b. Pathological gambling after bilateral subthalamic nucleus stimulation in Parkinson disease.
J Neurol Neurosurg Psychiatry. 2007;
78:517- 519

[69] staner l, mendlewicz j. Heredity and role of serotonin in aggressive impulsive behavior.
Encephale. 1998;
24:355- 364

[70] stojanov w, karayanidis f, johnston p, bailey a, carr v, schall u. Disrupted sensory gating in pathological gambling.
Biol Psychiatry. 2003;
54:474- 484

[71] tassin jp. Uncoupling between noradrenergic and serotonergic neurons as a molecular basis of stable changes in behavior induced by repeated drugs of abuse.
Biochem Pharmacol. 2008;
75:85- 97

[72] tippmann-peikert m, park jg, boeve bf, shepard jw, silber mh. Pathologic gambling in patients with restless legs syndrome treated with dopaminergic agonists.
Neurology. 2007;
68:301- 303

[73] van craenenbroeck k, de bosscher k, vanden berghe w, vanhoenacker p, haegeman g. Role of glucocorticoids in dopamine-related neuropsychiatric disorders.
Mol Cell Endocrinol. 2005;
245:10- 22

[74] voon v, hassan k, zurowski m, duff-canning s, de souza m, et coll.. Prospective prevalence of pathologic gambling and medication association in Parkinson disease.
Neurology. 2006;
66:1750- 1752

[75] voon v, thomsen t, miyasaki jm, de souza m, shafro a, et coll.. Factors associated with dopaminergic drug-related pathological gambling in Parkinson disease.
Arch Neurol. 2007;
64:212- 216

[76] weintraub d, siderowf ad, potenza mn, goveas j, morales kh, et coll.. Association of dopamine agonist use with impulse control disorders in Parkinson disease.
Arch Neurol. 2006;
63:969- 973

[77] witjas t, baunez c, henry jm, delfini m, regis j, et coll.. Addiction in Parkinson’s disease: impact of subthalamic nucleus deep brain stimulation.
Mov Disord. 2005;
20:1052- 1055

[78] zack m, poulos cx. Amphetamine primes motivation to gamble and gambling-related semantic networks in problem gamblers.
Neuropsychopharmacology. 2004;
29:195- 207

[79] zack m, poulos cx. A D2 Antagonist enhances the rewarding and priming effects of a gambling episode in pathological gamblers.
Neuropsychopharmacology. 2007;
32:1678- 1686

[80] zarow c, lyness sa, mortimer ja, chui hc. Neuronal loss is greater in the locus coeruleus than nucleus basalis and substantia nigra in Alzheimer and Parkinson diseases.
Arch Neurol. 2003;
60:337- 341

[81] zuckerman m. Impulsive sensation seeking and its behavioural, psychophysiological and biochemical correlates.
Neuropsychobiology. 1993;
28:30- 36

→ Aller vers SYNTHESE