Approches psychologiques et neurophysiologique
2008
| ANALYSE |
8-
Apport des neurosciences
Les neurosciences apportent une connaissance sur « les bases neuronales de… » en raison de la thèse défendue selon laquelle rien de ce qui fait l’activité d’un individu n’a de traduction cérébrale. Si cette activité relève du « normal », elle ne laissera que des traces éphémères ou mémorielles. Si cette activité met en cause l’équilibre, menace l’intégrité du sujet, ou provoque des traumas, alors le système nerveux s’en trouvera affecté à des degrés divers, pour le court ou le long terme. Le dysfonctionnement cérébral agira pour son propre compte et induira des symptômes, permanents ou intermittents. La réparation ou le traitement des dysfonctionnements – objet de la psychiatrie et de la neurologie – aura pour objet de rétablir la relation structure/fonction dans le cadre d’une normalité théorique. Comme pour tout organe, à cerveau « normal » correspondent des activités normales chez les individus, à cerveau en état de « dysfonction » ou atteint correspondent des activités « anormales » ou pathologiques. Ce qui maintient le normal ou induit des dysfonctions relève de causes endogènes, exogènes, génétiques ou environnementales. Le principe à l’œuvre concerne la relation entre normal et pathologique, étayé depuis Claude Bernard dans « Introduction à l’étude expérimentale » (1865 ) puis par Cannon et le concept d’homéostasie et ses dérèglements (1935
) puis par Cannon et le concept d’homéostasie et ses dérèglements (1935 ), enfin et surtout par Canguilhem (1979
), enfin et surtout par Canguilhem (1979 ). La normalité est étayée par de multiples constantes et les variabilités admises, par des examens étalonnés et approuvés par la pratique, par la nature même de l’examen clinique. La subjectivité inhérente à l’examen en psychiatrie – seule discipline médicale sans examen complémentaire – est grandement encadrée par une approche raisonnée et scientifique de la symptomatologie : entre donc dans le champ médical ce qui s’écarte pour le malade de sa normalité au point de réduire l’une ou l’autre des activités mentales ou physiques et ses capacités adaptatives. La pathologie est la science (médicale pour ce qui concerne l’humain) des maladies ; la maladie est une altération de la santé qui de ce fait, rend une aide médicale souhaitable ou nécessaire. L’addiction est une maladie chronique à rechutes (Mc Lellan et coll., 2000
). La normalité est étayée par de multiples constantes et les variabilités admises, par des examens étalonnés et approuvés par la pratique, par la nature même de l’examen clinique. La subjectivité inhérente à l’examen en psychiatrie – seule discipline médicale sans examen complémentaire – est grandement encadrée par une approche raisonnée et scientifique de la symptomatologie : entre donc dans le champ médical ce qui s’écarte pour le malade de sa normalité au point de réduire l’une ou l’autre des activités mentales ou physiques et ses capacités adaptatives. La pathologie est la science (médicale pour ce qui concerne l’humain) des maladies ; la maladie est une altération de la santé qui de ce fait, rend une aide médicale souhaitable ou nécessaire. L’addiction est une maladie chronique à rechutes (Mc Lellan et coll., 2000 ). Aux symptômes cliniques correspondent des désordres neurologiques et les neurosciences permettent de décrire la neuro-physio-pathologie de la maladie selon l’hypothèse qu’à tout symptôme correspond un désordre neuronal qui en est la cause. Examinée dans ses aspects médicaux, l’addiction est une branche de la psychiatrie dont elle adopte le modèle médical. Il va sans dire que l’addiction est étudiée par de nombreuses autres branches du savoir (histoire, économie, épidémiologie, sociologie…). La psychiatrie est concernée par les dysfonctionnements d’un organe (le cerveau) dont certains définissent l’Addiction.
). Aux symptômes cliniques correspondent des désordres neurologiques et les neurosciences permettent de décrire la neuro-physio-pathologie de la maladie selon l’hypothèse qu’à tout symptôme correspond un désordre neuronal qui en est la cause. Examinée dans ses aspects médicaux, l’addiction est une branche de la psychiatrie dont elle adopte le modèle médical. Il va sans dire que l’addiction est étudiée par de nombreuses autres branches du savoir (histoire, économie, épidémiologie, sociologie…). La psychiatrie est concernée par les dysfonctionnements d’un organe (le cerveau) dont certains définissent l’Addiction.
 ) puis par Cannon et le concept d’homéostasie et ses dérèglements (1935
) puis par Cannon et le concept d’homéostasie et ses dérèglements (1935 ), enfin et surtout par Canguilhem (1979
), enfin et surtout par Canguilhem (1979 ). La normalité est étayée par de multiples constantes et les variabilités admises, par des examens étalonnés et approuvés par la pratique, par la nature même de l’examen clinique. La subjectivité inhérente à l’examen en psychiatrie – seule discipline médicale sans examen complémentaire – est grandement encadrée par une approche raisonnée et scientifique de la symptomatologie : entre donc dans le champ médical ce qui s’écarte pour le malade de sa normalité au point de réduire l’une ou l’autre des activités mentales ou physiques et ses capacités adaptatives. La pathologie est la science (médicale pour ce qui concerne l’humain) des maladies ; la maladie est une altération de la santé qui de ce fait, rend une aide médicale souhaitable ou nécessaire. L’addiction est une maladie chronique à rechutes (Mc Lellan et coll., 2000
). La normalité est étayée par de multiples constantes et les variabilités admises, par des examens étalonnés et approuvés par la pratique, par la nature même de l’examen clinique. La subjectivité inhérente à l’examen en psychiatrie – seule discipline médicale sans examen complémentaire – est grandement encadrée par une approche raisonnée et scientifique de la symptomatologie : entre donc dans le champ médical ce qui s’écarte pour le malade de sa normalité au point de réduire l’une ou l’autre des activités mentales ou physiques et ses capacités adaptatives. La pathologie est la science (médicale pour ce qui concerne l’humain) des maladies ; la maladie est une altération de la santé qui de ce fait, rend une aide médicale souhaitable ou nécessaire. L’addiction est une maladie chronique à rechutes (Mc Lellan et coll., 2000 ). Aux symptômes cliniques correspondent des désordres neurologiques et les neurosciences permettent de décrire la neuro-physio-pathologie de la maladie selon l’hypothèse qu’à tout symptôme correspond un désordre neuronal qui en est la cause. Examinée dans ses aspects médicaux, l’addiction est une branche de la psychiatrie dont elle adopte le modèle médical. Il va sans dire que l’addiction est étudiée par de nombreuses autres branches du savoir (histoire, économie, épidémiologie, sociologie…). La psychiatrie est concernée par les dysfonctionnements d’un organe (le cerveau) dont certains définissent l’Addiction.
). Aux symptômes cliniques correspondent des désordres neurologiques et les neurosciences permettent de décrire la neuro-physio-pathologie de la maladie selon l’hypothèse qu’à tout symptôme correspond un désordre neuronal qui en est la cause. Examinée dans ses aspects médicaux, l’addiction est une branche de la psychiatrie dont elle adopte le modèle médical. Il va sans dire que l’addiction est étudiée par de nombreuses autres branches du savoir (histoire, économie, épidémiologie, sociologie…). La psychiatrie est concernée par les dysfonctionnements d’un organe (le cerveau) dont certains définissent l’Addiction.Les neurosciences des addictions sont par essence expérimentales, ce qui veut dire qu’elles ont recours à des préparations animales représentées essentiellement par les rongeurs, le rat, la souris. Ces préparations sont moléculaires ou cellulaires ou correspondent à des « modèles animaux » mis en situation de consommation (de drogue essentiellement ; il n’y a pas encore de modèles pour les addictions sans drogue). Les animaux s’auto-administrent toutes les drogues que consomment les humains car elles sont appétitives. Les questions posées tournent autour de l’analogie faite entre les deux espèces et de savoir si ces modèles rongeurs sont des modèles d’addiction. Deux paradigmes opposés sont ici en jeu (Le Moal et Koob, 2007 ). Le clinicien considère le malade (addict) dans son histoire ; il est confronté au principe fondamental des différences inter--individuelles et il sait que certains individus peu à peu s’engageront dans le processus addictif, alors que d’autres, pour des consommations au départ similaires, garderont un contrôle sur leurs conduites. Les sources de ces différences, les vulnérabilités en cause, font partie du diagnostic clinique et du traitement et correspondent aux comorbidités psychopathologiques et même à des vulnérabilités génétiques (voir plus loin). L’action propre des objets de consommation se surajoute aux conditions du « terrain » de l’individu, quitte à le transformer. En bref cette approche est historique, centrée sur l’individu. Le second paradigme est celui qui gouverne la recherche expérimentale. Ce n’est pas l’individu qui est l’intérêt de la recherche mais les effets propres de l’objet, par exemple d’une drogue dans une perspective de neuropharmacologie du comportement ; ces effets sont alors aisément étudiés jusqu’aux niveaux cellulaires ou moléculaires : l’animal – en fait le groupe d’animaux – est par définition a-historique et n’est considéré que par comparaison avec un groupe dit témoin engagé parallèlement dans le protocole expérimental. Cette approche est centrée sur la recherche des actions diverses de la drogue. Ce n’est que ces dernières années que deux groupes de chercheurs ont tenté, à partir de ce paradigme, d’obtenir un modèle d’addiction caractérisé par un accroissement de la consommation avec le temps résultant d’une perte de contrôle et d’une compulsivité (Ahmed et Koob, 1998
). Le clinicien considère le malade (addict) dans son histoire ; il est confronté au principe fondamental des différences inter--individuelles et il sait que certains individus peu à peu s’engageront dans le processus addictif, alors que d’autres, pour des consommations au départ similaires, garderont un contrôle sur leurs conduites. Les sources de ces différences, les vulnérabilités en cause, font partie du diagnostic clinique et du traitement et correspondent aux comorbidités psychopathologiques et même à des vulnérabilités génétiques (voir plus loin). L’action propre des objets de consommation se surajoute aux conditions du « terrain » de l’individu, quitte à le transformer. En bref cette approche est historique, centrée sur l’individu. Le second paradigme est celui qui gouverne la recherche expérimentale. Ce n’est pas l’individu qui est l’intérêt de la recherche mais les effets propres de l’objet, par exemple d’une drogue dans une perspective de neuropharmacologie du comportement ; ces effets sont alors aisément étudiés jusqu’aux niveaux cellulaires ou moléculaires : l’animal – en fait le groupe d’animaux – est par définition a-historique et n’est considéré que par comparaison avec un groupe dit témoin engagé parallèlement dans le protocole expérimental. Cette approche est centrée sur la recherche des actions diverses de la drogue. Ce n’est que ces dernières années que deux groupes de chercheurs ont tenté, à partir de ce paradigme, d’obtenir un modèle d’addiction caractérisé par un accroissement de la consommation avec le temps résultant d’une perte de contrôle et d’une compulsivité (Ahmed et Koob, 1998 ; Vanderschuren et Everitt, 2004
; Vanderschuren et Everitt, 2004 ). Cependant, une seule publication combine, après une consommation prolongée, les différences inter-individuelles et l’apparition chez un pourcentage réduit d’animaux (comme dans la vie réelle) de signes cardinaux de l’addiction humaine (Deroche-Gamonet et coll., 2004
). Cependant, une seule publication combine, après une consommation prolongée, les différences inter-individuelles et l’apparition chez un pourcentage réduit d’animaux (comme dans la vie réelle) de signes cardinaux de l’addiction humaine (Deroche-Gamonet et coll., 2004 ) ; ce modèle serait, en toute rigueur, le seul valide.
) ; ce modèle serait, en toute rigueur, le seul valide.
 ). Le clinicien considère le malade (addict) dans son histoire ; il est confronté au principe fondamental des différences inter--individuelles et il sait que certains individus peu à peu s’engageront dans le processus addictif, alors que d’autres, pour des consommations au départ similaires, garderont un contrôle sur leurs conduites. Les sources de ces différences, les vulnérabilités en cause, font partie du diagnostic clinique et du traitement et correspondent aux comorbidités psychopathologiques et même à des vulnérabilités génétiques (voir plus loin). L’action propre des objets de consommation se surajoute aux conditions du « terrain » de l’individu, quitte à le transformer. En bref cette approche est historique, centrée sur l’individu. Le second paradigme est celui qui gouverne la recherche expérimentale. Ce n’est pas l’individu qui est l’intérêt de la recherche mais les effets propres de l’objet, par exemple d’une drogue dans une perspective de neuropharmacologie du comportement ; ces effets sont alors aisément étudiés jusqu’aux niveaux cellulaires ou moléculaires : l’animal – en fait le groupe d’animaux – est par définition a-historique et n’est considéré que par comparaison avec un groupe dit témoin engagé parallèlement dans le protocole expérimental. Cette approche est centrée sur la recherche des actions diverses de la drogue. Ce n’est que ces dernières années que deux groupes de chercheurs ont tenté, à partir de ce paradigme, d’obtenir un modèle d’addiction caractérisé par un accroissement de la consommation avec le temps résultant d’une perte de contrôle et d’une compulsivité (Ahmed et Koob, 1998
). Le clinicien considère le malade (addict) dans son histoire ; il est confronté au principe fondamental des différences inter--individuelles et il sait que certains individus peu à peu s’engageront dans le processus addictif, alors que d’autres, pour des consommations au départ similaires, garderont un contrôle sur leurs conduites. Les sources de ces différences, les vulnérabilités en cause, font partie du diagnostic clinique et du traitement et correspondent aux comorbidités psychopathologiques et même à des vulnérabilités génétiques (voir plus loin). L’action propre des objets de consommation se surajoute aux conditions du « terrain » de l’individu, quitte à le transformer. En bref cette approche est historique, centrée sur l’individu. Le second paradigme est celui qui gouverne la recherche expérimentale. Ce n’est pas l’individu qui est l’intérêt de la recherche mais les effets propres de l’objet, par exemple d’une drogue dans une perspective de neuropharmacologie du comportement ; ces effets sont alors aisément étudiés jusqu’aux niveaux cellulaires ou moléculaires : l’animal – en fait le groupe d’animaux – est par définition a-historique et n’est considéré que par comparaison avec un groupe dit témoin engagé parallèlement dans le protocole expérimental. Cette approche est centrée sur la recherche des actions diverses de la drogue. Ce n’est que ces dernières années que deux groupes de chercheurs ont tenté, à partir de ce paradigme, d’obtenir un modèle d’addiction caractérisé par un accroissement de la consommation avec le temps résultant d’une perte de contrôle et d’une compulsivité (Ahmed et Koob, 1998 ; Vanderschuren et Everitt, 2004
; Vanderschuren et Everitt, 2004 ). Cependant, une seule publication combine, après une consommation prolongée, les différences inter-individuelles et l’apparition chez un pourcentage réduit d’animaux (comme dans la vie réelle) de signes cardinaux de l’addiction humaine (Deroche-Gamonet et coll., 2004
). Cependant, une seule publication combine, après une consommation prolongée, les différences inter-individuelles et l’apparition chez un pourcentage réduit d’animaux (comme dans la vie réelle) de signes cardinaux de l’addiction humaine (Deroche-Gamonet et coll., 2004 ) ; ce modèle serait, en toute rigueur, le seul valide.
) ; ce modèle serait, en toute rigueur, le seul valide.Processus addictif
Considérant l’évolution des manifestations phénotypiques et les changements cérébraux, le clinicien est confronté à la nécessité de définir précisément le stade du processus auquel il est référé et, en termes adéquats, les manifestations comportementales propres à ce stade. Quelques aspects particuliers doivent être abordés. Tout d’abord, de nombreuses addictions sont décrites et étudiées en fonction des différents objets addictogènes, les drogues et les conduites se rapportant au jeu, sexe, boulimie… Du point de vue des neurosciences, il convient d’examiner si elles ont des bases neurobiologiques communes. Ensuite, le processus suit une évolution propre à chaque individu. Différentes voies de consommation (un objet d’addiction est toujours un objet de consommation) sont classiquement décrites : expérimentale, sociale, circonstancielle, intensifiée et impulsive, compulsive. Le passage d’un niveau de consommation à un autre concerne de moins en moins d’individus, et très peu, quel que soit l’objet, succomberont à une consommation compulsive, c’est-à-dire l’addiction. À chaque niveau d’intoxication ou de consommation correspondra un état cérébral particulier. Le dernier stade, ultime, de la maladie chronique à rechute caractérisant l’addiction présentera des modifications anatomo-fonctionnelles chroniques voire permanentes, même après arrêt plus ou moins long de la consommation. Enfin, il faut comprendre pourquoi certains sujets succombent et d’autres pas (jusqu’à une résilience apparente). Cette question concerne l’existence d’une vulnérabilité potentielle, et de la mise en évidence de sa traduction neurobiologique.
Cette vulnérabilité ne concerne pas seulement le fait généralement admis selon lequel un sujet développera d’autant plus aisément d’autres addictions qu’il ait auparavant succombé pour un objet donné ; une interchangeabilité des objets est classiquement observée. De plus, des symptômes propres à au moins une condition psychiatrique majeure ou à des troubles du comportement caractérisés sont présents, tels les désordres affectifs, les troubles de l’attention… Il est bien établi que nombre de ces troubles précèdent les premières consommations et sont observés dès le jeune âge, sans oublier le rôle des environnements familiaux et socioéconomiques (pour revue voir Goodman, 2008 ). Vulnérabilité et comorbidité ont des traductions neurobiologiques. L’imagerie cérébrale a enrichi ces dernières années les connaissances physiopathologiques pouvant correspondre à des signes cliniques, mais les progrès à accomplir sont énormes avant d’en faire des données scientifiques de référence. Cependant, par essence, ces modifications cérébrales existent nécessairement et rendent parfois problématiques les nombreuses données obtenues pour les addictions et les interprétations. Une surimposition et une addition de différentes atteintes existent, celles qui préexistaient (comorbidité) et celles induites par la consommation de l’objet.
). Vulnérabilité et comorbidité ont des traductions neurobiologiques. L’imagerie cérébrale a enrichi ces dernières années les connaissances physiopathologiques pouvant correspondre à des signes cliniques, mais les progrès à accomplir sont énormes avant d’en faire des données scientifiques de référence. Cependant, par essence, ces modifications cérébrales existent nécessairement et rendent parfois problématiques les nombreuses données obtenues pour les addictions et les interprétations. Une surimposition et une addition de différentes atteintes existent, celles qui préexistaient (comorbidité) et celles induites par la consommation de l’objet.
 ). Vulnérabilité et comorbidité ont des traductions neurobiologiques. L’imagerie cérébrale a enrichi ces dernières années les connaissances physiopathologiques pouvant correspondre à des signes cliniques, mais les progrès à accomplir sont énormes avant d’en faire des données scientifiques de référence. Cependant, par essence, ces modifications cérébrales existent nécessairement et rendent parfois problématiques les nombreuses données obtenues pour les addictions et les interprétations. Une surimposition et une addition de différentes atteintes existent, celles qui préexistaient (comorbidité) et celles induites par la consommation de l’objet.
). Vulnérabilité et comorbidité ont des traductions neurobiologiques. L’imagerie cérébrale a enrichi ces dernières années les connaissances physiopathologiques pouvant correspondre à des signes cliniques, mais les progrès à accomplir sont énormes avant d’en faire des données scientifiques de référence. Cependant, par essence, ces modifications cérébrales existent nécessairement et rendent parfois problématiques les nombreuses données obtenues pour les addictions et les interprétations. Une surimposition et une addition de différentes atteintes existent, celles qui préexistaient (comorbidité) et celles induites par la consommation de l’objet.Le processus addictif, comme tout trouble psychiatrique, doit être examiné dans une perspective vie entière et en raison d’une diathèse précoce à considérer dès le développement (Le Moal et Koob, 2007 ; Koob et Le Moal, 2008
; Koob et Le Moal, 2008 ).
).
 ; Koob et Le Moal, 2008
; Koob et Le Moal, 2008 ).
).À terme, les neurosciences participeront – les techniques aidant – au dépistage des états prémorbides. Il faut rappeler que la plupart des maladies neurologiques ont des signes neuropathologiques bien avant qu’apparaissent les premiers symptômes ou manifestations comportementales. Il est maintenant admis que les désordres addictifs partagent un processus biopsychologique sous-jacent. Il serait souhaitable d’écrire addiction (a) lorsqu’il s’agit d’une addiction à (objet) et Addiction (A) lorsque l’on caractérise la maladie chronique à rechute et le syndrome commun à toutes les addictions (Koob et Le Moal, 1997 et 2006
et 2006 ). La co-occurrence des désordres psychiatriques à des taux élevés suggère que ces désordres sont bien des indicateurs de facteurs latents ou de processus physiopathologiques qui vont sous-tendre des conditions pathologiques diverses, dont l’Addiction (Shaffer et coll., 2004
). La co-occurrence des désordres psychiatriques à des taux élevés suggère que ces désordres sont bien des indicateurs de facteurs latents ou de processus physiopathologiques qui vont sous-tendre des conditions pathologiques diverses, dont l’Addiction (Shaffer et coll., 2004 ).
).
 et 2006
et 2006 ). La co-occurrence des désordres psychiatriques à des taux élevés suggère que ces désordres sont bien des indicateurs de facteurs latents ou de processus physiopathologiques qui vont sous-tendre des conditions pathologiques diverses, dont l’Addiction (Shaffer et coll., 2004
). La co-occurrence des désordres psychiatriques à des taux élevés suggère que ces désordres sont bien des indicateurs de facteurs latents ou de processus physiopathologiques qui vont sous-tendre des conditions pathologiques diverses, dont l’Addiction (Shaffer et coll., 2004 ).
).Leur détection et leur analyse en termes neurobiologiques permettent de mieux comprendre les facteurs de vulnérabilité en psychiatrie (Krueger et coll., 1998 ; Krueger, 1999
; Krueger, 1999 ), et plus précisément de proposer une théorie neurobiologique des processus qui sous-tendent l’Addiction.
), et plus précisément de proposer une théorie neurobiologique des processus qui sous-tendent l’Addiction.
 ; Krueger, 1999
; Krueger, 1999 ), et plus précisément de proposer une théorie neurobiologique des processus qui sous-tendent l’Addiction.
), et plus précisément de proposer une théorie neurobiologique des processus qui sous-tendent l’Addiction.
Caractéristiques biologiques du processus
Le processus est représenté dans la figure 8.1.
Pour des raisons intrinsèques de vulnérabilité, des environnements délétères, des caractéristiques socioéconomiques peu favorables, des relations familiales pauvres, tout ce qui provoque du stress dont les conséquences hormonales et neurobiologiques favorisent des désordres psychopathologiques, mais également certaines variables génétiques, la rencontre avec l’objet, en principe agréable, aura des effets particuliers propres à enclencher la répétition de la conduite. Il faut remarquer que les facteurs génétiques, trop souvent avancés, concernent des facteurs généraux de vulnérabilité neurobiologique. Il n’y a pas une vulnérabilité génétique à l’Addiction ou à l’une ou l’autre des addictions ; cependant ces facteurs peuvent favoriser la poursuite du processus.
L’usage occasionnel mais limité de l’objet ayant une particularité addictogène est distinct de l’émergence d’un usage chronique et d’Addiction. Les neuroadaptations résultant de ces différents usages, au sein de circuits spécifiques, sont de mieux en mieux connus, ainsi que les transitions d’un état à un autre. Le passage est cliniquement caractérisé par une perte progressive du contrôle sur la conduite consommatoire, la plongée dans une spirale aliénante centrée sur le seul objet, une pratique compulsive de la recherche de l’objet et de sa consommation en dépit des conséquences graves pouvant survenir à l’individu et à son entourage et le développement d’un état affectif négatif qui précipite la rechute (Koob et Le Moal, 1997 ; Goodman, 2008
; Goodman, 2008 ). Un élément majeur du processus addictif est la désactivation des systèmes motivationnels naturels de telle sorte que le fonctionnement normal des systèmes de récompense est compromis et que des systèmes anti--récompense sont recrutés (Koob et Le Moal, 2008
). Un élément majeur du processus addictif est la désactivation des systèmes motivationnels naturels de telle sorte que le fonctionnement normal des systèmes de récompense est compromis et que des systèmes anti--récompense sont recrutés (Koob et Le Moal, 2008 ).
).
 ; Goodman, 2008
; Goodman, 2008 ). Un élément majeur du processus addictif est la désactivation des systèmes motivationnels naturels de telle sorte que le fonctionnement normal des systèmes de récompense est compromis et que des systèmes anti--récompense sont recrutés (Koob et Le Moal, 2008
). Un élément majeur du processus addictif est la désactivation des systèmes motivationnels naturels de telle sorte que le fonctionnement normal des systèmes de récompense est compromis et que des systèmes anti--récompense sont recrutés (Koob et Le Moal, 2008 ).
).L’état motivationnel varie avec le niveau d’activation du sujet ; il guide le comportement en relation avec les changements de l’environnement interne (états motivationnels et pulsions centraux) ou externe (incitations variées) et donc évolue sans cesse dans le temps ; il est inextricablement lié avec les états hédoniques, affectifs, émotionnels (pour définitions voir Winkielman et coll., 2007 ) présents dans l’Addiction. La motivation est une fonction organismique fondamentale de l’individu ayant pour but de produire une activité organisée. Elle inclut d’une part le moteur et sa cohérence, et d’autre part le motif, le but, l’insertion dans l’histoire, la prise de décision, la volonté. Il est important de comprendre que ces états affectifs, dès leur initiation par le système nerveux, sont automatiquement modulés par des mécanismes centraux opposants afin de réduire leur intensité (Solomon et Corbit, 1974
) présents dans l’Addiction. La motivation est une fonction organismique fondamentale de l’individu ayant pour but de produire une activité organisée. Elle inclut d’une part le moteur et sa cohérence, et d’autre part le motif, le but, l’insertion dans l’histoire, la prise de décision, la volonté. Il est important de comprendre que ces états affectifs, dès leur initiation par le système nerveux, sont automatiquement modulés par des mécanismes centraux opposants afin de réduire leur intensité (Solomon et Corbit, 1974 ; Solomon, 1980
; Solomon, 1980 ). En d’autres termes, une réponse hédonique positive ou négative déclenchée par des stimuli ou des représentations (Koob et Le Moal, 2008
). En d’autres termes, une réponse hédonique positive ou négative déclenchée par des stimuli ou des représentations (Koob et Le Moal, 2008 ), corrélée avec leur intensité et leur durée sera suivie par une réaction, contraire donc, lente d’apparition, retardée, et de plus longue durée. Concrètement, considérant les systèmes motivationnels centraux, l’effet initial et immédiat de l’objet (addictogène pour certains sujets uniquement, voir plus haut) est « opposé », contrecarré par des changements homéostatiques dans le cerveau, à la manière d’un feedback négatif qui va s’opposer à l’état affectif initial déclenché par l’objet afin de rétablir un équilibre homéostatique (Poulos et Capell, 1991
), corrélée avec leur intensité et leur durée sera suivie par une réaction, contraire donc, lente d’apparition, retardée, et de plus longue durée. Concrètement, considérant les systèmes motivationnels centraux, l’effet initial et immédiat de l’objet (addictogène pour certains sujets uniquement, voir plus haut) est « opposé », contrecarré par des changements homéostatiques dans le cerveau, à la manière d’un feedback négatif qui va s’opposer à l’état affectif initial déclenché par l’objet afin de rétablir un équilibre homéostatique (Poulos et Capell, 1991 ; Koob et Le Moal, 2008
; Koob et Le Moal, 2008 ). Le fait essentiel est que si l’effet initial, de nature inconditionnelle, perdure sans changement pour chaque consommation, l’effet opposé, conditionné donc car déclenché par l’effet initial, se sensibilise peu à peu, s’accroît en intensité et durée au point d’être de plus en plus présent dans le temps (Larcher et coll., 1998
). Le fait essentiel est que si l’effet initial, de nature inconditionnelle, perdure sans changement pour chaque consommation, l’effet opposé, conditionné donc car déclenché par l’effet initial, se sensibilise peu à peu, s’accroît en intensité et durée au point d’être de plus en plus présent dans le temps (Larcher et coll., 1998 ; Laulin et coll., 1999
; Laulin et coll., 1999 ; Célérier et coll., 2001
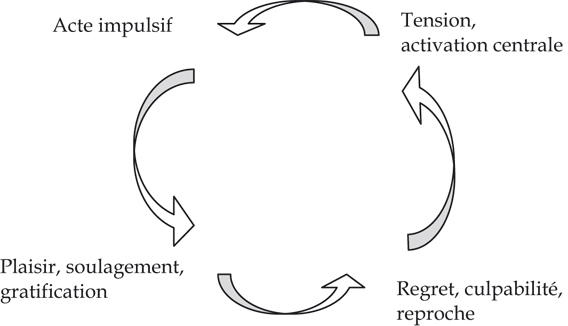
; Célérier et coll., 2001 ). L’euphorie, l’effet hédonique positif, va se réduire en intensité, dominé peu à peu par un état émotionnel aversif-négatif de plus en plus présent dans la vie du sujet. À un stade avancé d’une pratique consommatoire qui devient de plus en plus impulsive, l’individu s’installe dans une spirale (figure 8.2).
). L’euphorie, l’effet hédonique positif, va se réduire en intensité, dominé peu à peu par un état émotionnel aversif-négatif de plus en plus présent dans la vie du sujet. À un stade avancé d’une pratique consommatoire qui devient de plus en plus impulsive, l’individu s’installe dans une spirale (figure 8.2).
 ) présents dans l’Addiction. La motivation est une fonction organismique fondamentale de l’individu ayant pour but de produire une activité organisée. Elle inclut d’une part le moteur et sa cohérence, et d’autre part le motif, le but, l’insertion dans l’histoire, la prise de décision, la volonté. Il est important de comprendre que ces états affectifs, dès leur initiation par le système nerveux, sont automatiquement modulés par des mécanismes centraux opposants afin de réduire leur intensité (Solomon et Corbit, 1974
) présents dans l’Addiction. La motivation est une fonction organismique fondamentale de l’individu ayant pour but de produire une activité organisée. Elle inclut d’une part le moteur et sa cohérence, et d’autre part le motif, le but, l’insertion dans l’histoire, la prise de décision, la volonté. Il est important de comprendre que ces états affectifs, dès leur initiation par le système nerveux, sont automatiquement modulés par des mécanismes centraux opposants afin de réduire leur intensité (Solomon et Corbit, 1974 ; Solomon, 1980
; Solomon, 1980 ). En d’autres termes, une réponse hédonique positive ou négative déclenchée par des stimuli ou des représentations (Koob et Le Moal, 2008
). En d’autres termes, une réponse hédonique positive ou négative déclenchée par des stimuli ou des représentations (Koob et Le Moal, 2008 ), corrélée avec leur intensité et leur durée sera suivie par une réaction, contraire donc, lente d’apparition, retardée, et de plus longue durée. Concrètement, considérant les systèmes motivationnels centraux, l’effet initial et immédiat de l’objet (addictogène pour certains sujets uniquement, voir plus haut) est « opposé », contrecarré par des changements homéostatiques dans le cerveau, à la manière d’un feedback négatif qui va s’opposer à l’état affectif initial déclenché par l’objet afin de rétablir un équilibre homéostatique (Poulos et Capell, 1991
), corrélée avec leur intensité et leur durée sera suivie par une réaction, contraire donc, lente d’apparition, retardée, et de plus longue durée. Concrètement, considérant les systèmes motivationnels centraux, l’effet initial et immédiat de l’objet (addictogène pour certains sujets uniquement, voir plus haut) est « opposé », contrecarré par des changements homéostatiques dans le cerveau, à la manière d’un feedback négatif qui va s’opposer à l’état affectif initial déclenché par l’objet afin de rétablir un équilibre homéostatique (Poulos et Capell, 1991 ; Koob et Le Moal, 2008
; Koob et Le Moal, 2008 ). Le fait essentiel est que si l’effet initial, de nature inconditionnelle, perdure sans changement pour chaque consommation, l’effet opposé, conditionné donc car déclenché par l’effet initial, se sensibilise peu à peu, s’accroît en intensité et durée au point d’être de plus en plus présent dans le temps (Larcher et coll., 1998
). Le fait essentiel est que si l’effet initial, de nature inconditionnelle, perdure sans changement pour chaque consommation, l’effet opposé, conditionné donc car déclenché par l’effet initial, se sensibilise peu à peu, s’accroît en intensité et durée au point d’être de plus en plus présent dans le temps (Larcher et coll., 1998 ; Laulin et coll., 1999
; Laulin et coll., 1999 ; Célérier et coll., 2001
; Célérier et coll., 2001 ). L’euphorie, l’effet hédonique positif, va se réduire en intensité, dominé peu à peu par un état émotionnel aversif-négatif de plus en plus présent dans la vie du sujet. À un stade avancé d’une pratique consommatoire qui devient de plus en plus impulsive, l’individu s’installe dans une spirale (figure 8.2).
). L’euphorie, l’effet hédonique positif, va se réduire en intensité, dominé peu à peu par un état émotionnel aversif-négatif de plus en plus présent dans la vie du sujet. À un stade avancé d’une pratique consommatoire qui devient de plus en plus impulsive, l’individu s’installe dans une spirale (figure 8.2).Le renforcement positif (initial) existe donc encore après la consommation de l’objet, mais le renforcement négatif s’accroît, se sensibilise. L’Addiction étant installée, c’est-à-dire un état compulsif, le sujet s’enferme dans une autre spirale (figure 8.3).
À ce stade ultime du processus, l’individu, malade, est submergé par des renforcements négatifs et l’état affectif négatif. L’addict est un être en grande souffrance et douloureux. L’état de manque-sevrage qui domine la boucle compulsive est le reflet des multiples neuroadaptations survenues au cours du temps en raison de l’action directe (pharmacologique) ou indirecte (boucles comportementales sensori-motrices dans le cas des addictions sans drogue) de l’objet. Peu à peu, le processus passe par trois états :
• un état dominé par la mise en jeu du système de récompense, hédonique (reward system), avec une réactivité homéostatique vers l’équilibre ;
• une modification progressive des fonctionnements physiologiques des systèmes motivationnels, hors équilibre dans un état allostatique (Koob et Le Moal, 2004 ) associé à une vulnérabilité à la rechute ;
) associé à une vulnérabilité à la rechute ;
 ) associé à une vulnérabilité à la rechute ;
) associé à une vulnérabilité à la rechute ;
• l’état final où les changements cérébraux sont plus difficilement réversibles pour produire un état chronique de maladie qu’est l’Addiction (Koob et Le Moal, 2006 ; Le Moal et Koob, 2007
; Le Moal et Koob, 2007 ).
).
 ; Le Moal et Koob, 2007
; Le Moal et Koob, 2007 ).
).Ces considérations sont généralisables aux autres conditions psychopathologiques (Koob et Le Moal, 2001 ).
).
 ).
).Le système cérébral de récompense (reward system) correspond à des circuits impliqués dans le renforcement positif associé à des valeurs hédoniques appétitives. Les neuroadaptations induites par la consommation de l’objet correspondent par définition (homéostasie) à des changements d’état internes impliquant d’une part la dopamine (Le Moal et Simon, 1991 ) et d’autre part les systèmes d’activation et de stress (système périphérique hypothalamo-hypophyso-surrénalien) avec la sécrétion de l’hormone cortisone (glucocorticoïde). Cette hormone franchit la barrière hémato-encéphalique, active ses récepteurs centraux et en particulier ceux localisés dans les neurones à dopamine (Piazza et coll., 1989
) et d’autre part les systèmes d’activation et de stress (système périphérique hypothalamo-hypophyso-surrénalien) avec la sécrétion de l’hormone cortisone (glucocorticoïde). Cette hormone franchit la barrière hémato-encéphalique, active ses récepteurs centraux et en particulier ceux localisés dans les neurones à dopamine (Piazza et coll., 1989 et 1993
et 1993 ; Piazza et Le Moal, 1996
; Piazza et Le Moal, 1996 et 1998
et 1998 ). Le tableau 8.I
). Le tableau 8.I (Koob et Le Moal, 2008
(Koob et Le Moal, 2008 ) montre que chaque drogue (addictions) met en jeu des neurotransmetteurs et structures spécifiques mais que des substrats communs sont activés (Addiction).
) montre que chaque drogue (addictions) met en jeu des neurotransmetteurs et structures spécifiques mais que des substrats communs sont activés (Addiction).
 ) et d’autre part les systèmes d’activation et de stress (système périphérique hypothalamo-hypophyso-surrénalien) avec la sécrétion de l’hormone cortisone (glucocorticoïde). Cette hormone franchit la barrière hémato-encéphalique, active ses récepteurs centraux et en particulier ceux localisés dans les neurones à dopamine (Piazza et coll., 1989
) et d’autre part les systèmes d’activation et de stress (système périphérique hypothalamo-hypophyso-surrénalien) avec la sécrétion de l’hormone cortisone (glucocorticoïde). Cette hormone franchit la barrière hémato-encéphalique, active ses récepteurs centraux et en particulier ceux localisés dans les neurones à dopamine (Piazza et coll., 1989 et 1993
et 1993 ; Piazza et Le Moal, 1996
; Piazza et Le Moal, 1996 et 1998
et 1998 ). Le tableau 8.I
). Le tableau 8.I (Koob et Le Moal, 2008
(Koob et Le Moal, 2008 ) montre que chaque drogue (addictions) met en jeu des neurotransmetteurs et structures spécifiques mais que des substrats communs sont activés (Addiction).
) montre que chaque drogue (addictions) met en jeu des neurotransmetteurs et structures spécifiques mais que des substrats communs sont activés (Addiction).Les résultats expérimentaux convergent pour montrer que les systèmes centraux du stress (circuits intracérébraux du facteur de libération de la corticotropine – Corticotropin-Releasing Factor, CRF – et de la noradrénaline) et des émotions sont recrutés alors que le processus addictif progresse en conséquence d’une activation excessive du système de récompense, ce qui accroît la valence hédonique négative. Ces systèmes ont été appelés les systèmes anti-renforcements (anti-reward systems) (Koob et Le Moal, 2005 et 2008
et 2008 ) ; ils participent à un ensemble cette fois inter-systémique (et non plus intra-système) dont le fonctionnement physiopathologique va définir un état motivationnel puissant reflété par le passage des conduites impulsives aux conduites compulsives et dominé par le syndrome de sevrage. Le tableau 8.II résume les neurotransmetteurs impliqués dans ces états motivationnels.
) ; ils participent à un ensemble cette fois inter-systémique (et non plus intra-système) dont le fonctionnement physiopathologique va définir un état motivationnel puissant reflété par le passage des conduites impulsives aux conduites compulsives et dominé par le syndrome de sevrage. Le tableau 8.II résume les neurotransmetteurs impliqués dans ces états motivationnels.
 et 2008
et 2008 ) ; ils participent à un ensemble cette fois inter-systémique (et non plus intra-système) dont le fonctionnement physiopathologique va définir un état motivationnel puissant reflété par le passage des conduites impulsives aux conduites compulsives et dominé par le syndrome de sevrage. Le tableau 8.II résume les neurotransmetteurs impliqués dans ces états motivationnels.
) ; ils participent à un ensemble cette fois inter-systémique (et non plus intra-système) dont le fonctionnement physiopathologique va définir un état motivationnel puissant reflété par le passage des conduites impulsives aux conduites compulsives et dominé par le syndrome de sevrage. Le tableau 8.II résume les neurotransmetteurs impliqués dans ces états motivationnels.Tableau 8.I Neurotransmetteurs mis en jeu par l’abus de drogue
|
Abus de drogue
|
Neurotransmetteur
|
Site
|
|
Cocaïne et amphétamines
|
Dopamine
Acide γ-aminobutyrique
|
Nucleus accumbens
Amygdale
|
|
Opiacés
|
Peptides opioïdes
Dopamine
Endocannabinoïdes
|
Nucleus accumbens
Aire tegmentale ventrale
|
|
Nicotine
|
Acetylcholine nicotinique
Dopamine
Acide γ-aminobutyrique
Peptides opioïdes
|
Nucleus accumbens
Aire tegmentale ventrale
Amygdale
|
|
Δ9-tetrahydrocannabinol
|
Endocannabinoïdes
Peptides opioïdes
Dopamine
|
Nucleus accumbens
Aire tegmentale ventrale
|
|
Alcool
|
Dopamine
Peptides opioïdes
Acide γ-aminobutyrique
|
Nucleus accumbens
Aire tegmentale ventrale
Amygdale
|
Tableau 8.II Neurotransmetteurs impliqués dans les effets motivationnels de sevrage d’abus de drogues
|
Neurotransmetteur
|
Effet fonctionnel
|
|
↓ Dopamine
|
Dysphorie
|
|
↓ Sérotonine
|
Dysphorie
|
|
↓ Acide g-aminobutyrique
|
Anxiété, panique
|
|
↓ Neuropeptide Y
|
Antistress
|
|
↑ Dynorphine
|
Dysphorie
|
|
↑ Facteur de libération de corticotropine
|
Stress
|
|
↑ Noradrénaline
|
Stress
|
Les circuits neurobiologiques impliqués dans l’évolution du processus sont schématisés dans la figure 8.4.
Le processus addictif résulte pour une bonne part de l’accroissement progressif (sensibilisation) de tous les mécanismes qui, au départ, s’opposaient à l’effet aigu de l’objet ; ils se développent pour leur propre compte et correspondent aux physiopathologies à l’œuvre, conséquences des consommations mais également causes des besoins impérieux. Ces phénomènes ne sont pas encore entièrement compris. L’usage du terme tolérance (et le concept), issu de la pharmacologie du comportement (une consommation aurait progressivement moins d’effet et doit être donc accrue en quantité et dans le temps pour un effet similaire), est un non-sens physiologique. La consommation a de plus en plus d’effets non sur la cible neurobiologique initiale de l’objet (système de récompense), mais sur d’autres circuits (dont le cortex préfrontal), ceux qui sont à l’origine des mécanismes neuropathologiques. D’autres neurotransmetteurs et ensembles neuronaux sont recrutés qui vont précipiter la transition de la consommation impulsive vers la compulsion et la perte de contrôle.
Au niveau cellulaire et moléculaire, les recherches ont démontré le rôle de deux molécules. La première est un facteur de transcription, une protéine qui régule l’expression et l’activité des gènes et, partant, l’activité globale des cellules nerveuses : CREB (cAMP Response Element-Binding), qui résulte de l’activation de l’AMP cyclique dont la production augmente dans le système mésolimbique et le noyau accumbens en raison de l’utilisation accrue de dopamine (effet initial de l’objet). Cet accroissement est la conséquence de la consommation de drogue ou de l’activation comportementale. L’activation soutenue de CREB accroît l’expression de ses gènes cibles, dont certains codent pour la production de protéines qui vont, en conséquence, accroître l’activité des circuits du système de récompense, par exemple la synthèse de dynorphine, laquelle en retour inhibera les neurones dans l’aire tegmentale ventrale (siège des neurones à dopamine) et donc réduira l’activité du système de récompense. L’activation de CREB, de nature inconditionnelle, est de courte durée et disparaît en peu de jours après la consommation. Les effets prolongés des consommations d’objets addictogènes, les altérations cérébrales à long terme – en années et décennies – et qui subsistent après abstinence relèvent d’autres mécanismes, dont des changements structuraux. Il a été montré un accroissement du nombre des épines dendritiques (Robinson et Berridge, 2003 ), et ces remodelages peuvent rendre compte de l’hypersensibilité des régions impliquées dans l’Addiction aux neurotransmetteurs libérés soit par une consommation ou sa représentation mentale, soit par des signaux activant des mémoires spécifiques. Des données récentes (Nestler, 2001
), et ces remodelages peuvent rendre compte de l’hypersensibilité des régions impliquées dans l’Addiction aux neurotransmetteurs libérés soit par une consommation ou sa représentation mentale, soit par des signaux activant des mémoires spécifiques. Des données récentes (Nestler, 2001 et 2004
et 2004 ) suggèrent que la molécule delta FOS-B joue un rôle dans l’augmentation des épines dendritiques. Cet effet est l’une des nombreuses conséquences des sensibilisations à long terme mentionnées ci-dessus. Le facteur de transmission delta FOS-B est le reflet de ces changements moléculaires à long terme qui rendent compte de la chronicité de la maladie. Lors d’une consommation accrue (chronique), ce facteur s’accroît lentement et régulièrement dans les régions impliquées dans le processus addictif. Chez l’animal, cette protéine est extrêmement stable et reste active dans les neurones durant des mois après la consommation, maintenant de ce fait très longtemps les changements dans l’expression des gènes même après l’arrêt d’une consommation, ce qui contribue à la rechute (Nestler et coll., 2001
) suggèrent que la molécule delta FOS-B joue un rôle dans l’augmentation des épines dendritiques. Cet effet est l’une des nombreuses conséquences des sensibilisations à long terme mentionnées ci-dessus. Le facteur de transmission delta FOS-B est le reflet de ces changements moléculaires à long terme qui rendent compte de la chronicité de la maladie. Lors d’une consommation accrue (chronique), ce facteur s’accroît lentement et régulièrement dans les régions impliquées dans le processus addictif. Chez l’animal, cette protéine est extrêmement stable et reste active dans les neurones durant des mois après la consommation, maintenant de ce fait très longtemps les changements dans l’expression des gènes même après l’arrêt d’une consommation, ce qui contribue à la rechute (Nestler et coll., 2001 ; Nestler, 2001
; Nestler, 2001 et 2004
et 2004 ; Koob et Le Moal, 2008
; Koob et Le Moal, 2008 ). Cet accroissement a été observé également à partir de conduites répétitives comme l’activité motrice excessive ou la consommation incontrôlée de sucre, ce qui indique une implication générale dans la physiopathologie des conduites compulsives.
). Cet accroissement a été observé également à partir de conduites répétitives comme l’activité motrice excessive ou la consommation incontrôlée de sucre, ce qui indique une implication générale dans la physiopathologie des conduites compulsives.
 ), et ces remodelages peuvent rendre compte de l’hypersensibilité des régions impliquées dans l’Addiction aux neurotransmetteurs libérés soit par une consommation ou sa représentation mentale, soit par des signaux activant des mémoires spécifiques. Des données récentes (Nestler, 2001
), et ces remodelages peuvent rendre compte de l’hypersensibilité des régions impliquées dans l’Addiction aux neurotransmetteurs libérés soit par une consommation ou sa représentation mentale, soit par des signaux activant des mémoires spécifiques. Des données récentes (Nestler, 2001 et 2004
et 2004 ) suggèrent que la molécule delta FOS-B joue un rôle dans l’augmentation des épines dendritiques. Cet effet est l’une des nombreuses conséquences des sensibilisations à long terme mentionnées ci-dessus. Le facteur de transmission delta FOS-B est le reflet de ces changements moléculaires à long terme qui rendent compte de la chronicité de la maladie. Lors d’une consommation accrue (chronique), ce facteur s’accroît lentement et régulièrement dans les régions impliquées dans le processus addictif. Chez l’animal, cette protéine est extrêmement stable et reste active dans les neurones durant des mois après la consommation, maintenant de ce fait très longtemps les changements dans l’expression des gènes même après l’arrêt d’une consommation, ce qui contribue à la rechute (Nestler et coll., 2001
) suggèrent que la molécule delta FOS-B joue un rôle dans l’augmentation des épines dendritiques. Cet effet est l’une des nombreuses conséquences des sensibilisations à long terme mentionnées ci-dessus. Le facteur de transmission delta FOS-B est le reflet de ces changements moléculaires à long terme qui rendent compte de la chronicité de la maladie. Lors d’une consommation accrue (chronique), ce facteur s’accroît lentement et régulièrement dans les régions impliquées dans le processus addictif. Chez l’animal, cette protéine est extrêmement stable et reste active dans les neurones durant des mois après la consommation, maintenant de ce fait très longtemps les changements dans l’expression des gènes même après l’arrêt d’une consommation, ce qui contribue à la rechute (Nestler et coll., 2001 ; Nestler, 2001
; Nestler, 2001 et 2004
et 2004 ; Koob et Le Moal, 2008
; Koob et Le Moal, 2008 ). Cet accroissement a été observé également à partir de conduites répétitives comme l’activité motrice excessive ou la consommation incontrôlée de sucre, ce qui indique une implication générale dans la physiopathologie des conduites compulsives.
). Cet accroissement a été observé également à partir de conduites répétitives comme l’activité motrice excessive ou la consommation incontrôlée de sucre, ce qui indique une implication générale dans la physiopathologie des conduites compulsives.Il a été montré que plusieurs régions cérébrales impliquées dans l’Addiction, comme l’hippocampe, l’amygdale, le cortex préfrontal, communiquent (dans les deux sens) avec le système de récompense, dont le noyau accumbens et les neurones à dopamine par l’intermédiaire des voies glutamatergiques. Ces voies sont l’un des composants majeurs des systèmes opposants conditionnés qui induisent des sensibilisations à long terme (Kalivas, 2004 ; Ungless et coll., 2001
; Ungless et coll., 2001 ). Les neurones, à dopamine par exemple, ont une sensibilité accrue à ce transmetteur excitateur, libéré par des voies longues reliant différentes régions du cerveau ; ses récepteurs sont augmentés dans les neurones cibles (Ungless et coll., 2001
). Les neurones, à dopamine par exemple, ont une sensibilité accrue à ce transmetteur excitateur, libéré par des voies longues reliant différentes régions du cerveau ; ses récepteurs sont augmentés dans les neurones cibles (Ungless et coll., 2001 ).
).
 ; Ungless et coll., 2001
; Ungless et coll., 2001 ). Les neurones, à dopamine par exemple, ont une sensibilité accrue à ce transmetteur excitateur, libéré par des voies longues reliant différentes régions du cerveau ; ses récepteurs sont augmentés dans les neurones cibles (Ungless et coll., 2001
). Les neurones, à dopamine par exemple, ont une sensibilité accrue à ce transmetteur excitateur, libéré par des voies longues reliant différentes régions du cerveau ; ses récepteurs sont augmentés dans les neurones cibles (Ungless et coll., 2001 ).
).Toutes ces données doivent être intégrées selon une dynamique temporelle et selon les mécanismes qui régissent les différences inter-individuelles. Nous avons vu que les mêmes mécanismes physiologiques qui permettent des réponses motivationnelles rapides et adaptées à une consommation sont également à l’origine d’états pathologiques si les ressources nécessaires ne sont pas disponibles pour arrêter ces réponses. Les mécanismes allostatiques permettent une stabilité fonctionnelle en dépit de changements neuroadaptatifs au sein des systèmes de renforcement. Ces mécanismes ont un coût et débouchent sur l’hyperactivation des systèmes de renforcement et le recrutement des systèmes anti-renforcements et du stress (Koob et Le Moal, 2006 ).
).
 ).
).Neuropsychologie de l’Addiction
L’essentiel des données publiées concerne les addictions dues aux drogues d’abus. Cependant, comme les addictions sans drogue présentent les mêmes symptômes et même un syndrome de sevrage, il est logique d’admettre que ces manifestations cliniques reflètent les mêmes dysfonctionnements cérébraux qui relèvent donc d’une physiopathologie commune, celle de l’Addiction. Différents schémas ont été présentés dans la littérature spécialisée (pour une revue exhaustive, voir l’ouvrage Koob et Le Moal, 2006 ). Il ne sera jamais assez répété que le syndrome d’Addiction est la fin d’un processus qui s’insère dans un cycle (ou une spirale) dans la mesure où après sevrage, dans 80 % des cas, il y a rechute (voir figure 8.1
). Il ne sera jamais assez répété que le syndrome d’Addiction est la fin d’un processus qui s’insère dans un cycle (ou une spirale) dans la mesure où après sevrage, dans 80 % des cas, il y a rechute (voir figure 8.1 ). La position présentée ici (pour détails, voir Koob et Le Moal, 1997
). La position présentée ici (pour détails, voir Koob et Le Moal, 1997 ) est :
) est :
 ). Il ne sera jamais assez répété que le syndrome d’Addiction est la fin d’un processus qui s’insère dans un cycle (ou une spirale) dans la mesure où après sevrage, dans 80 % des cas, il y a rechute (voir figure 8.1
). Il ne sera jamais assez répété que le syndrome d’Addiction est la fin d’un processus qui s’insère dans un cycle (ou une spirale) dans la mesure où après sevrage, dans 80 % des cas, il y a rechute (voir figure 8.1 ). La position présentée ici (pour détails, voir Koob et Le Moal, 1997
). La position présentée ici (pour détails, voir Koob et Le Moal, 1997 ) est :
) est :
• que de l’initiation du processus jusqu’au stade terminal d’Addiction, le trouble majeur est la perte des capacités d’autorégulation à des degrés variables, pour s’achever dans la perte totale des mécanismes de contrôle ;
• que ces caractéristiques comportementales reflètent l’altération de mécanismes neurobiologiques faisant intervenir le cortex préfrontal. Nous y voyons le primum movens ou le mécanisme pathognomomique de nombreux troubles biocomportementaux et psychopathologiques dont les addictions.
Cliniciens et neurobiologistes doivent définir et maîtriser le vocabulaire dans le but de faire coïncider le contenu des mots qui définissent symptômes et syndromes et les mots qui définissent physiologiquement et physiopathologiquement les fonctions des structures cérébrales identifiées.
Le syndrome commun est défini par :
• la perte de contrôle et des capacités d’autorégulation ;
• une recherche et un usage compulsif de l’objet, l’instauration de boucles motrices déclenchées par les représentations mentales et les stimuli environnementaux ;
• une rupture de l’homéostasie hédonique avec un état affectif négatif en l’absence de l’objet ;
• conséquemment, un rétrécissement des conduites et la mise en danger du principe biologique fondamental : conservation de l’individu et préservation de l’espèce.
Une proposition neuropsychologique des relations structure-fonction est représentée dans la figure 8.5.
Les différentes propositions neurobiologiques communes au syndrome d’Addiction sont synthétisées dans la figure 8.6 (Koob et Le Moal, 2006 ). On y trouve un ensemble de régions, telles le noyau central de l’amygdale, le noyau de la strie terminale, la partie externe périphérique – shell – du noyau accumbens, souvent appelé amygdale étendue, comprenant par ailleurs des neurotransmetteurs tels que la dopamine et les opioïdes issus de l’aire tegmentale ventrale et du noyau arqué et les messagers du stress (glucocorticoïdes périphériques, CRF, noradrénaline).
). On y trouve un ensemble de régions, telles le noyau central de l’amygdale, le noyau de la strie terminale, la partie externe périphérique – shell – du noyau accumbens, souvent appelé amygdale étendue, comprenant par ailleurs des neurotransmetteurs tels que la dopamine et les opioïdes issus de l’aire tegmentale ventrale et du noyau arqué et les messagers du stress (glucocorticoïdes périphériques, CRF, noradrénaline).
 ). On y trouve un ensemble de régions, telles le noyau central de l’amygdale, le noyau de la strie terminale, la partie externe périphérique – shell – du noyau accumbens, souvent appelé amygdale étendue, comprenant par ailleurs des neurotransmetteurs tels que la dopamine et les opioïdes issus de l’aire tegmentale ventrale et du noyau arqué et les messagers du stress (glucocorticoïdes périphériques, CRF, noradrénaline).
). On y trouve un ensemble de régions, telles le noyau central de l’amygdale, le noyau de la strie terminale, la partie externe périphérique – shell – du noyau accumbens, souvent appelé amygdale étendue, comprenant par ailleurs des neurotransmetteurs tels que la dopamine et les opioïdes issus de l’aire tegmentale ventrale et du noyau arqué et les messagers du stress (glucocorticoïdes périphériques, CRF, noradrénaline). | Figure 8.6 Synthèse des circuits dont le dysfonctionnement produit le -syndrome commun de l’Addiction (d’après Koob et Le Moal, 2006 ) ) |
Ces régions intègrent les stimuli renforçants, ou les stimuli à signification aversive ou appétitive. Au début de la consommation, la valence globale est appétitive et positivement hédonique ; à mesure que le comportement devient impulsif, puis compulsif, les valeurs négatives ou aversives dominent. Les différentes parties sont inter-régulées par des modulations glutamatergiques. Un second circuit comprend les cortex et la région basolatérale de l’amygdale. Le cortex préfrontal est en position de régulation de l’ensemble cérébral ; il a une fonction inhibitrice de contrôle, défaillante dans l’Addiction. La consommation de l’objet, intégrée au niveau cortical, déclenche le cycle addictif (rechute) ; la perception des signaux ou indices associés à l’objet, intégrés dans le noyau basolatéral, enclenche de même la consommation incontrôlée. Ici encore, la plupart des voies descendantes sont de nature glutamatergiques. Enfin, le circuit moteur (pallidum, thalamus, cortex moteur) à l’œuvre dans la compulsion est régulé également par le cortex préfrontal. Ce schéma n’a pas inclus la région hippocampique qui intègre les mémoires associées à l’objet et à sa consommation (mais voir Koob et Le Moal, 2001 ).
).
 ).
).Dans la mesure où le syndrome clinique observé dans le jeu pathologique correspond à celui de l’Addiction, syndrome de sevrage inclus, il est admis que les fondements neuro- et physiopathologiques sont similaires. Qu’il s’agisse de la consommation d’aliments ayant des qualités hédoniques, de drogues qui envahissent les régions de renforcements positifs et usurpent leur fonctionnement normal, de conduites procurant plaisir et récompenses (ou leur attente), les mécanismes induits sont les mêmes, au niveau des mêmes structures, tout comme la capacité ou non de s’autoréguler. L’addiction aux jeux, et selon leurs multiples formes, présente bien évidemment des caractéristiques spécifiques. Il est admis que les sources de vulnérabilité sont identiques (Goodman, 2008 ). Très peu est connu sur les voies sensorielles impliquées, sur les circuits associés aux réponses déclenchées par des indices, visuels ou autres. Le rôle du cortex préfrontal est bien documenté (Bechara et coll., 1995
). Très peu est connu sur les voies sensorielles impliquées, sur les circuits associés aux réponses déclenchées par des indices, visuels ou autres. Le rôle du cortex préfrontal est bien documenté (Bechara et coll., 1995 et 1998
et 1998 ; Damasio et coll., 2000
; Damasio et coll., 2000 ; Kahneman, 2003
; Kahneman, 2003 ; Bechara, 2005
; Bechara, 2005 ) en particulier pour ce qui concerne la prédiction, la prise de décision (et les voies glutamatergiques descendantes) et le contrôle émotionnel. L’imagerie cérébrale montre une perte d’activation préférentielle de ces régions chez les sujets dépendants lors de situations reproduisant une situation de jeux (Potenza et coll., 2003
) en particulier pour ce qui concerne la prédiction, la prise de décision (et les voies glutamatergiques descendantes) et le contrôle émotionnel. L’imagerie cérébrale montre une perte d’activation préférentielle de ces régions chez les sujets dépendants lors de situations reproduisant une situation de jeux (Potenza et coll., 2003 ).
).
 ). Très peu est connu sur les voies sensorielles impliquées, sur les circuits associés aux réponses déclenchées par des indices, visuels ou autres. Le rôle du cortex préfrontal est bien documenté (Bechara et coll., 1995
). Très peu est connu sur les voies sensorielles impliquées, sur les circuits associés aux réponses déclenchées par des indices, visuels ou autres. Le rôle du cortex préfrontal est bien documenté (Bechara et coll., 1995 et 1998
et 1998 ; Damasio et coll., 2000
; Damasio et coll., 2000 ; Kahneman, 2003
; Kahneman, 2003 ; Bechara, 2005
; Bechara, 2005 ) en particulier pour ce qui concerne la prédiction, la prise de décision (et les voies glutamatergiques descendantes) et le contrôle émotionnel. L’imagerie cérébrale montre une perte d’activation préférentielle de ces régions chez les sujets dépendants lors de situations reproduisant une situation de jeux (Potenza et coll., 2003
) en particulier pour ce qui concerne la prédiction, la prise de décision (et les voies glutamatergiques descendantes) et le contrôle émotionnel. L’imagerie cérébrale montre une perte d’activation préférentielle de ces régions chez les sujets dépendants lors de situations reproduisant une situation de jeux (Potenza et coll., 2003 ).
).L’addiction au jeu pose aux neurosciences un problème à résoudre du plus grand intérêt. En effet, cette addiction est la seule qui soit « non métabolique », en d’autres termes dont l’objet n’est pas consommé dans le cadre des systèmes biologiques et de leurs limites métaboliques. Les drogues sont ingérées (ou administrées) et mettent en route les métabolismes biochimiques au sein des systèmes qui ont leurs propres limites homéostatiques et temporelles, de même pour le sexe, la boulimie. L’objet, dans le jeu pathologique, ici des stimuli sensoriels, a peu de limites temporelles, emprunte des voies et met en jeu des systèmes qui lui seront spécifiques, comme pour toute « addiction à ». Les structures en cause dans un syndrome addictif qui progresse sont par nature les mêmes, celles de l’Addiction. Cependant, la caractéristique essentielle est la rapidité entre perception et exécution, bien illustrée avec les joueurs d’échec qui mènent plusieurs parties en même temps et à l’œuvre chez les joueurs d’argent ou les « cyberjoueurs » par exemple. La prise de décision repose bien évidemment sur des connaissances, un savoir-faire, des mémoires dont la qualité et la pertinence rendent vraisemblablement compte de la rapidité de décision et d’action. La mise en jeu de schémas mentaux préétablis existe également avec les drogues d’abus et sont à l’origine des rechutes ; les indices de l’environnement mais aussi des représentations mentales déclenchent quasi immédiatement une consommation impérieuse, impulsive, compulsive, et même un syndrome de sevrage chez un sujet n’ayant pas consommé depuis plusieurs semaines. Les recherches neurobiologiques s’orientent vers l’identification des substrats mis en jeu dans les deux situations qui semblent reposer sur des associations stimuli-réponses dans le cadre de mémoires et de connaissances, de systèmes cognitifs donc. Dans le cas des drogues d’abus, il a été proposé le rôle central d’habitudes, de schémas sensori-moteurs (« habits »), de mémoires routinières et procédurales autonomes, localisés dans le striatum et sans grandes interférences, curieusement avec les mécanismes (ou non-contrôles) corticaux (Robbins et Everitt, 1999 ). Leur déclenchement et mise en route sont mal compris. A contrario, Kahneman et son école (pour revue récente voir Kahneman, 2003
). Leur déclenchement et mise en route sont mal compris. A contrario, Kahneman et son école (pour revue récente voir Kahneman, 2003 ) ont bien analysé les mécanismes impliqués lors des prises de décisions dans des situations à risques ou chargées d’incertitudes (jeu, bourse…) fréquentes dans le monde réel, y compris les drogues et le sexe (Tversky et -Kahneman, 1974
) ont bien analysé les mécanismes impliqués lors des prises de décisions dans des situations à risques ou chargées d’incertitudes (jeu, bourse…) fréquentes dans le monde réel, y compris les drogues et le sexe (Tversky et -Kahneman, 1974 et 1981
et 1981 ; Kahneman et Tversky, 1979
; Kahneman et Tversky, 1979 ) et pour lesquelles le rôle de certaines régions du cortex préfrontal a été bien analysé (Bechara et coll., 2000
) et pour lesquelles le rôle de certaines régions du cortex préfrontal a été bien analysé (Bechara et coll., 2000 ; Tranel et coll., 2002
; Tranel et coll., 2002 ; Gehring et Willoughby, 2002
; Gehring et Willoughby, 2002 ). La figure 8.7
). La figure 8.7 résume les caractéristiques d’une part d’un système rapide (sys-tème 1), implicite, émotionnel et non soumis à l’introspection, gouverné par des procédures et habitudes, et d’autre part d’un système réflexif (système 2), de contrôle, de raisonnement et qui serait plus lent. Un concept central sous-tend ces deux systèmes, celui de l’accessibilité, l’effort – ou l’aisance – avec lequel des contenus mentaux particuliers viennent à l’esprit ; l’accessibilité d’une pensée est déterminée à la fois par les caractéristiques des mécanismes cognitifs qui la produisent et par les caractéristiques des stimuli ou événements qui l’évoquent. Comment ces mécanismes corticaux se dérèglent est une question qui stimule la recherche en neurosciences.
résume les caractéristiques d’une part d’un système rapide (sys-tème 1), implicite, émotionnel et non soumis à l’introspection, gouverné par des procédures et habitudes, et d’autre part d’un système réflexif (système 2), de contrôle, de raisonnement et qui serait plus lent. Un concept central sous-tend ces deux systèmes, celui de l’accessibilité, l’effort – ou l’aisance – avec lequel des contenus mentaux particuliers viennent à l’esprit ; l’accessibilité d’une pensée est déterminée à la fois par les caractéristiques des mécanismes cognitifs qui la produisent et par les caractéristiques des stimuli ou événements qui l’évoquent. Comment ces mécanismes corticaux se dérèglent est une question qui stimule la recherche en neurosciences.
 ). Leur déclenchement et mise en route sont mal compris. A contrario, Kahneman et son école (pour revue récente voir Kahneman, 2003
). Leur déclenchement et mise en route sont mal compris. A contrario, Kahneman et son école (pour revue récente voir Kahneman, 2003 ) ont bien analysé les mécanismes impliqués lors des prises de décisions dans des situations à risques ou chargées d’incertitudes (jeu, bourse…) fréquentes dans le monde réel, y compris les drogues et le sexe (Tversky et -Kahneman, 1974
) ont bien analysé les mécanismes impliqués lors des prises de décisions dans des situations à risques ou chargées d’incertitudes (jeu, bourse…) fréquentes dans le monde réel, y compris les drogues et le sexe (Tversky et -Kahneman, 1974 et 1981
et 1981 ; Kahneman et Tversky, 1979
; Kahneman et Tversky, 1979 ) et pour lesquelles le rôle de certaines régions du cortex préfrontal a été bien analysé (Bechara et coll., 2000
) et pour lesquelles le rôle de certaines régions du cortex préfrontal a été bien analysé (Bechara et coll., 2000 ; Tranel et coll., 2002
; Tranel et coll., 2002 ; Gehring et Willoughby, 2002
; Gehring et Willoughby, 2002 ). La figure 8.7
). La figure 8.7 résume les caractéristiques d’une part d’un système rapide (sys-tème 1), implicite, émotionnel et non soumis à l’introspection, gouverné par des procédures et habitudes, et d’autre part d’un système réflexif (système 2), de contrôle, de raisonnement et qui serait plus lent. Un concept central sous-tend ces deux systèmes, celui de l’accessibilité, l’effort – ou l’aisance – avec lequel des contenus mentaux particuliers viennent à l’esprit ; l’accessibilité d’une pensée est déterminée à la fois par les caractéristiques des mécanismes cognitifs qui la produisent et par les caractéristiques des stimuli ou événements qui l’évoquent. Comment ces mécanismes corticaux se dérèglent est une question qui stimule la recherche en neurosciences.
résume les caractéristiques d’une part d’un système rapide (sys-tème 1), implicite, émotionnel et non soumis à l’introspection, gouverné par des procédures et habitudes, et d’autre part d’un système réflexif (système 2), de contrôle, de raisonnement et qui serait plus lent. Un concept central sous-tend ces deux systèmes, celui de l’accessibilité, l’effort – ou l’aisance – avec lequel des contenus mentaux particuliers viennent à l’esprit ; l’accessibilité d’une pensée est déterminée à la fois par les caractéristiques des mécanismes cognitifs qui la produisent et par les caractéristiques des stimuli ou événements qui l’évoquent. Comment ces mécanismes corticaux se dérèglent est une question qui stimule la recherche en neurosciences. | Figure 8.7 Caractéristiques des deux systèmes cognitifs impliqués dans une prise de décision lors de la présentation d’un stimulus de l’environnement (d’après Kahneman, 2003 ) ) |
En conclusion, un objet d’addiction n’est addictogène que dans la mesure où il est consommé par un individu préalablement vulnérable. Cette vulnérabilité résulte des comorbidités psychopathologiques diverses, de conditions environnementales et éducationnelles délétères, de troubles de la personnalité, de trajectoires de vie stressantes. Ces sujets vulnérables sont en général polyconsommateurs d’objets d’addiction. Les troubles développés sont donc complexes : propres à l’objet et propres aux comorbidités. La consommation est souvent une auto-médication. Comment prédire en amont une vulnérabilité est l’un des challenges de l’addictologie.
De la consommation occasionnelle et contrôlée à la consommation compulsive, un processus complexe, pathologique, s’engage s’achevant par le stade d’Addiction, maladie chronique à rechute. L’Addiction, maladie grave, concerne relativement peu de sujets au regard du nombre des consommateurs occasionnels.
Il est admis que pour chaque « addiction à », il y a des symptômes ou caractéristiques comportementales propres à la consommation de l’objet déterminé. Toutefois, il existe un syndrome clinique commun, le syndrome d’Addiction. Ce syndrome est analysé selon un modèle médical : recherche de l’étiologie, de la physiopathologie, élaboration du traitement. L’étiologie est en discussion : soit la comorbidité prémorbide, soit les caractéristiques propres à l’objet ; seule la première position est acceptable. Les traitements sont encore limités en efficacité.
La physiopathologie est de mieux en mieux connue. Une perspective neuro-psychologique est proposée pour laquelle les termes de la description clinique sont rapportés aux termes utilisés en physiologie du cerveau pour caractériser la fonction et la dysfonction des structures et réseaux.
Les addictions ne sont qu’une part d’un ensemble de perturbations psychopathologiques et comportementales, toutes caractérisées par une perte des capacités d’autorégulation.
Le jeu pathologique rejoint les addictions aux drogues licites (tabac, alcool), lesquelles coûtent à la société et aux systèmes de soin et, sans commune mesure, bien plus que les addictions illicites.
Le traitement, difficile comme pour toutes les pathologies psychiatriques, demande une grande expertise. La prévention sera possible sur la base d’une conception solide du pourquoi des différences inter-individuelles et du comment de l’entrée dans le processus addictif. Les neurosciences, avec les autres disciplines, doivent y concourir.
Bibliographie
[1] ahmed sh, koob gf. Transition from moderate to excessive drug intake: change in hedonic set point.
Science. 1998;
282:298- 300

[2] bechara a. Decision making, impulse control and loss of willpower to resist drugs: a neurocognitive perspective.
Nat Neurosci. 2005;
8:1458- 1463

[3] bechara a, tranel d, damasio h, adolphs r, rockland c, damasio a. Double dissociation of conditioning and declarative knowledge relative to the amygdale and hippocampus in humans.
Science. 1995;
267:115- 1118

[4] bechara a, damasio h, tranel d, anderson sw. Dissociation of working memory from decision making within the human prefrontal cortex.
J Neurosci. 1998;
18:428- 437

[5] bechara a, damasio h, damasio ar. Emotion, decision-making and the orbitofrontal cortex.
Cerebral Cortex. 2000;
10:295- 307

[6] bernard c. L’Introduction à l’étude de la médecine expérimentale.
Éditions JB Baillère et fils;
1865;


[9] célérier e, laulin jp, corcuff jb, le moal m, simonnet g. Progressive enhancement of delayed hyperalgesia induced by repeated heroin administration: a sensitization process.
J Neurosci. 2001;
21:4074- 4080

[10] damasio ar, grabowski tj, bechara a, damasio h, ponto ll, et coll.. Subcortical and cortical brain activity during the feeling of self-generated emotions.
Nat Neurosci. 2000;
3:1049- 1056

[11] deroche-gamonet v, belin d, piazza pv. Evidence for addiction-like behavior in the rat.
Science. 2004;
305:1014- 1017

[12] gehring wj, willoughby ar. The medial frontal cortex and the rapid processing of monetary gains and losses.
Science. 2002;
295:2274- 2282

[13] goldstein rz, volkow nd. Drug addiction and its underlying neurobiological basis: neuroimaging evidence for the involvement of the frontal cortex.
Am J -Psychiatry. 2002;
159:1642- 1652

[14] goodman a. Neurobiology of addiction: An integrative review.
Biochem Pharmacol. 2008;
75:266- 322

[15] guze sb. Why psychiatry is a branch of medicine.
Oxford University Press;
New York:1992;
147pp. 

[16] kahneman d. A perspective on judgment and choice: Mapping bounded rationality.
Am Psychol. 2003;
58:697- 720

[17] kahneman d, tversky a. Prospect theory: An analysis of decisions under risk.
Econometrica. 1979;
47:263- 291

[20] koob gf, le moal m. Drug addiction, dysregulation of reward and allostasis.
Neuropsychopharmacology. 2001;
24:97- 129

[21] koob gf, le moal m. Drug addiction and allostasis.
In : Allostasis, homeostais and the costs of physiological adaptation. In: schulkin j (ed), editors.
Cambridge University Press;
New York:2004;
150163

[22] koob gf, le moal m. Plasticity of reward neurocircuitry and the 'dark side' of drug addiction.
Nat Neurosci. 2005;
8:1442- 1444

[24] koob gf, le moal m. Addiction and the brain anti-reward system.
Ann Rev Psychology. 2008;
59:29- 53

[25] krueger rf, caspi a, moffitt te, silva pa. The structure and stability of common mental disorders (DSM-III-R): a longitudinal-epidemiological study.
J Abnorm Psychology. 1998;
107:216- 227

[27] le moal m, simon h. Mesocorticolimbic dopaminergic network: functional and regulatory roles.
Physiol Rev. 1991;
71:155- 234

[28] le moal m, koob gf. Drug addiction: Pathways to the disease and pathophysiological perspectives.
Eur Neuropsychopharmacology. 2007;
17:377- 393

[29] larcher a, laulin jp, célérier e, le moal m, simonnet g. Acute tolerance associated with a single opiate administration: involvement of N-methyl-D-aspartate-dependent pain facilitatory systems.
Neuroscience. 1998;
84:583- 589

[30] laulin jp, célérier e, larcher a, le moal m, simonnet g. Opiate tolerance to daily heroin administration: an apparent phenomenon associated with enhanced pain sensitivity.
Neuroscience. 1999;
89:631- 636

[31] mclellan at, lewis dc, o'brien cp, kleber hd. Drug dependence, a chronic medical illness: implications for treatment, insurance, and outcomes evaluation.
JAMA. 2000;
284:1689- 1695

[32] nestler ej. Molecular basis of long-term plasticity underlying addiction.
Nat Rev Neurosci. 2001;
2:119- 128

[33] nestler ej. Historical review: Molecular and cellular mechanisms of opiate and cocaine addiction.
Trends Pharmacol Sci. 2004;
25:210- 218

[34] nestler ej, barrot m, self dw. DeltaFosB: a sustained molecular switch for addiction.
Proc Natl Acad Sci USA. 2001;
98:11042- 11046

[35] piazza pv, le moal m. Pathophysiological basis of vulnerability to drug abuse: role of an interaction between stress, glucocorticoids, and dopaminergic neurons.
Annu Rev Pharmacol Toxicol. 1996;
36:359- 378

[36] piazza pv, le moal m. The role of stress in drug self-administration.
Trends Pharmacol Sci. 1998;
19:67- 74

[37] piazza pv, deminière jm, le moal m, simon h. Factors that predict individual vulnerability to amphetamine self-administration.
Science. 1989;
245:1511- 1513

[38] piazza pv, deroche v, deminière jm, maccari s, le moal m, simon h. Corticosterone in the range of stress-induced levels possesses reinforcing properties: implications for sensation-seeking behaviors.
Proc Natl Acad Sci USA. 1993;
90:11738- 11742

[39] potenza mn, steinberg ma, skudlarski p, fulbright rk, lacadie cm, et coll.. Gambling urges in pathological gambling: A functional magnetic resonance imaging study.
Arch Gen Psychiatry 2003. 60:828836

[40] poulos cx, cappell h. Homeostatic theory of drug tolerance: a general model of physiological adaptation.
Psychol Rev. 1991;
98:390- 408

[43] shaffer hj, laplante da, labrie ra, kidman rc, donato an, stanton mv. Toward a syndrome model of addiction: Multiple expressions, common etiology.
Harv Rev Psychiatry. 2004;
12:367- 374

[44] solomon rl. The opponent-process theory of acquired motivation: the costs of pleasure and the benefits of pain.
Am Psychol. 1980;
35:691- 712

[45] solomon rl, corbit jd. An opponent-process theory of motivation. I. Temporal dynamics of affect.
Psychol Rev. 1974;
81:119- 145

[46] tranel d, bechara a, denburg nl. Asymmetric functional roles of right and left ventromedial prefrontal cortices in social conduct, decision-making and emotional processing.
Cortex. 2002;
38:589- 612

[47] tversky a, kahneman d. Judgment under uncertainty: Heuristics and biases.
Science. 1974;
185:1124- 1131

[48] tversky a, kahneman d. The framing of decisions and the psychology of choice.
Science. 1981;
211:453- 458

[49] ungless ma, whistler jl, malenka rc, bonci a. Single cocaine exposure in vivo induces long-term potentiation in dopamine neurons.
Nature. 2001;
411:583- 587

[50] vanderschuren lj, everitt bj. Drug seeking becomes compulsive after prolonged cocaine self-administration.
Science. 2004;
305:1017- 1019

[51] winkielman p, knutson b, paulus m, trujillo jl. Affective influence on judgments and decisions: Moving towards core mechanisms.
Rev Gen Psychol. 2007;
11:179- 192

→ Aller vers SYNTHESE