| |
| Med Sci (Paris). 35(5): 412–416. doi: 10.1051/medsci/2019088.Analyse approfondie du lien entre le récepteur
MT2 de la mélatonine et le diabète de type 2 Alan Hegron1,2,3 and Ralf Jockers1,2,3* 1Inserm, U1016, Institut Cochin, 22 rue Méchain, 75014, Paris, France 2CNRS UMR 8104, Paris,
France 3Université Paris Descartes, Sorbonne Paris
Cité, Paris, France MeSH keywords: Animaux, Rythme circadien, Biologie informatique, Diabète de type 2, Évaluation préclinique de médicament, Études d'associations génétiques, Cellules HEK293, Humains, Mélatonine, Hérédité multifactorielle, Récepteur de la mélatonine de type MT2, Récepteurs couplés aux protéines G, Transduction du signal, Sommeil, Biologie des systèmes, bêta-Arrestines, génétique, métabolisme, physiologie |
La mélatonine (MLT), ou 5-méthoxy-N-acétyltryptamine, également appelée hormone du
sommeil, est une hormone qui régule de nombreuses fonctions physiologiques dans le corps
humain. Elle est principalement synthétisée par les pinéalocytes localisés dans la
glande pinéale des mammifères. Ces cellules utilisent en effet le tryptophane pour le
transformer en sérotonine de manière constitutive, sérotonine qui sera elle-même
transformée en MLT durant la nuit, régulant ainsi le cycle jour/nuit chez l’homme. Une
fois sécrétée, la MLT est libérée dans le système sanguin lui permettant d’atteindre
différentes régions du corps humain afin d’entraîner une réponse physiologique adéquate.
La MLT nocturne endogène régule les rythmes circadiens. Elle affecte l’initiation et
l’architecture du sommeil, les fonctions rétiniennes, l’homéostasie du glucose, les
fonctions immunitaires et la reproduction saisonnière [1]. La majeure partie de ses actions est transduite
par l’activation de ses deux récepteurs exprimés par ses cellules cibles. Les récepteurs
de la MLT appartiennent à la famille des récepteurs à sept domaines transmembranaires
couplés aux protéines G (RCPG) [2]. Deux récepteurs de haute affinité de la MLT ont été identifiés chez les
mammifères : MT1 (anciennement nommé Mel1a ou ML1A) et MT2
(anciennement Mel1b ou ML1B). |
Les récepteurs couplés aux protéines G Les RCPG forment le plus grand et le plus varié des groupes de récepteurs
membranaires chez les eucaryotes. Ces récepteurs de surface cellulaire transduisent
les signaux de nombreux messagers comme des peptides, des lipides, des métabolites,
des sucres ou encore des protéines, ou de la lumière (Figure 1). Ces messagers renseignent les cellules
sur leur environnement. Leurs récepteurs jouent un rôle important dans de nombreuses
fonctions biologiques et la compréhension de leur fonctionnement a eu un important
impact en médecine moderne. Environ 30 % des médicaments actuellement sur le marché
sont en effet des molécules liant ces RCPG. Les hommes, à eux seuls, expriment
environ 800 de ces récepteurs, dont plusieurs sont coexprimés en même temps dans
chaque cellule du corps. Les RCPG sont également appelés « récepteurs à sept
domaines transmembranaires », domaines qui sont reliés entre eux par des boucles
intracellulaires (ICL1, ICL2 et ICL3) et extracellulaires (ECL1, ECL2 et ECL3)
(Figure 1). Les
mutations touchant les gènes codant ces récepteurs sont impliquées dans de très
nombreuses maladies, notamment le diabète de type 2 (DT2) [3, 4] (→).
(→) Voir la Synthèse de N. Bouatia-Naj et al.,
m/s n° 11, novembre 2009, page 897
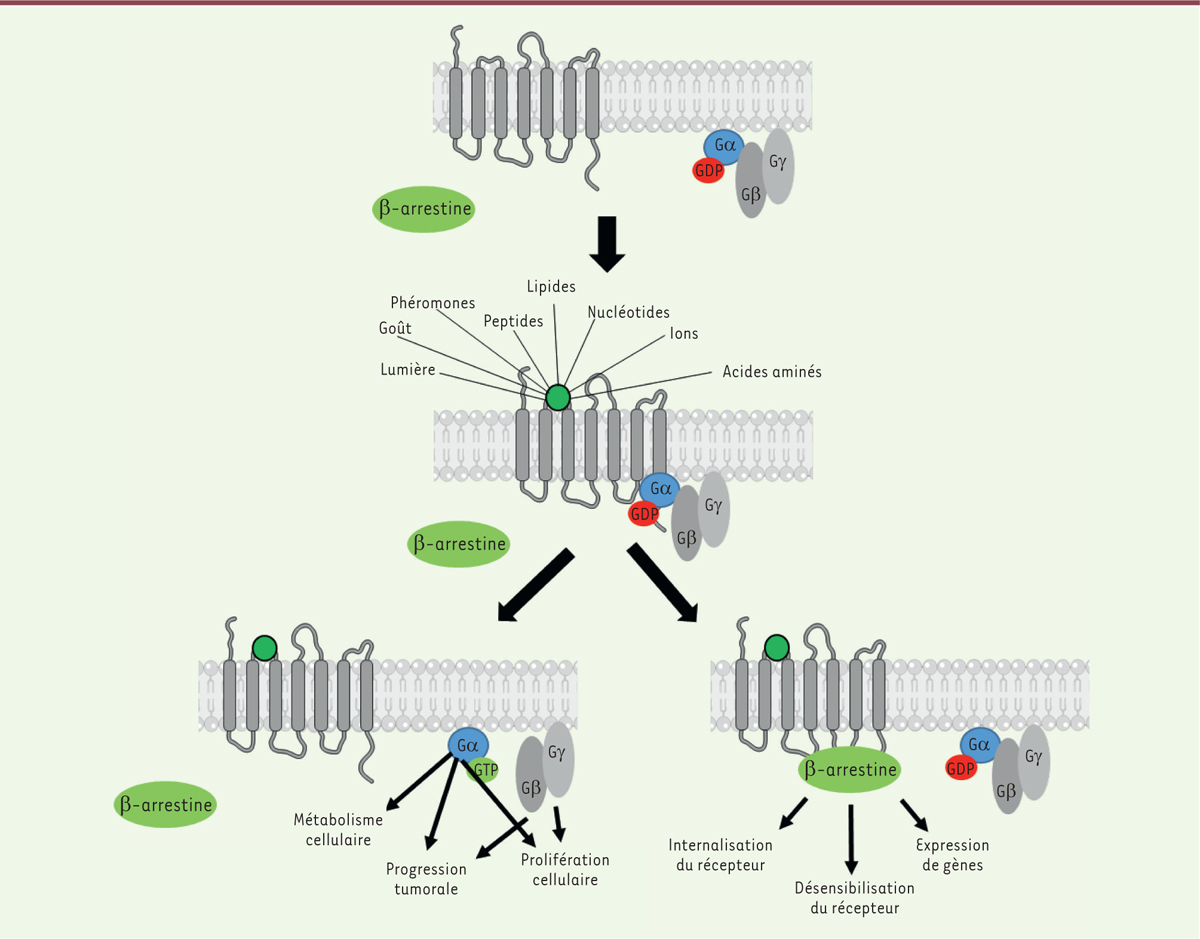
 | Figure 1. Schéma d’un récepteur couplé aux protéines G avant et après
son activation. Le récepteur couplé aux
protéines G est représenté sous sa forme inactive. La sous-unité α est
couplée au GDP (guanosine di-phosphate) et les protéines Ga, Gb, Gγ sont
liées au sein du même complexe. Lorsque le récepteur prend sa forme
active, de façon spontanée ou stabilisé par la liaison d’un ligand
agoniste, il entraîne le remplacement du GDP lié à la sous-unité α par
le GTP (guanosine tri-phosphate) et la dissociation du complexe α/β/γ.
L´activation du récepteur va ainsi entraîner l’activation de plusieurs
voies de signalisation dépendantes des protéines Gα ou Gβγ. Finalement,
la β-arrestine est recrutée par le récepteur et entraîne sa
désensibilisation, son internalisation et une signalisation spécifique
de cette protéine. |
|
Les protéines G et les b-arrestines : outils de signalisation des RCPG Comme leur nom l’indique, les RCPG interagissent avec les protéines G au niveau de la
membrane plasmique. Lorsqu’un ligand se lie à un RCPG, il induit un changement
conformationnel du récepteur, conduisant à des interactions de proximité avec les
protéines G. Les protéines G s’associant aux RCPG sont hétérotrimériques. Elles sont
constituées de trois sous-unités différentes : une sous-unité alpha, une bêta et une
gamma. Les sous-unités alpha et gamma sont liées à la membrane plasmique par des
ancrages lipidiques ; la sous-unité alpha, selon sa conformation, lie le GTP (forme
active) ou le GDP (forme inactive). En l’absence de signal, le GDP est lié à la
sous-unité alpha et ce complexe est lui-même lié aux RCPG. Cette conformation
inactive persiste jusqu’à ce qu’une molécule de signalisation se lie au récepteur et
entraîne le remplacement du GDP par le GTP et la dissociation du complexe
triprotéique en deux parties : la sous-unité alpha liée au GTP d’une part, et le
dimère bêta-gamma d’autre part (Figure
1). Il faut néanmoins noter que le complexe RCPG/protéine G
n’est pas figé. Même en l’absence de ligand, la conformation du RCPG change en effet
de manière plus ou moins importante, lui permettant d’activer certaines protéines G.
C’est ce que l’on appelle l’activité spontanée ou constitutive du récepteur. L’activation d’une seule protéine G peut affecter la production de centaines de
seconds messagers, comme l’AMP cyclique (AMPc), le diacylglycérol (DAG), l’inositol
1, 4, 5-triphosphate (IP3), ou l’activation des cascades de kinases comme celles
régulées par un signal extérieur (ERK, extracellular signal-regulated
kinase) qui coordonnent les voies de signalisation
intracellulaires. Le modèle principal de la signalisation des RCPG postule que, suite à la stimulation
par l’agoniste et à la génération du second messager, la protéine G est physiquement
découplée du récepteur afin d’éviter les effets négatifs d’une stimulation prolongée
du récepteur dans la cellule. Ce processus de désensibilisation du RCPG est
principalement initié par les kinases spécifiques du RCPG (GRK,
G-protein-coupled receptor kinases) et d’autres kinases qui
phosphorylent les résidus sérine et thréonine situés dans les boucles
intracellulaires et au niveau C-terminal des récepteurs activés. Les récepteurs
phosphorylés vont alors activer et recruter vers la membrane plasmique les protéines
β-arrestines du cytoplasme, entraînant la fin de la signalisation dépendante des
protéines G, l’internalisation du récepteur et une signalisation dépendant de la
β-arrestine (Figure 1). |
Lien entre la mélatonine et le diabète de type 2 Le DT2 est une pathologie multifactorielle dont le développement dépend du patrimoine
génétique et de l’environnement de l’individu [4]. Pour comprendre le lien entre la MLT et le DT2, il faut savoir que
cette hormone peut avoir plusieurs types d’effets. Ses effets peuvent être
immédiats, suite à sa sécrétion nocturne, mais également prospectifs ou retardés,
généralement amorcés pendant la nuit, avec des conséquences fonctionnelles pendant
la journée ; des effets chronobiologiques reposant sur l’action directe de la MLT
sur l’horloge circadienne et saisonniers (dépendant de la durée de la nuit) sont
également décrits [5]. Il est
fortement probable que le dysfonctionnement de l’un ou de plusieurs de ces effets
contribue au développement du DT2. En effet, la dérégulation des cycles de sécrétion
de la MLT [6], des
dérégulations du rythme circadien [7] ou encore un sommeil insuffisant [8] augmentent le risque de développer le
DT2. Dans ce contexte de relation complexe entre la MLT et le DT2, la génétique humaine a
permis d’apporter des avancées majeures ces dix dernières années. Un variant
fréquent (rs10830963) positionné au niveau de l’intron du gène
MTNR1B codant le récepteur MT2 a été associé à la
dérégulation de l’homéostasie glycémique, augmentant ainsi le risque de développer
un DT2 [9]
(→).
(→) Voir la Synthèse d’A. Karamitri et al.,
m/s n° 8-9, août-septembre 2013, page 778
L’effet de l’allèle de risque du variant rs10830963 commence probablement
précocement, lors du développement de l’hyperglycémie à jeun chez les sujets
prédiabétiques, en affectant la sécrétion d’insuline [10]. Ces observations ont permis de formuler
l’hypothèse d’un éventuel dysfonctionnement du récepteur MT2 dans le
DT2. Les deux exons du gène MTNR1B ont été séquencés chez des personnes
normoglycémiques et diabètiques et 40 variants rares ont été découverts
(Figure 2). Ce travail
collaboratif entre le laboratoire du Pr Froguel et le nôtre a permis de montrer que
les variants ayant une perte de fonction étaient associés à un risque accru de
développement du DT2 [3]. Cette étude,
s’appuyant sur un grand nombre de variants MT2 naturels, a fourni une
opportunité unique de caractériser avec une grande précision un RCPG associé au
développement du DT2 [11].
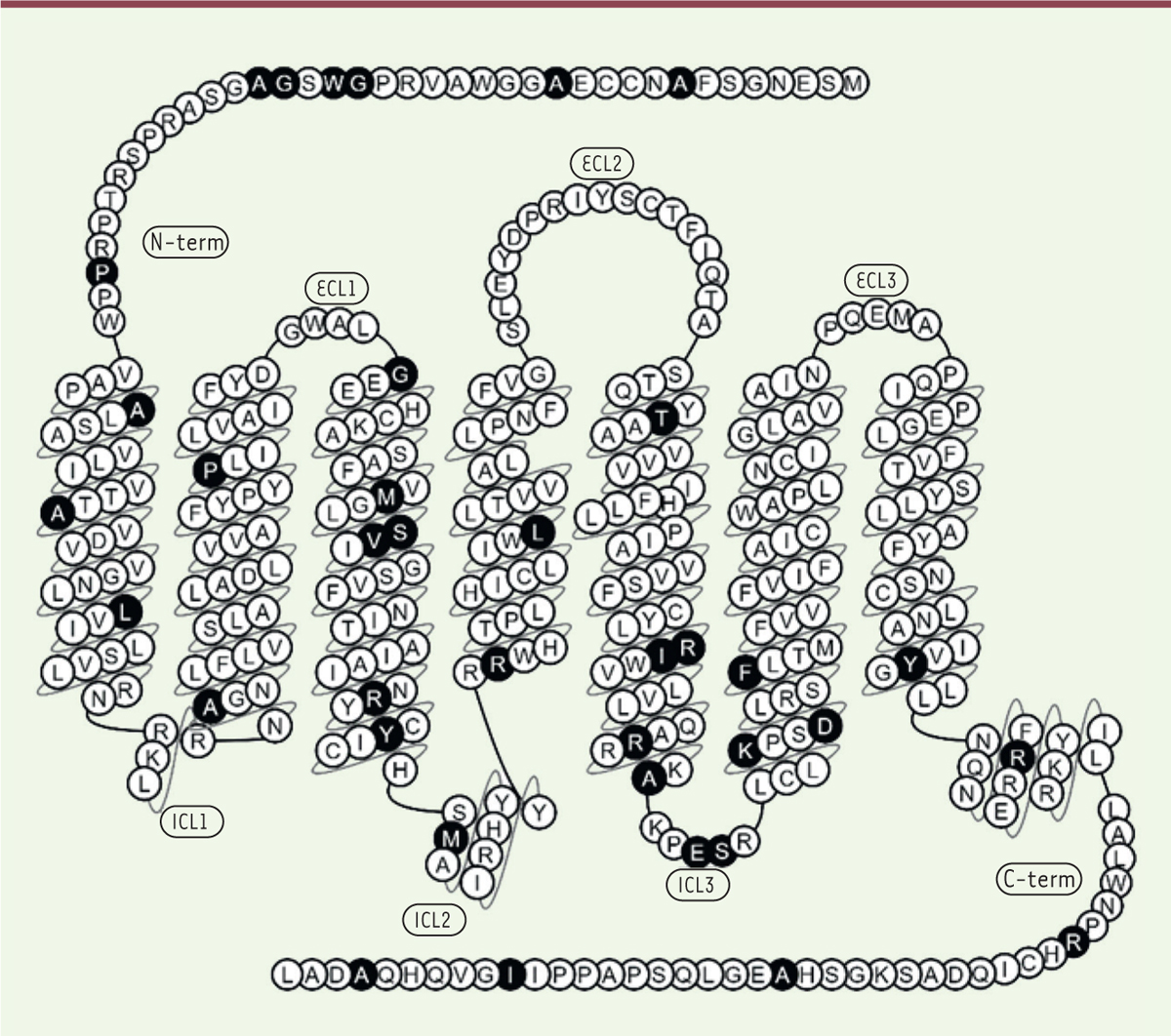
 | Figure 2.Représentation du récepteur MT2 et de la position des
différents variants rares identifiés. En noir
sont représentées les positions des différents variants identifiés dans
l’étude précédente menée par Bonnefond et al. [ 3]. |
|
Profilage transdisciplinaire des variants du récepteur MT2 Pour appréhender la nature du(des) défaut(s) fonctionnel(s) augmentant le risque des
porteurs de variants rares dans le gène MTNR1B de développer un
DT2, nous avons conjugué une analyse cellulaire et pharmacologique avec une analyse
bioinformatique. Profilage fonctionnel Nous avons dans un premier temps identifié l’ensemble des voies de signalisation
activées par le récepteur MT 2 sauvage, en l’absence (correspondant à
son activité constitutive) et en présence de son ligand. Cette étude a été
réalisée dans les cellules HEK293, un contexte cellulaire non-différencié
exprimant une large collection de protéines de signalisation, ce qui a permis de
déterminer le profil de signalisation d’un RCPG avec précision. Nous avons ainsi
révélé que le récepteur sauvage MT 2 était capable d’activer les
protéines Gαi/o et Gαz, de recruter la β-arrestine 2, d’entraîner la
phosphorylation d’ERK et d’inhiber la production d’AMPc. Après avoir enregistré
la signature de signalisation du récepteur MT 2 sauvage, nous nous
sommes intéressés à l’ensemble des 40 variants. Nous avons pu observer que
certaines variations avaient un impact sur l’activité spontanée du récepteur ou
sur sa puissance (DE 50) 1 ou son
efficacité (réponse maximale transduite par la MLT, ou E max) à
activer ou recruter une protéine suite à la liaison de la MLT. Selon le profil
de signalisation de chacun des variants, nous les avons classés en 8 catégories
: (1) les variants ayant une perte de liaison à la MLT ; (2) les variants ayant
une perte de signalisation de toutes les voies ; (3) ceux ayant une perte
d’activation de 2 voies ou plus ; (4) ceux ayant une perte d’activation
spécifique des protéines G lors de stimulation par la MLT ; (5) ceux ayant une
perte spécifique de recrutement de la β-arrestine 2 ; (6) ceux ayant un défaut
spécifique d’activation d’ERK ; (7) ceux ayant un gain de fonction ; et enfin
(8) ceux ayant un profil de signalisation similaire à celui du récepteur
MT 2 sauvage. Profilage bioinformatique La grande quantité de données collectées nous a permis de valider un modèle de
prédiction de l’impact de mutations sur la fonction de la protéine. Ce modèle à
action d’évolution (EA) repose sur l’importance relative de chaque résidu en
fonction de sa divergence évolutive [ 12]. Nous avons ainsi réalisé une corrélation entre les
prédictions de ce modèle informatique et les données expérimentales obtenues
pour ces mutants. Une corrélation entre le modèle informatique et les résultats
expérimentaux a pu être obtenue, confirmant sa robustesse pour la prédiction des
effets mutationnels sur un échantillon de 40 mutants. Cela conforte
l’homogénéité de nos résultats expérimentaux et valide le modèle de prédiction
pour de futures analyses de variants non-synonymes (entraînant un changement
d’acide aminé) dans les gènes codant des RCPG, estimés à environ 17 000 [ 13]. Profilage génétique et association avec le DT2 Afin de déterminer quels défauts de signalisation pouvaient avoir une influence
sur le développement du DT2, nous avons pris en compte 9 paramètres :
l’activation spontanée et induite par la MLT de Gαi1, Gαz, le recrutement
spontané et induit par la MLT de la β-arrestine 2, l’inhibition de la production
d’AMPc, l’activation d’ERK induite par la MLT et enfin l’absence de différences
de signalisation comparativement au récepteur sauvage (Figure 3). Grâce aux tests
statistiques, nous avons par la suite révélé que les mutants rares ayant un
défaut d’activation des protéines Gαi1 ou Gαz engendrée par la MLT et de
recrutement spontané de la β-arrestine 2 étaient associés de manière
préférentielle à un risque accru de développer le DT2. Ce résultat est
surprenant et remarquable à plusieurs titres. Dans le cas des protéines G,
l’activité constitutive n’est pas reliée à un risque accru de développer le DT2,
seule l’activité induite par la MLT l’est. La situation est inverse concernant
la β-arrestine 2. Ces résultats suggèrent donc deux types de défauts liés aux
mutants du récepteur MT 2 : l’un dépend de la capacité du récepteur à
activer des protéines G et l’autre de sa capacité à recruter la β-arrestine 2.
La composante dépendant des protéines G est régulée par le MT2 et est donc
rythmée par la sécrétion nocturne de la MLT. En revanche, la composante
dépendant de la β-arrestine 2 est uniquement liée à la quantité de
MT 2 exprimée dans la cellule et n’est pas limitée à la période
nocturne. Le niveau d’expression des récepteurs de la mélatonine peut varier de
façon circadienne, rajoutant un niveau supplémentaire de régulation [ 14, 15]. Ce résultat ouvre une nouvelle
voie de recherche qui viserait à mieux comprendre les conséquences
fonctionnelles du recrutement de la β-arrestine 2 au voisinage de
MT 2, conséquences qui restent pour l’instant peu explorées.
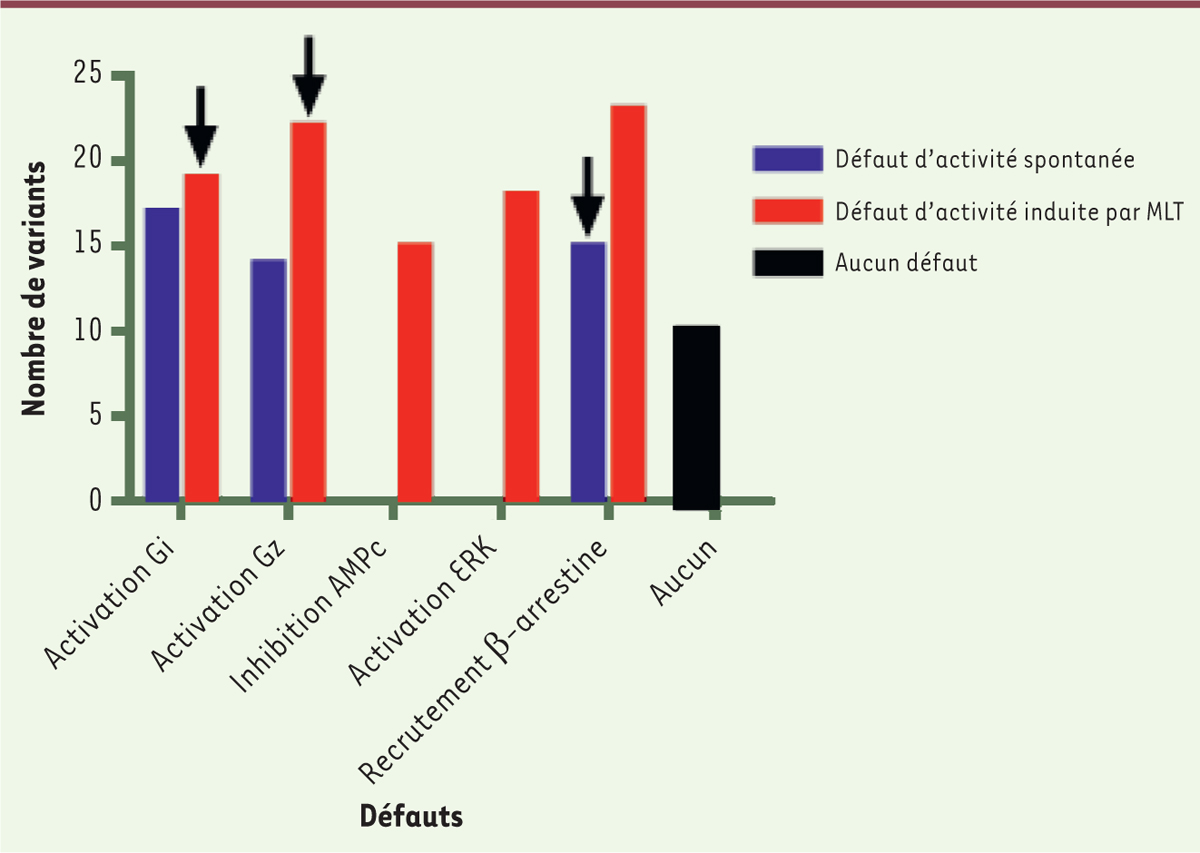
 | Figure 3. Représentation des mutants ayant des défauts de
signalisation. Représentation graphique du
nombre de mutants ayant un défaut dans les 8 paramètres testés
expérimentalement. En bleu sont représentés les mutants ayant un
défaut d’activité spontanée, en rouge les mutants ayant un défaut
d’activité induite par la mélatonine (MLT) et en noir ceux n’ayant
aucun défaut et ayant par conséquent le même profil de signalisation
que le récepteur de la mélatonine MT2 sauvage. Les
flèches indiquent les défauts associés à un risque accru de
développer le diabète de type 2 (DT2). |
|
Conclusion et perspectives Depuis de nombreuses années, les chercheurs tentent de relier des variants génétiques
à des risques accrus de développer certaines maladies pour trouver des traitements
mieux ciblés et présentant moins d’effets secondaires. C’est dans ce contexte que
cette étude fut réalisée. Au cours de celle-ci, nous avons caractérisé de manière
approfondie le récepteur MT2 sauvage ainsi que 40 mutants naturels. Nos
résultats ont montré que certains défauts fonctionnels du récepteur MT2,
dus à des variants rares, augmentent le risque de développer un DT2. Tant
l’activation des protéines G induite par la MLT durant la nuit que le recrutement
spontané de la β-arrestine 2 sur le récepteur MT2 semblent avoir un
impact sur le développement du DT2, nous indiquant l’importance du cycle circadien
dans le développement du DT2. Ces informations seront à la fois utiles pour de futures études sur le système
mélatoninergique, mais également pour le traitement du DT2, une maladie complexe et
multifactorielle qu’il est parfois difficile de traiter. Il serait maintenant
intéressant de développer des molécules permettant de restaurer la signalisation
normale des mutants associés à un risque accru de développer un DT2 dans le but
final de fournir un traitement personnalisé aux personnes souffrant de DT2. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les
données publiées dans cet article.
|
Nous tenons à remercier l’Agence nationale de la recherche (ANR-2011-BSV1-012-01 «
MLT2D » et ANR-2011-META « MELABETES », ANR-12-RPIB-0016 “MED-HET-REC-2”), la
Fondation pour la recherche médicale (Équipe FRM DEQ20130326503), le “Who am I?”
laboratory d’excellence No.ANR-11-LABX-0071 financé par le Gouvernement Français par
le programme “Grand Imprint“ R-11-IDEX-0005-01, ainsi que l’Inserm et le CNRS pour
leurs soutiens financiers. Nous remercions l’ensemble des collègues ayant participé
à la réalisation du travail publié dans la revue Science Signaling en 2018 pour leur
collaboration fructueuse, et en particulier Angeliki Karamitri, Bianca Plouffe et
Amélie Bonnefond, les trois premiers auteurs principaux de ce travail.
|
Footnotes |
1. Dubocovich
ML,
Delagrange
P,
Krause
DN, et al.
International union of basic and clinical pharmacology. LXXV.
Nomenclature, classification, and pharmacology of G protein-coupled
melatonin receptors . Pharmacol Rev .
2010; ; 62 :
:343.–380. 2. Jockers
R,
Delagrange
P,
Dubocovich
ML, et al.
Update on melatonin receptors: IUPHAR Review 20 .
Br J Pharmacol . 2016; ; 173 :
:2702.–2725. 3. Bonnefond
A,
Clement
N,
Fawcett
K, et al.
Rare MTNR1B variants impairing melatonin receptor 1B function
contribute to type 2 diabetes . Nat Genet .
2012; ; 44 :
:297.–301. 4. Bouatia-Naji
N,
Bonnefond
A,
Froguel
P. Avancées dans la
génétique de la glycémie à jeun : quelles leçons pour le diabète
? . Med Sci (Paris) . 2009; ;
25 :
:897.–902. 5. Cipolla-Neto
J,
Amaral
FG,
Afeche
SC, et al.
Melatonin, energy metabolism, and obesity: a
review . J Pineal Res . 2014; ;
56 :
:371.–381. 6. O’Brien
IA,
Lewin
IG,
O’Hare
JP, et al.
Abnormal circadian rhythm of melatonin in diabetic autonomic
neuropathy . Clin Endocrinol (Oxf) .
1986; ; 24 :
:359.–364. 7. Scheer
FA,
Hilton
MF,
Mantzoros
CS,
Shea
SA. Adverse
metabolic and cardiovascular consequences of circadian
misalignment . Proc Natl Acad Sci USA .
2009; ; 106 :
:4453.–4458. 8. Knutson
KL,
Ryden
AM,
Mander
BA, Van
Cauter
E. Role of sleep
duration and quality in the risk and severity of type 2 diabetes
mellitus . Arch Intern Med .
2006; ; 166 :
:1768.–1774. 9. Karamitri
A,
Vincens
M,
Chen
M,
Jockers
R. Implication des
mutations du récepteur de la mélatonine MT2 dans la survenue du diabète de
type 2 . Med Sci (Paris) . 2013;
; 29 : :778.–784. 10. Karamitri
A,
Jockers
R. Melatonin in type
2 diabetes mellitus and obesity . Nat Rev
Endocrinol . 2019; ; 15 :
:105.–125. 11. Karamitri
A,
Plouffe
B,
Bonnefond
A, et al.
Type 2 diabetes-associated variants of the MT2 melatonin receptor
affect distinct modes of signaling . Sci
Signal . 2018; ; 11 :
:545.. 12. Katsonis
P,
Lichtarge
O. A formal
perturbation equation between genotype and phenotype determines the
evolutionary action of protein-coding variations on fitness .
Genome Res . 2014; ; 24 :
:2050.–2058. 13. Karamitri
A. JR.
Exon sequencing of G protein-coupled receptor genes and
perspectives for disease treatment . In:
Stevens
C, eds. G protein-coupled
receptor genetics. Protocols methods in pharmacology and
toxicology . New York: :
Springer; , 2014 :
:313.–32. 14. Poirel
VJ,
Masson-Pevet
M,
Pevet
P,
Gauer
F. MT1 melatonin
receptor mRNA expression exhibits a circadian variation in the rat
suprachiasmatic nuclei . Brain Res .
2002; ; 946 :
:64.–71. 15. Beesley
S,
Lee
J,
Olcese
J. Circadian clock
regulation of melatonin MTNR1B receptor expression in human myometrial
smooth muscle cells . Mol Hum Reprod .
2015; ; 21 :
:662.–671. |