L’industrialisation de nos sociétés a entraîné de profonds changements dans notre mode de vie. Parallèlement, on observe une nette augmentation de l’incidence de multiples maladies inflammatoires chroniques. C’est en particulier vrai pour l’athérosclérose, la cause majeure des maladies cardio-vasculaires, qui sont responsables de plus de 30 % des décès dans le monde. L’athérosclérose est considérée comme une maladie inflammatoire chronique, caractérisée par la formation de plaques d’athérome suite à un dépôt de lipides, en particulier de cholestérol, dans la paroi des grosses et moyennes artères. Ces lipides, suite à leur modification biochimique, induisent une réaction inflammatoire locale qui perturbe la cicatrisation et favorise le recrutement de monocytes circulants, conduisant à une accumulation de macrophages inflammatoires gorgés de lipides, à l’origine du développement de la plaque d’athérome. Il n’est donc pas étonnant qu’une alimentation inadaptée à nos nouveaux modes de vie sédentaire ait été incriminée dans le développement des maladies cardio-vasculaires [1]. Mais qu’entendons-nous vraiment par « mode de vie » ? Par définition, le mode de vie d’un individu inclut tout ce qu’il fait, du réveil au coucher, et même pendant qu’il dort. Chacun se rappelle les conseils avisés de ses parents ou grands-parents « d’avoir une bonne nuit de sommeil pour récupérer ». Mais que cachent vraiment ces observations empiriques ? Des études épidémiologiques ont confirmé la pertinence des conseils de nos aïeux, en faisant le lien entre durée et/ou qualité du sommeil et prévalence des maladies cardio-vasculaires [2, 3]. Ainsi, il a été proposé qu’une nuit idéale pour nos artères serait d’environ 7 heures de sommeil. Bien entendu, les besoins peuvent différer d’un individu à l’autre. A cause de l’augmentation du temps de travail, l’accroissement du travail posté ou l’utilisation de dispositifs électroniques qui tend à changer la durée et la qualité du sommeil dans nos modes de vie modernes, il a été estimé qu’un français sur trois dort moins de 6 heures par nuit. Mais quels sont les mécanismes liant le manque de sommeil et l’athérosclérose ?
Afin de comprendre comment le sommeil protège contre les maladies cardio-vasculaires, McAlpine et al. ont étudié l’effet de la fragmentation du sommeil dans un modèle préclinique murin [4]. Des animaux susceptibles de développer des plaques d’athérome ont ainsi été tenus éveillés de manière intermittente par le déplacement d’une barre au fond des cages d’élevage, et comparés à des animaux qui avaient un cycle de sommeil normal. Ces auteurs ont ainsi prouvé que les souris ayant un sommeil fragmenté développaient plus de plaques d’athérome, un phénomène accompagné par une infiltration très importante de macrophages. Étonnamment, ce phénotype était associé à un état inflammatoire chronique caractérisé par une augmentation du nombre de globules blancs dans le sang, en particulier des monocytes et des polynucléaires neutrophiles, secondaire à une production accrue de ces cellules dans la moelle osseuse. Bien que l’association entre maladies cardio-vasculaires et taux élevé de leucocytes (hyperleucocytose) et monocytes (monocytose) dans le sang soit bien établie [1], l’existence d’un sommeil fragmenté n’avait pas été mise en évidence comme facteur de risque dans l’apparition de ces anomalies avant cette étude.
Dans leur article de synthèse paru en 2015, Nahrendorf et Swirski, derniers signataires de cette étude récente rapportant les résultats chez la souris, faisaient un premier bilan des arguments scientifiques permettant de relier le mode de vie dans nos sociétés industrialisées à l’existence d’une inflammation chronique à bas bruit, qui aboutit à une production accrue de globules blancs [1]. Ces auteurs discutaient du rôle de l’obésité (déséquilibre entre prise alimentaire excessive et sédentarité), de changements du microbiote liés également en grande partie à notre alimentation, et du stress psychique induisant la libération de corticostéroïdes ou de catécholamines [1]. En se fondant sur l’existence d’une régulation circadienne des polynucléaires neutrophiles et des monocytes, et sur le fait que les troubles du sommeil observés chez les individus souffrant d’apnées du sommeil étaient associés à une inflammation chronique (augmentation systémique du taux de cytokines inflammatoires), les auteurs présentaient déjà l’hypothèse d’un lien entre sommeil fragmenté et surproduction de globules blancs comme un mécanisme potentiel du développement des complications cardio-vasculaires [1]. Quatre ans plus tard, non seulement ils valident leur hypothèse, mais de plus, ils identifient un nouveau mécanisme qui enrichit nos connaissances sur la complexité du contrôle de la production des globules blancs dans la moelle osseuse.
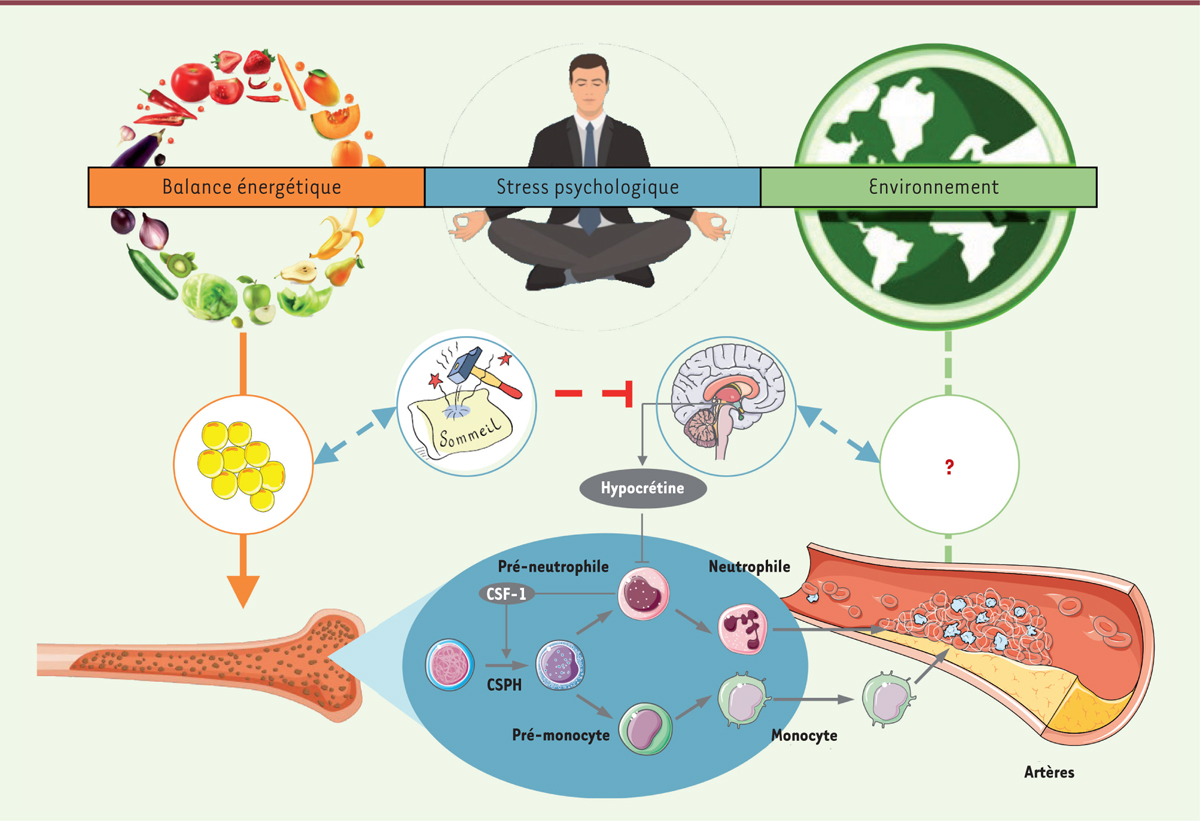
| Figure 1. Le sommeil fragmenté nuit à nos artères. Les
sociétés industrialisées ont connu de profonds changements du mode de vie,
concernant notamment notre équilibre énergétique, le stress psychique, et
l’environnement. Le lien entre ces changements et la forte augmentation de
l’incidence de multiples maladies inflammatoires chroniques n’est pas encore
complètement élucidé. Dans une étude récente chez la souris, McAlpine
et al. montrent que le sommeil fragmenté, d’ailleurs
souvent associé au stress psychique dans les sociétés humaines, détériore
les artères. En soumettant des souris, dans un modèle préclinique, à un
protocole de fragmentation du sommeil, les auteurs ont pu mettre en évidence
une diminution de la sécrétion d’hypocrétine, une hormone également connue
sous le nom d’orexine, par des neurones localisés dans l’hypothalamus. Cette
hormone agit sur des cellules pré-neutrophiles de la moelle osseuse. En
inhibant la synthèse du facteur de croissance CSF-1 (ou M-CSF, pour
macrophage colony-stimulating factor) par ces cellules,
l’hypocrétine limite la production de monocytes et polynucléaires
neutrophiles (des cellules impliquées dans l’inflammation), à partir des
cellules souches progénitrices hématopoïétiques (CSPH). La diminution de la
sécrétion d’hypocrétine lors d’un sommeil fragmenté entraîne au contraire
une production excessive de monocytes et de polynucléaires neutrophiles, qui
s’accumulent dans les artères, favorisant la formation de plaques
d’athérome. Il n’est pas exclu que d’autres mécanismes, en rapport avec les
effets métaboliques de l’hypocrétine, contribuent à la détérioration de la
paroi artérielle en cas de sommeil fragmenté. |
Le stress émotionnel, lié à une activité excessive de l’amygdale cérébrale, a été associé à une augmentation de l’activité de la moelle osseuse et une inflammation à bas bruit, qui prédisent les événements cardio-vasculaires [5]. Cependant, McAlpine et al. n’ont pas mis en évidence de modifications de la concentration du cortisol dans le sang ou de l’activité du système nerveux sympathique, ce qui indiquait que le sommeil fragmenté stimule l’hématopoïèse par un nouveau mécanisme [4]. Les auteurs ont également exclu un rôle du microbiote intestinal en montrant que l’augmentation de l’hématopoïèse liée à un sommeil fragmenté était maintenue après l’administration d’antibiotiques à large spectre. C’est en analysant l’expression des gènes de l’hypothalamus impliqués dans le contrôle du sommeil que les auteurs ont identifié une diminution de la production d’hypocrétine, également appelée orexine, un neurotransmetteur excitateur stimulant l’appétit et l’état d’éveil [6]. Les auteurs ont établi une corrélation entre la diminution des taux plasmatiques d’hypocrétine et l’augmentation de la production de globules blancs dans la moelle osseuse [4]. Intrigués par cette observation, ils ont alors produit des souris mutantes chez lesquelles le gène de l’hypocrétine avait été invalidé, et ont ainsi pu montrer que la déficience en hypocrétine augmentait la production des polynucléaires neutrophiles et des monocytes en accélérant la prolifération et la différenciation des cellules hématopoïétiques progénitrices de la moelle osseuse. En produisant des souris déficientes en hypocrétine dans un modèle de susceptibilité à l’athérosclérose, les auteurs ont également montré, chez ces souris, l’aggravation de la maladie athéromateuse associée à une accumulation de polynucléaires neutrophiles, de monocytes, et de macrophages dans les plaques d’athérome. Chez ces souris mutantes, la perfusion d’hypocrétine par une mini-pompe osmotique limite l’augmentation de l’hématopoïèse et le développement de l’athérosclérose induits par un sommeil fragmenté. Les auteurs concluent que la sécrétion hormonale d’hypocrétine pendant le sommeil serait un mécanisme central de protection contre la survenue de complications cardio-vasculaires.
Pour tenter de comprendre les mécanismes moléculaires sous-jacents, les auteurs ont trié 14 populations cellulaires différentes de la moelle osseuse. Ils ont trouvé que seuls les polynucléaires neutrophiles exprimaient l’ARNm du récepteur de l’hypocrétine, et que parmi ces cellules, les pré-neutrophiles l’exprimaient de manière encore plus abondante [4]. Mais quelle est le rôle de ces cellules ? Les pré-neutrophiles synthétisent le facteur de stimulation des colonies de macrophages (CSF-1, également appelé M-CSF, pour macrophage colony- stimulating factor), qui est impliqué dans la production des globules blancs de la lignée myélo-monocytaire à partir des cellules souches hématopoïétiques [7]. McAlpine et al. ont montré un effet inhibiteur de l’hypocrétine sur la production de CSF-1 par les pré-neutrophiles in vitro, et chez les souris déficientes pour l’hypocrétine, une augmentation de la production de CSF-1 par les pré-neutrophiles ex vivo et dans la moelle osseuse in vivo [4]. Ils ont également confirmé ce mécanisme de contrôle de l’hématopoïèse pendant le sommeil en invalidant CSF-1 dans la moelle osseuse de souris susceptibles à l’athérosclérose et en les soumettant à un sommeil fragmenté : ces souris étaient alors protégées contre l’augmentation de l’hématopoïèse et le développement d’une athérosclérose induits par un sommeil fragmenté. Cependant, d’autres mécanismes d’action de l’hypocrétine sur l’hématopoïèse sont possibles, en particulier du fait de ses effets métaboliques [6].
La diminution de la prise alimentaire chez les souris soumises à un sommeil fragmenté, malgré un poids corporel identique [4], suggère que leur dépense énergétique est diminuée et leur métabolisme altéré. Ces résultats sont à mettre en parallèle avec l’apparition d’une obésité et d’une intolérance au glucose tardive chez les souris déficientes en hypocrétine, et avec la plus grande incidence de l’obésité et de l’intolérance au glucose chez les patients narcoleptiques par déficience en hypocrétine [6]. L’absence d’effet du sommeil fragmenté sur la tolérance au glucose dans l’étude de McAlpine et al. [4] pourrait donc être expliquée par le fait que l’étude a été réalisée chez de jeunes souris. Bien que les mécanismes de la reprogrammation du métabolisme des cellules souches hématopoïétiques de la moelle osseuse soient encore mal connus, cette reprogrammation métabolique a été récemment impliquée dans de nombreuses maladies chroniques inflammatoires, induites entre autres par un régime riche en graisse ou une obésité d’origine génétique par déficience en leptine [8, 9]. Il n’est donc pas exclu qu’une telle reprogrammation des cellules hématopoïétiques soit liée aux effets métaboliques de la diminution d’hypocrétine observée chez les souris soumises à un sommeil fragmenté.
L’utilisation de corticostéroïdes et de médicaments anti-inflammatoires non stéroïdiens dans des maladies chroniques inflammatoires a été scrutée par les instances de santé pour leur effet faible mais potentiellement délétère sur le risque cardio-vasculaire. A l’inverse, l’essai clinique CANTOS ciblant la cytokine inflammatoire interleukine-1b a fourni des résultats encourageants pour réduire le risque cardio-vasculaire dans une population à haut risque [10]. Par ailleurs, compte-tenu des résultats récents de l’étude de McAlpine et al. chez la souris, que penser d’une éventuelle utilisation thérapeutique d’antagonistes du récepteur de l’hypocrétine, actuellement en développement en tant que médicaments contre l’insomnie ?
Outre les perspectives thérapeutiques pour diminuer le risque cardio-vasculaire lié aux troubles du sommeil, l’étude de McAlpine et al. ouvre des perspectives plus larges concernant les conséquences de notre mode de vie pour la santé [4]. Dans un article paru récemment, Latz prône une politique agressive d’éducation et de taxation pour réduire des facteurs de risque cardio-vasculaire bien connus tels que la « malbouffe » et la consommation excessive d’alcool ou de tabac [9]. Mais à l’heure de l’engouement collectif pour la consommation de produits issus de l’agriculture « biologique » et d’une prise de conscience de l’impact de l’environnement sur la santé par les pouvoirs publics, qu’en est-il de la prise en considération des autres facteurs de risque cardio-vasculaire ? Le livre du Dr Michel Lallement, paru en 2017, a mis en perspective « les 3 clés de la santé » : alimentation, psychisme (incluant les émotions), et environnement [11]. Mais que sait-on vraiment par exemple de l’impact de la pollution de l’air ou des perturbateurs endocriniens sur nos artères ? Le journal Le Monde a récemment révélé la conclusion d’une étude selon laquelle 107 766 années de vie en bonne santé seraient perdues chaque année en Ile-de-France à cause des nuisances sonores liées aux transports, dont on commence à mesurer les conséquences sur la qualité du sommeil, en particulier sa fragmentation. Les résultats de l’étude de McAlpine et al. publiés récemment pourraient donc contribuer à une véritable prise de conscience collective.