| |
| Med Sci (Paris). 36(11): 1018–1026. doi: 10.1051/medsci/2020172.La saga de l’induction neurale : presque un siècle de recherche Marc Moreau,1* Catherine Leclerc,1 and Isabelle Néant1 1Centre de biologie du développement (CBD), Centre de biologie intégrative (CBI), Université de Toulouse, CNRS, UPS
,
118 route de Narbonne
,
F-31062
,
Toulouse
,
France |
Dans le développement embryonnaire, l’induction est un processus d’interaction qui permet à un tissu, appelé tissu inducteur, de modifier le destin d’un autre tissu, appelé tissu cible. Pendant l’embryogenèse, l’induction neurale correspond au processus qui permet à des cellules de l’ectoderme (tissu cible) d’acquérir un destin neural en réponse à des signaux appropriés provenant d’une région spécifique du mésoderme dorsal de l’embryon (tissu inducteur)
(
Figure 1
)
. L’induction neurale se déroule pendant la gastrulation et conduit, sur la face dorsale de l’embryon, à la formation de la plaque neurale qui est à l’origine de l’ensemble du système nerveux. L’embryon d’amphibien a été le modèle de choix pour étudier ce processus. Au cours de cette synthèse, nous allons détailler toutes les grandes étapes qui ont conduit à la compréhension de ce processus.
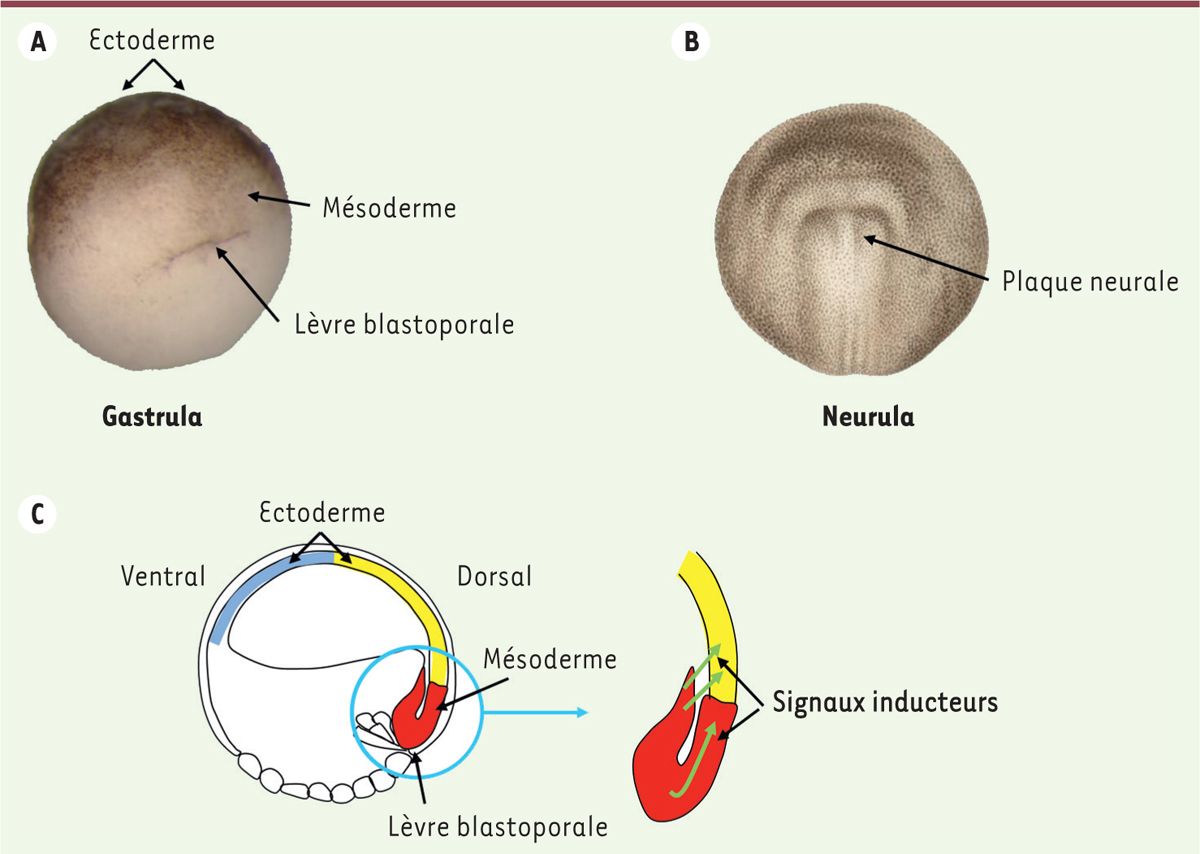
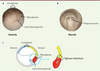 | Figure 1.
Le processus d’induction neurale pendant la gastrulation. A.
La gastrulation débute 9 heures après fécondation et dure environ 7 à 8 heures chez le xénope. Elle débute par l’internalisation des cellules du mésoderme dorsal au niveau de la lèvre du blastopore. Photo d’une jeune gastrula de xénope montrant l’ectoderme (tissu cible), le mésoderme dorsal (tissu inducteur) et la lèvre du blastopore sur la face dorsale dans l’hémisphère végétatif.
B.
Schéma d’une jeune neurula (16 heures après fécondation). La plaque neurale se forme sur la face dorsale de l’embryon.
C.
Schéma d’une coupe sagittale d’une jeune gastrula. Alors que l’ectoderme dorsal (jaune) est à l’origine du système nerveux, l’ectoderme ventral (bleu) va donner l’épiderme. Le mésoderme dorsal (rouge) est la source des signaux inducteurs (flèches vertes).
|
|
L’induction neurale chez les amphibiens
Pendant la gastrulation, les cellules de l’ectoderme embryonnaire donnent naissance aux progéniteurs épidermiques sur la face ventrale de l’embryon, et aux progéniteurs neuraux sur la face dorsale. Les expériences pionnières de Hans Spemann et Hilde Mangold (en 1924) ont montré que le mésoderme dorsal (appelé aussi organisateur de Spemann-Mangold) greffé sur la partie ventrale d’une gastrula receveuse induisait un second axe respectant les polarités dorso-ventrales et antéro-postérieures. Ainsi, le système nerveux du second axe s’était formé à partir de l’ectoderme ventral de la gastrula receveuse qui, à l’origine, était destiné à former de l’épiderme. Ces résultats importants montraient que pendant la gastrulation, l’ectoderme embryonnaire était induit à former du tissu neural en présence d’une source de signaux inducteurs issus du mésoderme dorsal [
1
-
3
]. Pour ce travail, Hans Spemann obtint en 1935 le prix Nobel de physiologie ou médecine. Hilde Mangold ne put malheureusement être associée à cette récompense car décédée accidentellement en 1932.
Les cellules de l’ectoderme ont donc le choix entre deux destins : neural ou épidermique. Le rôle de l’induction neurale est de spécifier l’ectoderme en neuroectoderme conduisant à la formation du système nerveux de l’adulte suivant l’axe antéro-postérieur. Rapidement a été montrée la conservation des mécanismes d’induction neurale chez les vertébrés, en particulier chez le poulet, le canard, le lapin ou encore la souris (pour revue voir [
4
]). À la suite de l’identification de l’organisateur et de l’induction neurale, beaucoup de laboratoires essayèrent de découvrir la nature de la molécule émise par l’organisateur qui orientait les cellules de l’ectoderme dorsal vers un destin neural. Pendant plus de 60 ans, jusqu’aux débuts des années 1990, ces travaux furent vains. Très tôt, dans différents laboratoires, il a été montré que des substances d’origine naturelle comme des stéroïdes, des protéines, des ARN, des ions, des lectines ou des tissus animaux chauffés étaient inductrices et induisaient un axe secondaire chez l’embryon. Il en était de même pour des composés chimiques comme le bleu de méthylène, des colorants histologiques ou des solutions d’alcool. Beaucoup de laboratoires investirent une grande énergie dans cette recherche qui resta infructueuse (pour revues [
4
-
7
]).
Cet échec est dû à plusieurs raisons : les techniques traditionnelles de biochimie pratiquées avaient probablement atteint leurs limites. Les substances inductrices étaient en très faible concentration ; de plus, les embryons d’amphibiens contiennent de grandes quantités de lipides et de vitellus interférant avec les techniques d’extraction. Les inducteurs chimiques semblaient spécifiques des amphibiens urodèles
1
(triton, ambystome), comme le montraient de nombreuses expériences. L’embryon de xénope (amphibien anoure), quant à lui, ne répondait pas à ces inducteurs non spécifiques [
8
,
9
].
Toutefois, de ces 60 ans de recherches infructueuses, un certain nombre de résultats méritent d’être retenus : (1) l’inducteur serait une molécule secrétée. En effet, il a été montré qu’un milieu de culture ayant contenu des mésodermes de salamandre est inducteur, et que l’inducteur était de nature protéique [
10
,
11
]. (2) La composition ionique du milieu de culture des embryons est fondamentale [
12
]. (3) Une lectine, la concanavaline A (ConA), possède des propriétés inductrices chez les amphibiens [
13
,
14
]. (4) L’ectoderme de l’embryon d’amphibien au stade blastula peut être disséqué et mis en culture dans un milieu purement ionique sans facteurs de croissance. On appelle cette préparation
calotte animale
ou
animal cap
. Les cellules de cette calotte animale sont pluripotentes et peuvent être induites à se différencier en tissu neural, mésodermique ou endodermique selon l’inducteur ajouté au milieu de culture
(
Figure 2
)
[
15
]. (5) Le signal neuralisant serait transmis
via
des récepteurs situés sur la membrane du tissu cible [
16
], ce qui posait le problème de la transduction du signal neuralisant. Dans les années 1980, dans la mesure où la recherche de l’inducteur avait épuisé en vain plusieurs générations de chercheurs, une nouvelle voie de recherche a emergé et a posé la question du rôle joué par les cellules du tissu cible, c’est-à-dire de l’ectoderme, dans le déclenchement de l’induction neurale [
13
]. En France, l’équipe d’Anne-Marie Duprat à Toulouse a développé ce concept [
17
]. Claudio Stern en 1984 [
18
] le résume ainsi : «
Whatever the mechanisms of action of the numerous inducing factors known up until now, it is therefore quite possible that the competent target tissue itself contains the capacity and the specificity needed for neural induction. All that these neuralizing factors so far studied would have in common is the capability to initiate the same signal which sets in motion the machinery of neural determination »
2
.
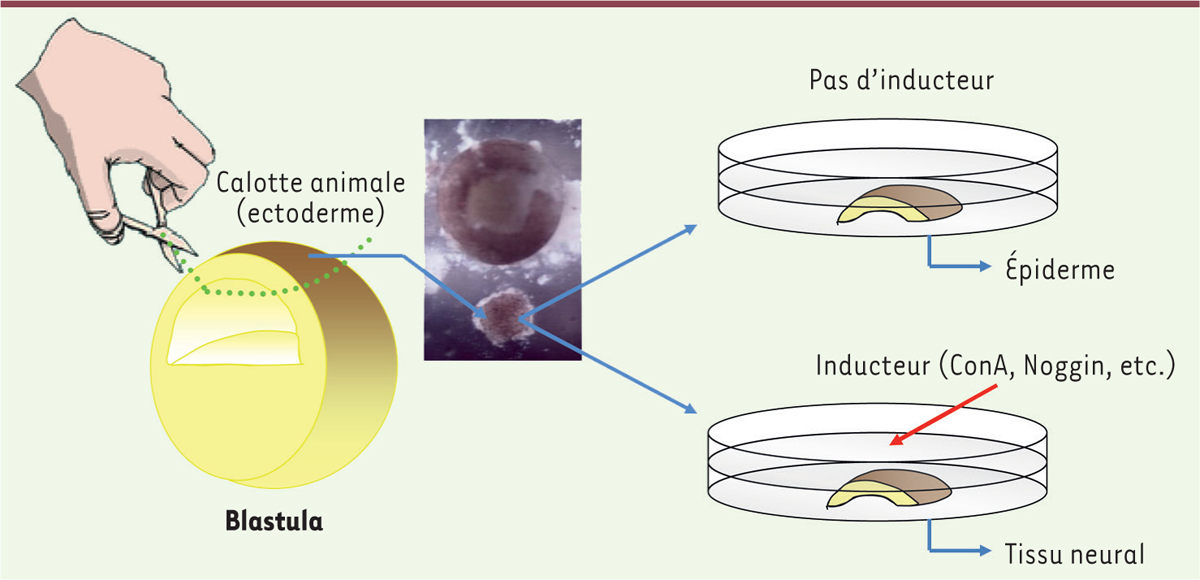
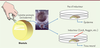 | Figure 2.
Le système des calottes animales pour étudier l’induction neurale.
Avant la gastrulation, au stade blastula, les cellules de l’ectoderme sont pluripotentes. Ce tissu peut être isolé (calottes animales) de l’embryon et mis en culture dans un milieu salin. Dans ce milieu, les cellules de la calotte animale donneront de l’épiderme. L’addition dans le milieu d’un inducteur neural (la Concanavaline A [ConA], ou la protéine Noggin) oriente les cellules dans la voie neurale.
|
Intéressé par ce concept et à la suite de discussion avec Anne-Marie Duprat, en 1989, j’ai rejoint son unité à Toulouse pour constituer avec Catherine Leclerc un groupe pour étudier la transduction du message neuralisant au niveau du tissu cible. Spécialistes de la signalisation calcique (Ca
2+
), nous nous sommes intéressés au rôle de cet ion dans ce mécanisme.
|
Ca
2+
et induction neurale
À cette période, dans de nombreux laboratoires, l’inducteur artificiel de choix utilisé chez l’amphibien était la ConA dont la concentration pouvait être maitrisée. Sur d’autres systèmes, cette lectine pouvait se lier à des canaux Ca
2+
de type L
3
sensibles aux dihydropyridines (DHP) [
19
]. En première approche, nous avons montré qu’effectivement, sur les calottes animales isolées de l’embryon d’urodèle,
Pleurodeles
, la ConA provoquait en moins de 10 minutes une entrée de Ca
2+
qui durait environ 20 minutes. Cette entrée de Ca
2+
était due à l’activation de canaux Ca
2+
de type L. L’inhibition pharmacologique de ces canaux empêchait l’induction neurale provoquée par la ConA [
20
]. De plus, sur des calottes animales, tous les agents pharmacologiques augmentant la concentration intracellulaire de Ca
2+
([Ca
2+
]
i
), que ce soient les dihydropyridines agonistes des canaux L, comme le BayK8644, ou les composés permettant une libération de Ca
2+
interne, comme la caféine ou la ryanodine, déclenchaient l’induction neurale, ce qui se traduisait en culture par la différenciation de neurones et de cellules gliales. Ces résultats démontraient que le Ca
2+
était nécessaire et suffisant pour déclencher l’induction neurale [
20
]. Toutes ces augmentations de [Ca
2+
]
i
sont transitoires et sont le signal déclencheur capable d’engager les cellules de l’ectoderme dans la voie neurale, l’expression des marqueurs neuraux ne se faisant que beaucoup plus tardivement.
|
Découverte du mécanisme d’induction
Les premières expériences décisives furent effectuées au cours des années 1990. Les premières molécules naturelles isolées de l’embryon et ayant des propriétés inductrices furent extraites à partir de l’embryon de poulet [
21
,
22
]. Toutefois, chez l’amphibien, elles induisaient, en fonction de leur concentration, du mésoderme ou de l’épiderme, mais pas de tissu neural [
23
]. La nature et le mécanisme d’action de ces molécules étaient inconnus. Plus tard, il a été montré que ces molécules correspondaient à l’activine A, un facteur de la famille du TGF-b (
transforming growth factor-beta
). Par contre, l’inhibition de cette signalisation par expression d’une forme tronquée du récepteur de type II de l’activine induisait l’expression de marqueurs neuraux. Ainsi, le blocage de la signalisation activine permettait aux cellules de l’ectoderme d’exprimer leur destin neural. Le tissu neural pouvait donc être induit par la suppression d’un inhibiteur [
24
]. Pendant cette période, il est aussi démontré que dans l’ectoderme de xénope, la protéine BMP4 (
bone morphogenetic protein 4
), un autre membre de la famille du TGF-b, est un activateur de la détermination épidermique et un inhibiteur la détermination neurale. Dans le même temps, trois gènes codant des protéines ayant des activités neuralisantes et sécrétées par le mésoderme dorsal furent caractérisés :
noggin
,
follistatin
et
chordin
. Il fut alors rapidement démontré que ces molécules se liaient physiquement à BMP4, bloquant ainsi sa fixation sur son récepteur et empêchant d’activer la voie de signalisation BMP et donc la détermination épidermique. Ces travaux ont conduit au concept de détermination neurale «
par défaut »
. Les cellules de l’ectoderme dorsal en contact avec le mésoderme dorsal n’ont d’autre choix que de se différencier en tissu neural (pour revue voir [
7
]). Soixante-dix ans après les travaux de Spemann et Mangold et beaucoup d’échecs dans les laboratoires, on avait enfin un mode d’action moléculaire de l’induction neurale.
Cependant le problème n’était pas complètement résolu. Quelle relation existait-il entre l’inhibition de la signalisation BMP et l’influx de Ca
2+
nécessaire et suffisant à la détermination neurale ? Dans l’ectoderme, quelle était la cascade de transduction entre des canaux membranaires et l’expression des gènes neuraux au niveau du noyau ?
|
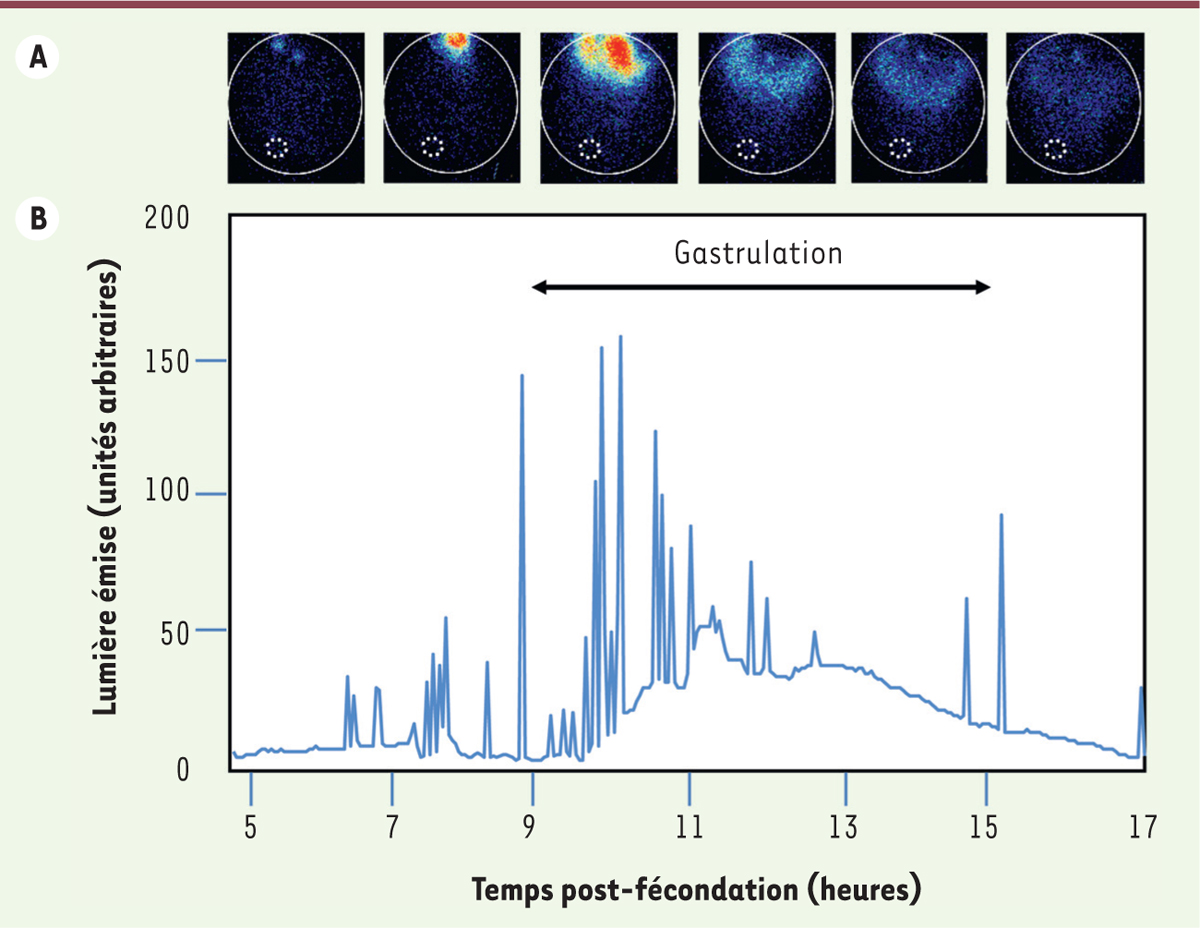
Visualisation des mouvements de Ca
2+
dans l’embryon de xénope pendant la gastrulation
Jusqu’alors, nous avions uniquement travaillé sur un système
in vitro
, les calottes animales. Afin de montrer que le Ca
2+
était un signal important pour l’induction neurale, il fallait pouvoir visualiser ces signaux calciques dans l’embryon en développement. Aussi, à partir de 1995, nous avons privilégié l’embryon de xénope pour nos études. Par des techniques d’imagerie utilisant l’æquorine
4
[
25
], nous avons visualisé,
in vivo
, et en temps réel pendant la gastrulation, les variations spontanées de concentration de Ca
2+
dans chaque cellule de l’ectoderme. Ces variations de Ca
2+
intracellulaire, sous forme de flashs de durées variables, débutent à la fin du stade blastula et augmentent en nombre jusqu’au milieu de la gastrulation, soit pendant l’induction neurale. Ces flashs ne sont observés que dans l’ectoderme dorsal, là où se déroule l’induction neurale. L’ectoderme ventral, destiné à devenir de l’épiderme, ne présente pas de signaux Ca
2+
détectables
(
Figure 3
)
. Dans l’ectoderme dorsal, cette signalisation est déterminante : l’induction neurale est en effet bloquée en présence d’un chélateur intracellulaire de Ca
2+
, le BAPTA-AM, ou en présence d’un inhibiteur spécifique des canaux Ca
2+
de type L [
26
].
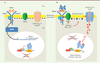
 | Figure 3.
Imagerie calcique in vivo, dans les cellules de l’ectoderme au cours de la gastrulation.
L’æquorine est une sonde calcique bioluminescente [
52
] (
→
).
|
(→) Voir l’article prix Nobel 2008 de M.T. Nicolas et M. Moreau,
m/s
n° 11, novembre 2008, page 983
|
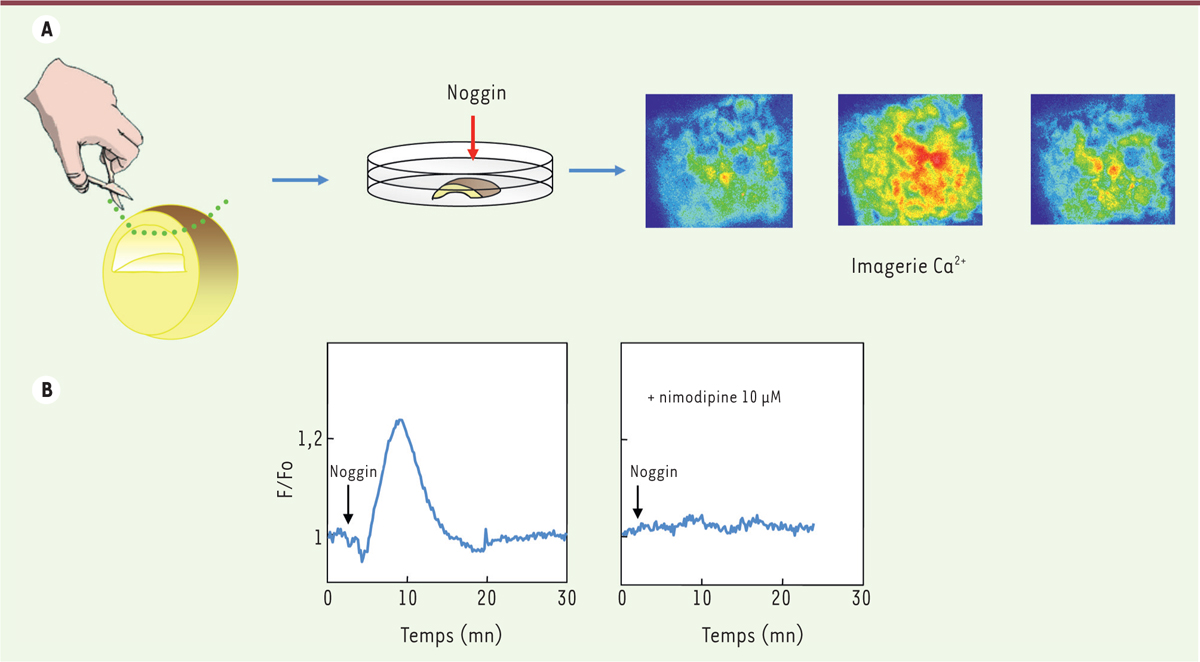
Quelle est la relation entre l’activation des canaux L et Noggin ?
Sur les calottes animales, Noggin, l’inhibiteur naturel de la signalisation BMP4, ajouté dans le milieu de culture provoque rapidement une augmentation transitoire de la concentration de calcium interne, [Ca
2+
]
i.
Cette augmentation est bloquée par les antagonistes des canaux L [
27
-
29
]
(
Figure 4
)
(
→
).
(→) Voir les Nouvelles de M. Moreau
et al.
,
m/s
n° 12, décembre 2006, page 1022 ; et de I. Néant
et al.
,
m/s
n° 4, avril 2006, page 346
 | Figure 4.
Imagerie calcique sur des calottes animales. A.
L’addition de Noggin dans le milieu induit très rapidement des variations de Ca
2+
intracellulaire [Ca
2+
]
i
qui sont mesurables avec une sonde calcique fluorescente, le Fluo3 [
51
]. Les variations de Ca
2+
sont codées en fausses couleurs allant du bleu au rouge. B. Les variations de Ca
2+
induites par Noggin sont transitoires (10-15 minutes) et sont inhibées par les dihydropyridines antagonistes des canaux calciques de type L, ici la nimodipine.
|
Ainsi, d’un côté, il y a Noggin, inducteur neural, et de l’autre, le calcium. Comment faire le lien entre BMP4 et les canaux Ca
2+
de type L ?
Les canaux L sont ouverts par une variation de potentiel
Les canaux de type L sont codés par 4 gènes Ca
V
1.1, Ca
V
1.2, Ca
V
1.3, Ca
V
1.4 [
30
]. Dans l’ectoderme de l’embryon de xénope, ce sont les canaux Ca
V
1.2 qui sont majoritairement présents [
31
]. Les canaux Ca
2+
Ca
V
1.2 sont dépendants du potentiel, c’est-à-dire qu’ils s’ouvrent lors d’une dépolarisation membranaire [
30
]. Nous avons montré sur les calottes animales que Noggin provoquait une dépolarisation allant jusqu’au seuil d’activation des canaux Ca
V
1.2 [
31
,
32
]. Toutefois, Noggin n’est pas un agoniste des canaux Ca
V
, et n’agit donc pas directement sur ceux-ci. Cette observation soulevait le problème de l’activation des canaux Ca
V
1.2 pendant le processus d’induction. Nous avons alors émis l’hypothèse qu’il existait une structure intermédiaire entre le récepteur BMP (BMPR) et les canaux Ca
V
1.2.
|
Caractérisation du chaînon manquant entre le récepteur BMP et les canaux Ca
V
1.2
Dans un travail précédent, nous avions montré que Noggin était capable d’activer TRPC1, un canal non-dépendant du potentiel de la famille des TRP (
transient receptor potential
), laissant entrer du Ca
2+
dans la cellule [
32
]. Ce canal est exprimé dans tout l’ectoderme de l’embryon de xénope aux stades blastula et gastrula, c’est-à dire au bon moment et au bon endroit pour jouer un rôle lors du processus d’induction neurale [
31
]. L’inhibition de son expression par des ARN antisens de type morpholinos bloque totalement l’action de Noggin, c’est-à-dire réduit fortement la dépolarisation membranaire au dessous du seuil d’activation des canaux Ca
V
1.2 et bloque les variations de Ca
2+
ainsi que son activité neuralisante [
31
]. Ces résultats suggéraient que TRPC1 pouvait être le lien entre le récepteur de BMP (BMPR) et les canaux Ca
V
1.2.
Relations entre BMPR et TRPC1
BMP4 se lie, sous forme de dimères, à des tétramères de récepteurs membranaires de type sérine/thréonine kinase, composés de deux récepteurs de type I (BMPRI) et deux de type II (BMPRII). La liaison de BMP4 produit une trans-phosphorylation de BMPRI par BMPRII. Cette liaison active la voie de signalisation des SMAD, responsable de la détermination épidermique [
33
]. Noggin provoque deux phénomènes : l’inhibition de la détermination épidermique et l’entrée de Ca
2+
responsable de l’induction neurale. Récemment, par des expériences d’immunoprécipitation, nous avons démontré que la partie C-terminale du récepteur BMPRII interagit avec TRPC1. Cette interaction est augmentée par Noggin, elle permet l’activation du canal TRPC1 provoquant l’entrée de Ca
2+
et de Na
+
. La dépolarisation membranaire résultante permet l’activation des canaux Ca
V
1.2 [
31
]
(
Figure 5
)
.
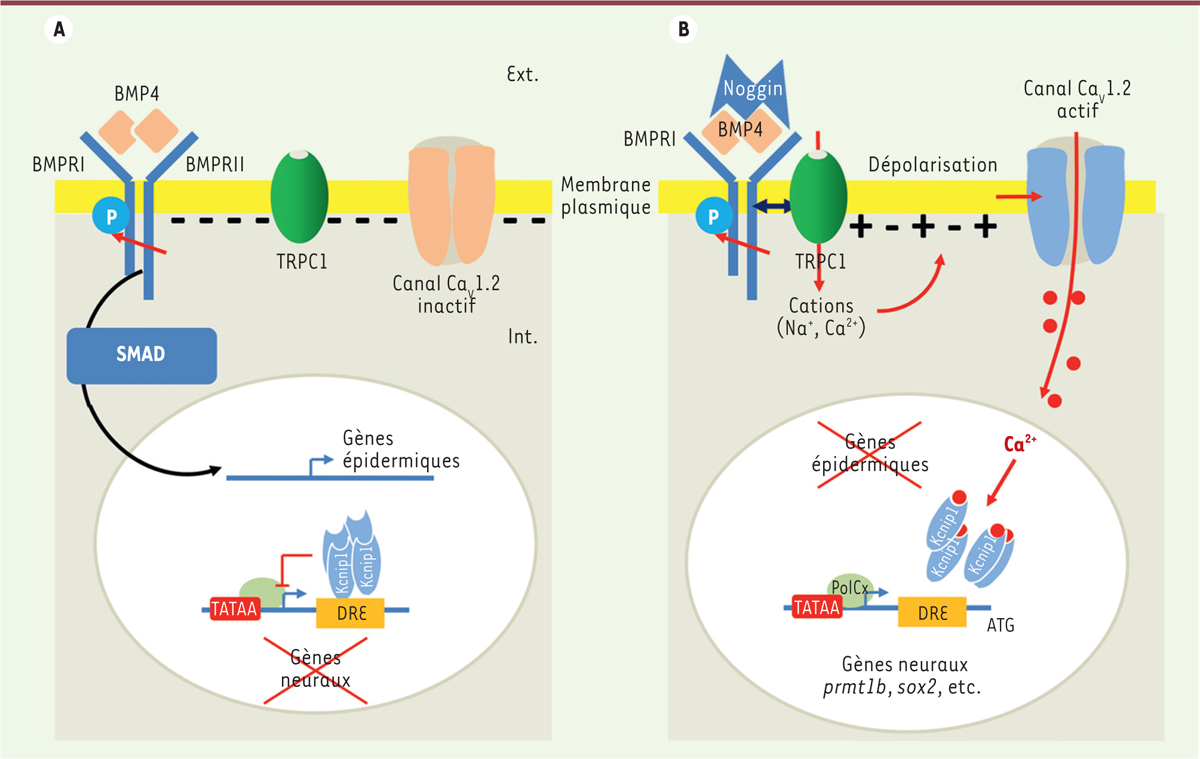
 | Figure 5.
Les acteurs identifiés de la transduction du signal neuralisant. A.
La signalisation BMP4 met en jeu des récepteurs à activité sérine/thréonine kinase (BMPRI et BMPRII). Lors de la fixation de BMP4 sous forme de dimères, la phosphorylation de BMPRI par BMPRII déclenche la phosphorylation des protéines effectrices SMAD et leur relocalisation dans le noyau où elles agissent alors comme facteurs de transcription sur les gènes cibles (gènes épidermiques). Lorsque la voie BMP est active, les gènes neuraux sont réprimés. Dans l’embryon, ce mécanisme est actif dans l’ectoderme ventral, destiné à donner du tissu épidermique.
B.
La protéine extracellulaire Noggin inhibe la voie BMP. Sa liaison avec BMP4 inhibe d’une part l’activation des gènes épidermiques et d’autre part augmente l’interaction entre le canal TRPC1 et le domaine C-terminal du récepteur BMPRII. Cette interaction qui permet l’activation des canaux TRPC1 et l’entrée de cations (Ca
2+
et Na
+
), induit la dépolarisation de la membrane. Ainsi, le potentiel passe d’environ -55 mV à -20 mV. Cette valeur correspond au seuil d’activation des canaux Ca
v
1.2. L’activation des canaux Ca
v
1.2 permet une entrée de Ca
2+
plus importante. Au niveau nucléaire, ce Ca
2+
régule directement la transcription de gènes neuraux précoces tels
prmt1b
et
sox2
. Prmt1b régule ensuite directement l’expression de
zic3
. Le mécanisme de régulation fait intervenir le répresseur transcriptionnel KCNIP1. KCNIP1 fait partie de la famille des protéines KCNIP qui constituent la classe E des senseurs de Ca
2+
. Ce sont des protéines globulaires de 217 à 270 acides aminés qui possèdent un domaine central très conservé contenant 4 motifs de liaison au Ca
2+
de type EF-hand (EF-1, EF-2, EF-3 et EF-4). Parmi ces quatre motifs, seul EF-1 n’est pas capable de lier le Ca
2+
. Les protéines KCNIP contrôlent la transcription des gènes de manière directe. Elles se lient, sous forme de tétramères, à des sites appelés DRE (
downstream regulatory element
) localisés dans la séquence 5’proximale du gène, en aval de la boîte TATA et en amont du codon START. La séquence GTCA forme le noyau central du site DRE. En absence de Ca
2+
, le site DRE est occupé et la transcription est réprimée. La liaison du Ca
2+
sur les sites EF-hand modifie l’affinité des tétramères KCNIP pour le site DRE, la transcription est alors possible. Dans l’embryon, ce mécanisme original est actif dans l’ectoderme dorsal, destiné à donner du tissu neural.
|
|
Le Ca
2+
active directement les gènes neuraux
Certains facteurs de transcription sont des cibles privilégiées du Ca
2+
[
34
]. Ainsi le gène
c-fos
est activé pendant l’induction neurale [
35
], qu’elle soit déclenchée par Noggin ou par une augmentation de [Ca
2+
]
i.
Deux gènes proneuraux,
pou2
et z
ic3
, sont également activés suite à la stimulation de l’ectoderme par Noggin ou par une variation de [Ca
2+
]
i
induite par l’activation pharmacologique des canaux Ca
V
1.2. Il est possible d’utiliser un modèle simplifié d’induction neurale. Ce modèle en deux dimensions consiste à prélever l’ectoderme rattaché au mésoderme dorsal et à le mettre en culture à plat sous une lamelle [
36
]. Seuls les signaux planaires issus du mésoderme diffuseront vers l’ectoderme. Ce modèle reproduit la plupart des aspects de l’induction neurale, comme les variations de la concentration de Ca
2+
intracellulaire, l’expression des gènes, la différenciation neurale et la régionalisation de la plaque neurale selon un axe antéro-postérieur. Grâce à ce système d’induction naturelle en deux dimensions, nous avons pu corréler l’expression de z
ic3
avec la répartition spatiale des transitoires de Ca
2+
[
37
]. Afin de mieux comprendre le rôle du Ca
2+
au cours de l’induction neurale, nous avons recherché des gènes précoces de la détermination neurale, contrôlés par le Ca
2+
. Une banque soustractive d’ADNc (ADN complémentaire) a été construite entre des calottes animales induites dans la voie neurale par une augmentation de [Ca
2+
]
i
et des calottes non traitées. Une trentaine de gènes précoces contrôlés par le Ca
2+
et qui s’expriment dans les futurs territoires neuraux ont ainsi été sélectionnés [
38
]. Le gène
prmt1b
qui code une arginine N-méthyl-transférase est un gène de réponse directe au Ca
2+
. Son expression est détectée dès le début de la gastrulation, dans tout l’ectoderme ainsi que dans le mésoderme dorsal puis, dans les stades plus tardifs, son expression est restreinte aux territoires neuraux. Dans l’embryon, la perte de fonction de
prmt1b
bloque le développement de la partie antérieure du système nerveux. Nous avons montré que
prmt1b
contrôle l’expression de
zic3
. Nos résultats suggèrent que
prmt1b
fait le lien entre l’augmentation de [Ca
2+
]
i
et les événements en aval de l’induction neurale [
28
,
38
].
|
Quel est le mécanisme d’action du Ca
2+
?
Dans la mesure où l’activation de
prmt1b
par le Ca
2+
est directe, le seul mécanisme actuellement connu de régulation transcriptionnelle directe par le Ca
2+
fait intervenir les senseurs de Ca
2+
de la famille KCNIP (
potassium channel-interacting proteins
) constituée de quatre protéines (KCNIP1 à 4). Ces protéines lient le Ca
2+
via
des sites de type EF-hand
5
. Elles régulent l’expression et l’activité de canaux potassiques mais agissent aussi comme répresseurs ou activateurs transcriptionnels. Elles se lient à une séquence spécifique de l’ADN, le site DRE (
downstream regulatory element
). Cette liaison est modulée par la fixation du Ca
2+
sur ses sites EF-hand [
39
].
Chez l’embryon de xénope, nous avons montré que le gène
kcnip1
est présent dans les territoires neuraux présomptifs, contrôle la prolifération des progéniteurs neuraux et que sa perte de fonction empêche la formation des structures neurales antérieures. Il faut noter que des sites DRE ont été identifiés sur les promoteurs des gènes proneuraux
prmt1b
et s
ox2
. Ainsi, dans l’ectoderme, en l’absence de signaux Ca
2+
, la protéine KCNIP1 est présente sur les sites DRE, empêchant la transcription des gènes neuraux
prmt1b
et s
ox2
[
40
]
(
Figure 5
)
.
|
La compréhension du mécanisme complet de l’induction neurale depuis les expériences de Spemann et Mangold dans les années 1920 jusqu’à la transduction du signal neuralisant conduisant à l’expression des gènes neuraux précoces a demandé pratiquement un siècle de recherche. Pendant longtemps on a pensé que le mécanisme de l’induction neurale était instructif, une molécule libérée par le mésoderme serait capable d’orienter les cellules de l’ectoderme dans la voie neurale. Les progrès ont été significatifs dans les années 1990 avec un changement de paradigme montrant que l’induction neurale pouvait être un mécanisme par défaut. En effet, la différenciation épidermique nécessitait un signal inducteur tandis que la différenciation neurale demandait seulement l’inhibition du signal épidermique. Par défaut, l’ectoderme serait destiné à donner du tissu neural [
41
].
Si la plupart des scientifiques du domaine se sont concentrés sur le signal inducteur, très peu de travaux ont concerné sa transduction. Ils ont été réalisés principalement chez l’amphibien mais ont été éphémères. Toutefois, il a été acquis que l’ester de phorbol PMA (phorbolmyristate acétate) qui active la protéine kinase C (PKC) induisait des marqueurs neuraux dans les calottes animales d’amphibiens [
42
]. Ces résultats sont en accord avec nos travaux concernant le rôle de la signalisation Ca
2+
. En effet, nous avons pu montrer que dans les cellules des calottes animales, les canaux Ca
2+
de type L étaient effectivement régulés par la PKC [
20
].
Si la levée de l’inhibition de la différenciation épidermique par les antagonistes de la signalisation BMP oriente par défaut les cellules de l’ectoderme dans la voie neurale, le message Ca
2+
dans la transduction a quant à lui un rôle instructif. En effet, nos résultats montrent clairement que l’activation de la voie de signalisation Ca
2+
est nécessaire et suffisante pour neuraliser l’ectoderme. Ils expliquent en grande partie pourquoi des substances hétérologues étaient inductrices. Ces molécules modifiaient de nombreux paramètres cellulaires, tels le pH, l’activation de canaux ioniques, la fluidité de la membrane. En fait, nous pensons que ces substances dépolarisaient indirectement la membrane et permettaient d’activer les canaux Ca
2+
.
Nous avons ici un modèle original où le Ca
2+
est capable d’induire directement l’expression de gènes, en agissant directement sur un répresseur transcriptionnel, KCNIP1 [
39
]. La variation de Ca
2+
n’a pas besoin d’être de longue durée. Le Ca
2+
se comporte comme un déclencheur irréversible de phénomènes plus tardifs comme la transcription des gènes neuraux.
Nous pouvons nous demander si le rôle de la signalisation Ca
2+
observée dans le cas de l’induction neurale chez l’amphibien peut être généralisé à d’autres modèles ?
À la suite de nos travaux, la signalisation Ca
2+
a été associée à l’induction neurale chez d’autres vertébrés, comme le poisson zèbre [
43
], l’embryon de poulet [
44
] ou chez des invertébrés comme l’ascidie
Ciona intestinalis
où des transitoires de concentration Ca
2+
intracellulaire sont observés lors de la formation de la plaque neurale. De plus, chez
Ciona,
un milieu appauvri en Ca
2+
inhibe le développement de la plaque neurale antérieure [
45
]. Les cellules souches embryonnaires humaines offrent la possibilité d’étudier l’induction neurale. Le rôle de la voie TGF-β et de la voie de signalisation canonique WNT/β-caténine ont été décrite lors de l’induction neurale dans ces cellules [
46
]. De manière plus importante, la voie de signalisation non canonique WNT/Ca
2+
joue probablement un rôle essentiel dans le choix entre destin neural ou destin épidermique dans la mesure où elle est régulée positivement lors de l’induction neurale dans les cellules souches embryonnaires humaines. De plus, il est montré que l’inhibition de la voie de signalisation Ca
2+
/CaMKII (
calmodulin-dependent protein kinase II
) en aval de la voie WNT non canonique, inhibe les gènes neuraux tels que
Pax6
et permet la sur-expression des marqueurs épidermiques comme
K18
. Ces résultats suggèrent que la voie de signalisation Ca
2+
/CaMKII oriente les cellules dans la voie neurale en bloquant le destin épidermique [
47
].
En conclusion, pendant plus de 60 ans, la quête du Graal pour de nombreux embryologistes a été la recherche du facteur inducteur instructif. Un certain nombre de chercheurs à la fin des années 1970 commençaient à douter de son existence. Løvtrup et ses collaborateurs traduisaient ce désarroi en écrivant
« few compounds, other than the philosopher’s stone, have been searched for more intensely than the presumed agent of primary induction in the amphibian embryo »
6
[
48
].
Comme cela a été montré dans les années 1990, la piste du facteur inducteur instructif n’était pas judicieuse [
49
,
50
]. Ces recherches infructueuses ont eu comme conséquence d’occulter jusqu’aux années 1980 un autre aspect important de l’induction neurale : le rôle joué par le tissu cible lui-même dans la transduction du message neuralisant. En choisissant de nous intéresser à cet aspect, nous avons pu disséquer une transduction faisant intervenir une signalisation Ca
2+
conduisant à l’expression des gènes neuraux précoces verrouillant le destin des cellules de l’ectoderme.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Cette revue est dédiée à Anne-Marie Duprat. Elle a su dès les années 1980 s’intéresser au rôle du tissu cible dans l’induction neurale, pressentir le rôle joué par les ions et nous faire confiance en nous accueillant dans son unité pour déchiffrer la transduction du message neuralisant. Nous tenons aussi à remercier Jean-Claude Beetschen pour les discussions passionnantes sur l’embryologie des amphibiens.
|
Footnotes |
1.
Spemann
H
,
Mangold
H
.
Über die induktion von embryonalanlagen durch implantation artfremder organisatoren.
.
Wihlem Roux’s Arch Entw Mech Org.
1924;
;
100
:
:599.
–
638
.
2.
Spemann
H
,
Mangold
H
.
Induction of embryonic primordia by implantation of organizers from a different species, 1923.
.
Int J Dev Biol.
2001;
;
45
:
:13.
–
38
.
3.
Gilbert
SF
,
Saxen
L
.
Spemann’s organizer : models and molecules.
.
Mech Dev.
1993;
;
41
:
:73.
–
89
.
4.
Stern
CD
.
Gastrulation. From cells to embryo.
.
New York:
:
Cold Spring Harbor Laboratory Press;
,
2004
:
:419.
–
32
.
5.
Grunz
H.
.
Neural induction in amphibians.
.
Curr Top Dev Biol.
1997;
;
35
:
:191.
–
228
.
6.
Grunz
H.
.
Developmental biology of amphibians after Hans Spemann in Germany.
.
Int J Dev Biol.
2001;
;
45
:
:39.
–
50
.
7.
Stern
CD
.
Neural induction : old problem, new findings, yet more questions.
.
Development.
2005;
;
132
:
:2007.
–
2021
.
8.
Ruiz i Altaba
A
.
Planar and vertical signals in the induction and patterning of the Xenopus nervous system.
.
Development.
1992;
;
116
:
:67.
–
80
.
9.
Kintner
CR
,
Melton
DA
.
Expression of Xenopus N-CAM RNA in ectoderm is an early response to neural induction.
.
Development.
1987;
;
99
:
:311.
–
325
.
10.
Niu
MC
,
Twitty
VC
.
The differentiation of gastrula ectoderm in medium conditioned by axial mesoderm.
.
Proc Natl Acad Sci USA.
1953;
;
39
:
:985.
–
989
.
11.
Saxen
L.
.
Transfilter neural induction of amphibian ectoderm.
.
Dev Biol.
1961;
;
3
:
:140.
–
152
.
12.
Barth
LG
.
The nature of the action of ions as inductors.
.
Biol Bull.
1965;
;
129
:
:471.
–
481
.
13.
Takata
K
,
Yamamoto
K
,
Ozawa
R
.
Use of lectins as probes for analyzing embryonic induction.
.
Roux’s Arch Dev Biol.
1981;
;
190
:
:92.
–
96
.
14.
Duprat
AM
,
Gualandris
L
,
Rouge
P
.
Neural induction and the structure of the target cell surface.
.
J Embryol Exp Morphol.
1982;
;
70
:
:171.
–
187
.
15.
Yamada
T
,
Takata
K
.
A technique for testing macromolecular samples in solution for morphogenetic effects on the isolated ectoderm of the amphibian gastrula.
.
Dev Biol.
1961;
;
3
:
:411.
–
423
.
16.
Tiedemann
H
,
Asashima
M
,
Grunz
H
,
Knochel
W
.
Neural induction in embryos.
.
Dev Growth Differ.
1998;
;
40
:
:363.
–
376
.
17.
Gualandris
L
,
Rouge
P
,
Duprat
AM
.
Membrane changes in neural target cells studied with fluorescent lectin probes.
.
J Embryol Exp Morphol.
1983;
;
77
:
:183.
–
200
.
18.
Stern
CD
.
Mini-review : hyaluronidases in early embryonic development.
.
Cell Biol Int Rep.
1984;
;
8
:
:703.
–
717
.
19.
Borsotto
M
,
Barhanin
J
,
Norman
RI
,
Lazdunski
M
.
Purification of the dihydropyridine receptor of the voltage-dependent Ca
2+
channel from skeletal muscle transverse tubules using
+
[3H]PN 200–110
.
.
Biochem Biophys Res Commun.
1984;
;
122
:
:1357.
–
1366
.
20.
Moreau
M
,
Leclerc
C
,
Gualandris-Parisot
L
,
Duprat
A
.
Increased internal Ca
2+
mediates neural induction in the amphibian embryo
.
.
Proc Natl Acad Sci USA.
1994;
;
91
:
:12639.
–
12643
.
21.
Born
J
,
Tiedemann
H
.
The mechanism of embryonic induction : isolation of an inhibitor for the vegetalizing factor.
.
Biochim Biophys Acta.
1972;
;
279
:
:174.
–
183
.
22.
Geithe
HP
,
Asashima
M
,
Asahi
KI
,
et al.
A vegetalizing inducing factor. Isolation and chemical properties.
.
Biochim Biophys Acta.
1981;
;
676
:
:350.
–
356
.
23.
Asashima
M
,
Nakano
H
,
Shimada
K
,
et al.
Mesodermal induction in early amphibian embryos by activin A (erythroid differentiation factor).
.
Roux Arch Dev Biol.
1990;
;
198
:
:330.
–
335
.
24.
Hemmati-Brivanlou
A
,
Melton
DA
.
Inhibition of activin receptor signaling promotes neuralization in Xenopus.
.
Cell.
1994;
;
77
:
:273.
–
281
.
25.
Miller
AL
,
Karplus
E
,
Jaffe
LF
.
Imaging [Ca
2+
]i with aequorin using a photon imaging detector
.
.
Methods Cell Biol.
1994;
;
40
:
:305.
–
338
.
26.
Leclerc
C
,
Webb
S
,
Daguzan
C
,
et al.
Imaging patterns of calcium transients during neural induction in Xenopus laevis embryos.
.
J Cell Sci.
2000;
;
113
:
:3519.
–
3529
.
27.
Leclerc
C
,
Daguzan
C
,
Nicolas
M
,
et al.
L-type calcium channel activation controls the in vivo transduction of the neuralizing signal in the amphibian embryos.
.
Mechanisms of Development.
1997;
;
64
:
:105.
–
110
.
28.
Moreau
M
,
Neant
I
,
Batut
J
,
et al.
L’induction neurale chez les amphibiens : un problème de calcium ?
.
Med Sci (Paris).
2006;
;
22
:
:1022.
–
1025
.
29.
Néant
I
,
Leclerc
C
,
Batut
J
,
et al.
Une augmentation du calcium intracellulaire contrôle l’expression d’une arginine N-méthyl-transférase impliquée dans la détermination neurale chez l’embryon d’amphibien.
.
Med Sci (Paris).
2006;
;
22
:
:346.
–
348
.
30.
Catterall
WA
,
Perez-Reyes
E
,
Snutch
TP
,
Striessnig
J
.
International union of pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels.
.
Pharmacol Rev.
2005;
;
57
:
:411.
–
425
.
31.
Néant
I
,
Leung
HC
,
Webb
SE
,
et al.
Trpc1 as the missing link between the Bmp and Ca.
.
Sci Rep.
2019;
;
9
:
:16049.
.
32.
Lee
KW
,
Moreau
M
,
Néant
I
,
et al.
FGF-activated calcium channels control neural gene expression in Xenopus.
.
Biochim Biophys Acta.
2009;
;
1793
:
:1033.
–
1040
.
33.
Moreau
M
,
Leclerc
C
.
The choice between epidermal and neural fate: a matter of calcium.
.
Int J Dev Biol.
2004;
;
48
:
:75.
–
84
.
34.
Murphy
TH
,
Worley
PF
,
Baraban
JM
.
L-type voltage-sensitive calcium channels mediate synaptic activation of immediate early genes.
.
Neuron.
1991;
;
7
:
:625.
–
635
.
35.
Leclerc
C
,
Duprat
A
,
Moreau
M
.
Noggin upregulates Fos expression by a calcium-mediated pathway in amphibian embryos.
.
Dev Growth Differ.
1999;
;
41
:
:227.
–
238
.
36.
Keller
R
,
Danilchik
M
.
Regional expression, pattern and timing of convergence and extension during gastrulation of Xenopus laevis.
.
Development.
1988;
;
103
:
:193.
–
209
.
37.
Leclerc
C
,
Lee
M
,
Webb
S
,
et al.
Calcium transients triggered by planar signals induce the expression of ZIC3 gene during neural induction in Xenopus.
.
Dev Biol.
2003;
;
261
:
:381.
–
390
.
38.
Batut
J
,
Vandel
L
,
Leclerc
C
,
et al.
The Ca
2+
-induced methyltransferase xPRMT1b controls neural fate in amphibian embryo
.
.
Proc Natl Acad Sci USA.
2005;
;
102
:
:15128.
–
15133
.
39.
Mellström
B
,
Naranjo
JR
.
Mechanisms of Ca
2+
-dependent transcription
.
.
Curr Opin Neurobiol.
2001;
;
11
:
:312.
–
319
.
40.
Néant
I
,
Mellström
B
,
Gonzalez
P
,
et al.
Kcnip1 a Ca²
+
-dependent transcriptional repressor regulates the size of the neural plate in Xenopus
.
.
Biochim Biophys Acta.
2015;
;
1853
:
:2077.
–
2085
.
41.
Weinstein
DC
,
Hemmati-Brivanlou
A
.
Neural induction in Xenopus laevis: evidence for the default model.
.
Curr Opin Neurobiol.
1997;
;
7
:
:7.
–
12
.
42.
Otte
AP
,
Koster
CH
,
Snoek
GT
,
Durston
AJ
.
Protein kinase C mediates neural induction in Xenopus laevis.
.
Nature.
1988;
;
334
:
:618.
–
620
.
43.
Webb
SE
,
Miller
AL
.
Ca
2+
signalling and early embryonic patterning during zebrafish development
.
.
Clin Exp Pharmacol Physiol.
2007;
;
34
:
:897.
–
904
.
44.
Papanayotou
C
,
De Almeida
I
,
Liao
P
,
et al.
Calfacilitin is a calcium channel modulator essential for initiation of neural plate development.
.
Nat Commun.
2013;
;
4
:
:1837.
.
45.
Hackley
C
,
Mulholland
E
,
Kim
GJ
,
et al.
A transiently expressed connexin is essential for anterior neural plate development in Ciona intestinalis.
.
Development.
2013;
;
140
:
:147.
–
155
.
46.
Stern
CD
.
Neural induction : 10 years on since the default model.
.
Curr Opin Cell Biol.
2006;
;
18
:
:692.
–
697
.
47.
Huang
CT
,
Tao
Y
,
Lu
J
,
et al.
Time-course gene expression profiling reveals a novel role of non-canonical WNT signaling during neural induction.
.
Sci Rep.
2016;
;
6
:
:32600.
.
48.
Løvtrup
,
Soren
.,
Landström
U
,
Løvtrup-Rein
H
.
Polarities, cell differentiation and primary induction in the amphibian embryo.
.
Biol Rev.
1978;
;
53
:
:1.
–
42
.
49.
Piccolo
S
,
Sasai
Y
,
Lu
B
,
De Robertis
EM
.
Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4.
.
Cell.
1996;
;
86
:
:589.
–
598
.
50.
Zimmerman
LB
,
De Jesus-Escobar
JM
,
Harland
RM
.
The Spemann organizer signal noggin binds and inactivates bone morphogenetic protein 4.
.
Cell.
1996;
;
86
:
:599.
–
606
.
51.
Whitaker
M.
.
Calcium imaging.
.
Methods Cell Biol.
2004;
;
74
:
:443.
–
468
.
52.
Nicolas
MT
,
Moreau
M
.
Prix Nobel de Chimie 2008 (Osumo Shimomura, Martin Chalfie et Roger Y. Tsien): Osamu Shimomura.
.
Med Sci (Paris).
2008;
;
24
:
:983.
–
984
.
|