Phtalates
2011
| ANALYSE |
37-
Études sur cultures d’organes et cellulaires
Pour appréhender les mécanimes d’action des phtalates sur le développement testiculaire chez le mâle, des travaux ont été menés sur des cultures d’organes. Le modèle de culture organotypique est fréquemment utilisé pour analyser l’impact à court terme d’une substance chimique sur le développement testiculaire. Ce modèle a l’avantage de conserver les interactions entre cellules somatiques et cellules germinales qui sont cruciales pour le bon développement des gonades. C’est par ailleurs le seul modèle qui permet d’adresser expérimentalement l’effet d’un perturbateur sur le développement de la gonade fœtale humaine. Différents travaux ont rapporté des effets des phtalates en culture organotypique de testicules fœtaux ou néonatals. Dans ce modèle, il est possible d’appréhender l’effet direct des phtalates sur le testicule fœtal et de contrôler précisément la dose d’exposition mais la prise en compte des différents métabolites produits in vivo est plus difficile à intégrer.
Les données obtenues suite aux expositions in vivo chez l’animal indiquent que l’ovaire est un organe cible de l’action des phtalates chez la femelle. Différents modèles cellulaires ont été développés pour étudier les effets des phtalates sur l’ovaire.
Les études toxicologiques in vivo ont essentiellement utilisé le DEHP ou le DBP alors que la plupart des études in vitro ont mesuré l’effet du MEHP (métabolite du DEHP) ou du MBP (métabolite du DBP).
Modèle d’étude sur cultures d’organes du développement testiculaire
Le groupe de R. Habert a étudié l’effet du MEHP (10 et 100 μM) sur des testicules fœtaux, issus de produits d’interruption volontaire de grossesse, âgés de 7 à 12 semaines de gestation (Lambrot et coll., 2009 ). Pour cela, un testicule a été traité au MEHP durant 72 h et ses paramètres ont été comparés à ceux du testicule contra-latéral qui sert de témoin ce qui permet de s’affranchir de la variabilité inter-individus. Dans ce modèle, le MEHP ne modifie ni la sécrétion de testostérone ni l’expression des enzymes de biosynthèse des stéroïdes. Une absence d’effet du DBP ou de son métabolite, le MBP (1 mM), avait également été rapportée sur les cellules de Leydig dans des testicules fœtaux humains plus âgés, de 15 à 20 semaines (Hallmark et coll., 2007
). Pour cela, un testicule a été traité au MEHP durant 72 h et ses paramètres ont été comparés à ceux du testicule contra-latéral qui sert de témoin ce qui permet de s’affranchir de la variabilité inter-individus. Dans ce modèle, le MEHP ne modifie ni la sécrétion de testostérone ni l’expression des enzymes de biosynthèse des stéroïdes. Une absence d’effet du DBP ou de son métabolite, le MBP (1 mM), avait également été rapportée sur les cellules de Leydig dans des testicules fœtaux humains plus âgés, de 15 à 20 semaines (Hallmark et coll., 2007 ).
).
 ). Pour cela, un testicule a été traité au MEHP durant 72 h et ses paramètres ont été comparés à ceux du testicule contra-latéral qui sert de témoin ce qui permet de s’affranchir de la variabilité inter-individus. Dans ce modèle, le MEHP ne modifie ni la sécrétion de testostérone ni l’expression des enzymes de biosynthèse des stéroïdes. Une absence d’effet du DBP ou de son métabolite, le MBP (1 mM), avait également été rapportée sur les cellules de Leydig dans des testicules fœtaux humains plus âgés, de 15 à 20 semaines (Hallmark et coll., 2007
). Pour cela, un testicule a été traité au MEHP durant 72 h et ses paramètres ont été comparés à ceux du testicule contra-latéral qui sert de témoin ce qui permet de s’affranchir de la variabilité inter-individus. Dans ce modèle, le MEHP ne modifie ni la sécrétion de testostérone ni l’expression des enzymes de biosynthèse des stéroïdes. Une absence d’effet du DBP ou de son métabolite, le MBP (1 mM), avait également été rapportée sur les cellules de Leydig dans des testicules fœtaux humains plus âgés, de 15 à 20 semaines (Hallmark et coll., 2007 ).
).Deux études du groupe de R. Sharpe rapportent qu’une exposition in utero n’altère pas durablement la production de testostérone chez le marmouset (Hallmark et coll., 2007 ; McKinnell et coll., 2009
; McKinnell et coll., 2009 ). Ces données sont surprenantes au regard des nombreux travaux qui démontrent une baisse de la production de testostérone en réponse à une exposition in utero au DBP ou au DEHP chez le rat (Mylchreest et coll., 2002
). Ces données sont surprenantes au regard des nombreux travaux qui démontrent une baisse de la production de testostérone en réponse à une exposition in utero au DBP ou au DEHP chez le rat (Mylchreest et coll., 2002 ; Fisher et coll., 2003
; Fisher et coll., 2003 ; Thompson et coll., 2004
; Thompson et coll., 2004 ; Wilson et coll., 2004
; Wilson et coll., 2004 ; Mahood et coll., 2005
; Mahood et coll., 2005 ; Borch et coll., 2006
; Borch et coll., 2006 ; Mahood et coll., 2006
; Mahood et coll., 2006 ; Hallmark et coll., 2007
; Hallmark et coll., 2007 ; Culty et coll., 2008
; Culty et coll., 2008 ; Lin et coll., 2008a
; Lin et coll., 2008a ; Howdeshell et coll., 2008
; Howdeshell et coll., 2008 ).
).
 ; McKinnell et coll., 2009
; McKinnell et coll., 2009 ). Ces données sont surprenantes au regard des nombreux travaux qui démontrent une baisse de la production de testostérone en réponse à une exposition in utero au DBP ou au DEHP chez le rat (Mylchreest et coll., 2002
). Ces données sont surprenantes au regard des nombreux travaux qui démontrent une baisse de la production de testostérone en réponse à une exposition in utero au DBP ou au DEHP chez le rat (Mylchreest et coll., 2002 ; Fisher et coll., 2003
; Fisher et coll., 2003 ; Thompson et coll., 2004
; Thompson et coll., 2004 ; Wilson et coll., 2004
; Wilson et coll., 2004 ; Mahood et coll., 2005
; Mahood et coll., 2005 ; Borch et coll., 2006
; Borch et coll., 2006 ; Mahood et coll., 2006
; Mahood et coll., 2006 ; Hallmark et coll., 2007
; Hallmark et coll., 2007 ; Culty et coll., 2008
; Culty et coll., 2008 ; Lin et coll., 2008a
; Lin et coll., 2008a ; Howdeshell et coll., 2008
; Howdeshell et coll., 2008 ).
).Par ailleurs, des données sur culture d’organe chez le rat indiquent soit une baisse de la production de testostérone en réponse au MEHP, métabolite du DEHP (Chauvigné et coll., 2009 ), soit une absence d’effet du MBP, métabolite du DBP (Hallmark et coll., 2007
), soit une absence d’effet du MBP, métabolite du DBP (Hallmark et coll., 2007 ). Ces observations sur cultures d’organes divergentes peuvent être attribuées à l’utilisation de différents types de phtalates ou à des expositions à des âges variables. L’absence d’effet du MBP sur culture d’organe a été décrite en fin de gestation, lorsque la production de testostérone atteint un plateau chez le rat, alors que l’effet du MEHP (baisse de la production de testostérone) a été rapporté au début de l’organogenèse testiculaire, lorsque la production de testostérone augmente fortement. L’intervention d’effets extra-testiculaires ne peut cependant être exclue et des travaux additionnels seront nécessaires pour comprendre ces différences.
). Ces observations sur cultures d’organes divergentes peuvent être attribuées à l’utilisation de différents types de phtalates ou à des expositions à des âges variables. L’absence d’effet du MBP sur culture d’organe a été décrite en fin de gestation, lorsque la production de testostérone atteint un plateau chez le rat, alors que l’effet du MEHP (baisse de la production de testostérone) a été rapporté au début de l’organogenèse testiculaire, lorsque la production de testostérone augmente fortement. L’intervention d’effets extra-testiculaires ne peut cependant être exclue et des travaux additionnels seront nécessaires pour comprendre ces différences.
 ), soit une absence d’effet du MBP, métabolite du DBP (Hallmark et coll., 2007
), soit une absence d’effet du MBP, métabolite du DBP (Hallmark et coll., 2007 ). Ces observations sur cultures d’organes divergentes peuvent être attribuées à l’utilisation de différents types de phtalates ou à des expositions à des âges variables. L’absence d’effet du MBP sur culture d’organe a été décrite en fin de gestation, lorsque la production de testostérone atteint un plateau chez le rat, alors que l’effet du MEHP (baisse de la production de testostérone) a été rapporté au début de l’organogenèse testiculaire, lorsque la production de testostérone augmente fortement. L’intervention d’effets extra-testiculaires ne peut cependant être exclue et des travaux additionnels seront nécessaires pour comprendre ces différences.
). Ces observations sur cultures d’organes divergentes peuvent être attribuées à l’utilisation de différents types de phtalates ou à des expositions à des âges variables. L’absence d’effet du MBP sur culture d’organe a été décrite en fin de gestation, lorsque la production de testostérone atteint un plateau chez le rat, alors que l’effet du MEHP (baisse de la production de testostérone) a été rapporté au début de l’organogenèse testiculaire, lorsque la production de testostérone augmente fortement. L’intervention d’effets extra-testiculaires ne peut cependant être exclue et des travaux additionnels seront nécessaires pour comprendre ces différences.Chez la souris, aucun effet n’a été observé in utero (Gaido et coll., 2007 ). Sur culture d’organes, des effets positifs et négatifs sur la stéroïdogenèse testiculaire fœtale ont été rapportés selon l’âge ou la présence de LH (Lehraiki et coll., 2009
). Sur culture d’organes, des effets positifs et négatifs sur la stéroïdogenèse testiculaire fœtale ont été rapportés selon l’âge ou la présence de LH (Lehraiki et coll., 2009 ). Les effets sur la production de testostérone apparaissent donc variables selon l’espèce et le mode d’administration des phtalates, in vivo ou in vitro.
). Les effets sur la production de testostérone apparaissent donc variables selon l’espèce et le mode d’administration des phtalates, in vivo ou in vitro.
 ). Sur culture d’organes, des effets positifs et négatifs sur la stéroïdogenèse testiculaire fœtale ont été rapportés selon l’âge ou la présence de LH (Lehraiki et coll., 2009
). Sur culture d’organes, des effets positifs et négatifs sur la stéroïdogenèse testiculaire fœtale ont été rapportés selon l’âge ou la présence de LH (Lehraiki et coll., 2009 ). Les effets sur la production de testostérone apparaissent donc variables selon l’espèce et le mode d’administration des phtalates, in vivo ou in vitro.
). Les effets sur la production de testostérone apparaissent donc variables selon l’espèce et le mode d’administration des phtalates, in vivo ou in vitro.Une autre altération induite par le MEHP dans le testicule fœtal humain est la diminution des fonctions sertoliennes et notamment la diminution de l’expression de l’hormone anti-Müllérienne (AMH) (Lambrot et coll., 2009 ). Cet effet a également été retrouvé dans les testicules fœtaux de rat et de souris en culture organotypique (Li et Kim, 2003
). Cet effet a également été retrouvé dans les testicules fœtaux de rat et de souris en culture organotypique (Li et Kim, 2003 ; Chauvigné et coll., 2009
; Chauvigné et coll., 2009 ; Lehraiki et coll., 2009
; Lehraiki et coll., 2009 ). Cette observation n’a pas encore été décrite in vivo probablement du fait de la nature transitoire de cette sécrétion mais la persistance des canaux de Müller, futur tractus femelle, n’a pas non plus été rapportée. En revanche, plusieurs études montrent qu’un traitement in utero chez le rat induit une désorganisation des cordons testiculaires (formés par les cellules de Sertoli) sans pour autant que celle-ci soit systématiquement décrite.
). Cette observation n’a pas encore été décrite in vivo probablement du fait de la nature transitoire de cette sécrétion mais la persistance des canaux de Müller, futur tractus femelle, n’a pas non plus été rapportée. En revanche, plusieurs études montrent qu’un traitement in utero chez le rat induit une désorganisation des cordons testiculaires (formés par les cellules de Sertoli) sans pour autant que celle-ci soit systématiquement décrite.
 ). Cet effet a également été retrouvé dans les testicules fœtaux de rat et de souris en culture organotypique (Li et Kim, 2003
). Cet effet a également été retrouvé dans les testicules fœtaux de rat et de souris en culture organotypique (Li et Kim, 2003 ; Chauvigné et coll., 2009
; Chauvigné et coll., 2009 ; Lehraiki et coll., 2009
; Lehraiki et coll., 2009 ). Cette observation n’a pas encore été décrite in vivo probablement du fait de la nature transitoire de cette sécrétion mais la persistance des canaux de Müller, futur tractus femelle, n’a pas non plus été rapportée. En revanche, plusieurs études montrent qu’un traitement in utero chez le rat induit une désorganisation des cordons testiculaires (formés par les cellules de Sertoli) sans pour autant que celle-ci soit systématiquement décrite.
). Cette observation n’a pas encore été décrite in vivo probablement du fait de la nature transitoire de cette sécrétion mais la persistance des canaux de Müller, futur tractus femelle, n’a pas non plus été rapportée. En revanche, plusieurs études montrent qu’un traitement in utero chez le rat induit une désorganisation des cordons testiculaires (formés par les cellules de Sertoli) sans pour autant que celle-ci soit systématiquement décrite.Enfin, l’effet le plus marquant des travaux sur le testicule fœtal humain est l’observation d’un effet pro-apoptotique du MEHP sur les cellules germinales (Rouiller-Fabre et coll., 2008 ; Lambrot et coll., 2009
; Lambrot et coll., 2009 ). L’exposition au MEHP pendant 72 h sur culture d’organe augmente significativement l’apoptose des gonocytes humains, les cellules germinales précurseurs de spermatogonies, et ce dès 10 μM. Dans cette étude, l’apoptose a été détectée par immunohistochimie de la caspase-3 clivée. Cet effet est corrélé à une diminution du nombre de gonocytes de 40 % à 100 μM. Cet effet a également été retrouvé dans les testicules fœtaux en culture de rats (Chauvigné et coll., 2009
). L’exposition au MEHP pendant 72 h sur culture d’organe augmente significativement l’apoptose des gonocytes humains, les cellules germinales précurseurs de spermatogonies, et ce dès 10 μM. Dans cette étude, l’apoptose a été détectée par immunohistochimie de la caspase-3 clivée. Cet effet est corrélé à une diminution du nombre de gonocytes de 40 % à 100 μM. Cet effet a également été retrouvé dans les testicules fœtaux en culture de rats (Chauvigné et coll., 2009 ) et de souris (Lehraiki et coll., 2009
) et de souris (Lehraiki et coll., 2009 ). Sur ce point, les travaux effectués chez la souris apportent un éclairage particulier grâce à l’utilisation de souris mutantes pour le récepteur aux œstrogènes et pour le récepteur aux androgènes qui a permis de démontrer que l’effet apoptotique germinal du MEHP était indépendant des récepteurs nucléaires canoniques aux œstrogènes et androgènes (Lehraiki et coll., 2009
). Sur ce point, les travaux effectués chez la souris apportent un éclairage particulier grâce à l’utilisation de souris mutantes pour le récepteur aux œstrogènes et pour le récepteur aux androgènes qui a permis de démontrer que l’effet apoptotique germinal du MEHP était indépendant des récepteurs nucléaires canoniques aux œstrogènes et androgènes (Lehraiki et coll., 2009 ). Deux études décrivent un effet semblable lors d’une exposition in utero chez le rat (Fisher et coll., 2003
). Deux études décrivent un effet semblable lors d’une exposition in utero chez le rat (Fisher et coll., 2003 ; Ferrara et coll., 2006
; Ferrara et coll., 2006 ). Cette atteinte des cellules germinales pendant la vie fœtale pourrait expliquer les altérations de la fertilité mâle décrite chez le rat adulte après une exposition in utero (Mahood et coll., 2006
). Cette atteinte des cellules germinales pendant la vie fœtale pourrait expliquer les altérations de la fertilité mâle décrite chez le rat adulte après une exposition in utero (Mahood et coll., 2006 ; Ferrara et coll., 2006
; Ferrara et coll., 2006 ).
).
 ; Lambrot et coll., 2009
; Lambrot et coll., 2009 ). L’exposition au MEHP pendant 72 h sur culture d’organe augmente significativement l’apoptose des gonocytes humains, les cellules germinales précurseurs de spermatogonies, et ce dès 10 μM. Dans cette étude, l’apoptose a été détectée par immunohistochimie de la caspase-3 clivée. Cet effet est corrélé à une diminution du nombre de gonocytes de 40 % à 100 μM. Cet effet a également été retrouvé dans les testicules fœtaux en culture de rats (Chauvigné et coll., 2009
). L’exposition au MEHP pendant 72 h sur culture d’organe augmente significativement l’apoptose des gonocytes humains, les cellules germinales précurseurs de spermatogonies, et ce dès 10 μM. Dans cette étude, l’apoptose a été détectée par immunohistochimie de la caspase-3 clivée. Cet effet est corrélé à une diminution du nombre de gonocytes de 40 % à 100 μM. Cet effet a également été retrouvé dans les testicules fœtaux en culture de rats (Chauvigné et coll., 2009 ) et de souris (Lehraiki et coll., 2009
) et de souris (Lehraiki et coll., 2009 ). Sur ce point, les travaux effectués chez la souris apportent un éclairage particulier grâce à l’utilisation de souris mutantes pour le récepteur aux œstrogènes et pour le récepteur aux androgènes qui a permis de démontrer que l’effet apoptotique germinal du MEHP était indépendant des récepteurs nucléaires canoniques aux œstrogènes et androgènes (Lehraiki et coll., 2009
). Sur ce point, les travaux effectués chez la souris apportent un éclairage particulier grâce à l’utilisation de souris mutantes pour le récepteur aux œstrogènes et pour le récepteur aux androgènes qui a permis de démontrer que l’effet apoptotique germinal du MEHP était indépendant des récepteurs nucléaires canoniques aux œstrogènes et androgènes (Lehraiki et coll., 2009 ). Deux études décrivent un effet semblable lors d’une exposition in utero chez le rat (Fisher et coll., 2003
). Deux études décrivent un effet semblable lors d’une exposition in utero chez le rat (Fisher et coll., 2003 ; Ferrara et coll., 2006
; Ferrara et coll., 2006 ). Cette atteinte des cellules germinales pendant la vie fœtale pourrait expliquer les altérations de la fertilité mâle décrite chez le rat adulte après une exposition in utero (Mahood et coll., 2006
). Cette atteinte des cellules germinales pendant la vie fœtale pourrait expliquer les altérations de la fertilité mâle décrite chez le rat adulte après une exposition in utero (Mahood et coll., 2006 ; Ferrara et coll., 2006
; Ferrara et coll., 2006 ).
).Il semble qu’il existe une fenêtre critique d’exposition au cours du développement testiculaire puisque chez les rongeurs les effets sur la fertilité semblent moins prononcés après une exposition postnatale in vivo mais il existe des données contradictoires sur ce point. Sur culture d’organe, les cellules germinales du testicule fœtal de souris présentent une plus forte sensibilité au stade jeune (Lehraiki et coll., 2009 ). Ces stades correspondent aux stades auxquels un effet a été rapporté sur les cellules germinales humaines. Cependant, une étude sur culture d’organe de rat ne montre pas d’effet sur la lignée germinale durant la vie fœtale mais exclusivement en période postnatale (Li et Kim, 2003
). Ces stades correspondent aux stades auxquels un effet a été rapporté sur les cellules germinales humaines. Cependant, une étude sur culture d’organe de rat ne montre pas d’effet sur la lignée germinale durant la vie fœtale mais exclusivement en période postnatale (Li et Kim, 2003 ). Il est à noter que dans ce travail seule la densité et non le nombre total de gonocyte a été mesuré.
). Il est à noter que dans ce travail seule la densité et non le nombre total de gonocyte a été mesuré.
 ). Ces stades correspondent aux stades auxquels un effet a été rapporté sur les cellules germinales humaines. Cependant, une étude sur culture d’organe de rat ne montre pas d’effet sur la lignée germinale durant la vie fœtale mais exclusivement en période postnatale (Li et Kim, 2003
). Ces stades correspondent aux stades auxquels un effet a été rapporté sur les cellules germinales humaines. Cependant, une étude sur culture d’organe de rat ne montre pas d’effet sur la lignée germinale durant la vie fœtale mais exclusivement en période postnatale (Li et Kim, 2003 ). Il est à noter que dans ce travail seule la densité et non le nombre total de gonocyte a été mesuré.
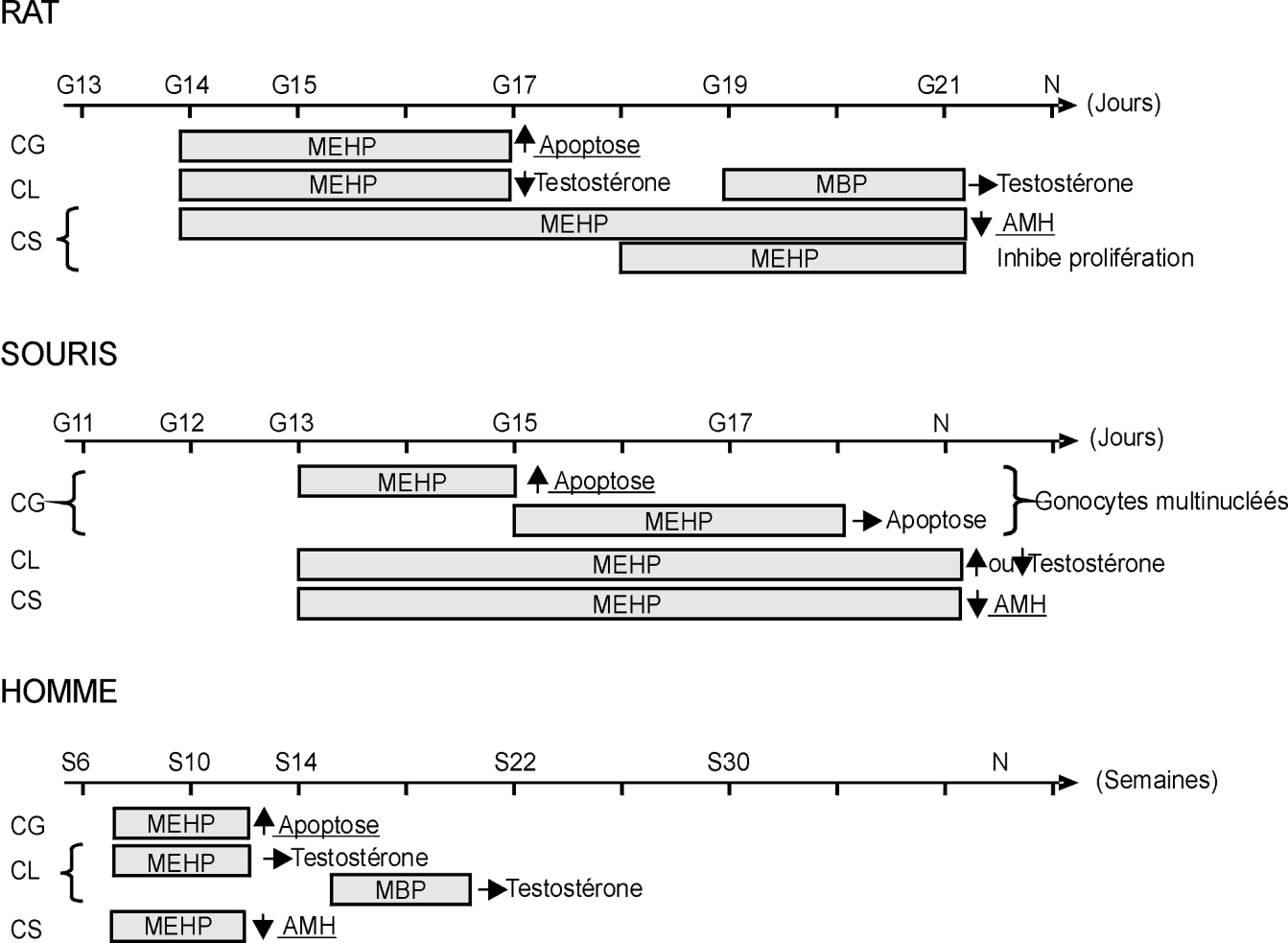
). Il est à noter que dans ce travail seule la densité et non le nombre total de gonocyte a été mesuré.La figure 37.1 résume les principaux effets des phtalates sur le testicule fœtal chez le rat, la souris et l’homme. L’effet des phtalates en culture organotypique est extrêmement variable sur la production de testostérone et ne permet pas encore de conclure à une atteinte testiculaire directe dans le testicule fœtal humain en dépit des nombreuses altérations leydigiennes rapportées chez les rongeurs.
résume les principaux effets des phtalates sur le testicule fœtal chez le rat, la souris et l’homme. L’effet des phtalates en culture organotypique est extrêmement variable sur la production de testostérone et ne permet pas encore de conclure à une atteinte testiculaire directe dans le testicule fœtal humain en dépit des nombreuses altérations leydigiennes rapportées chez les rongeurs.
 résume les principaux effets des phtalates sur le testicule fœtal chez le rat, la souris et l’homme. L’effet des phtalates en culture organotypique est extrêmement variable sur la production de testostérone et ne permet pas encore de conclure à une atteinte testiculaire directe dans le testicule fœtal humain en dépit des nombreuses altérations leydigiennes rapportées chez les rongeurs.
résume les principaux effets des phtalates sur le testicule fœtal chez le rat, la souris et l’homme. L’effet des phtalates en culture organotypique est extrêmement variable sur la production de testostérone et ne permet pas encore de conclure à une atteinte testiculaire directe dans le testicule fœtal humain en dépit des nombreuses altérations leydigiennes rapportées chez les rongeurs. | Figure 37.1 Schéma récapitulatif des principaux effets des phtalates sur culture de testicule fœtal d’après les études analysées |
Modèles cellulaires en relation avec les fonctions reproductrices mâles
Après exposition à de faibles doses de MBzP (100 et 1 000 nM/l), des cellules de Leydig tumorales murines (MCTL-1) ont une activité stéroïdogénique accrue. Ceci est corrélé avec une augmentation du niveau d’expression transcriptionnelle et protéique du gène StAR (steroidogenic acute regulatory protein) (Wang et coll., 2006 ). Cette observation va à l’encontre du rôle anti-stéroïdogénique des phtalates à forte dose reporté par ce même groupe et d’autres, et supporte l’existence d’une réponse dose-dépendante en U inversé.
). Cette observation va à l’encontre du rôle anti-stéroïdogénique des phtalates à forte dose reporté par ce même groupe et d’autres, et supporte l’existence d’une réponse dose-dépendante en U inversé.
 ). Cette observation va à l’encontre du rôle anti-stéroïdogénique des phtalates à forte dose reporté par ce même groupe et d’autres, et supporte l’existence d’une réponse dose-dépendante en U inversé.
). Cette observation va à l’encontre du rôle anti-stéroïdogénique des phtalates à forte dose reporté par ce même groupe et d’autres, et supporte l’existence d’une réponse dose-dépendante en U inversé.Modèles cellulaires d’études des effets sur l’ovaire, ovocytes et glande mammaire
Chez la femelle, les données obtenues suite aux expositions in vivo indiquent que l’ovaire est un organe cible de l’action des phtalates. Le DEHP et son métabolite, le MEHP, ont principalement été testés. Leur principal effet est une altération de la production et du métabolisme de l’œstradiol par les cellules de granulosa.
Cellules dérivées de l’ovaire
Différents modèles cellulaires ont été développés pour étudier les effets des phtalates sur l’ovaire :
• des cultures de follicules entiers, certainement plus proches de la physiologie d’un ovaire sain car le follicule est un système complexe contenant différents types cellulaires, tous en interaction les uns avec les autres (ovocytes, cellules de granulosa, et cellules de la thèque) ;
• des cultures primaires de cellules de granulosa fraîchement isolées de follicules mais qui ont le désavantage d’être coupées des interactions cellulaires et hormonales qui existent dans le follicule natif ;
• des lignées issues de cellules tumorales souvent bien éloignées des cellules natives dont elles sont issues et qui ont des caractéristiques parfois différentes de celles-ci.
Follicules entiers
Chez la souris (CD-1), des follicules à antrum ont été isolés à partir d’ovaires de femelles âgées de 32-35 jours puis mis en culture en présence de DEHP (1, 10 et 100 μg/ml) et MEHP (0,1, 1 et 10 μg/ml). La croissance des follicules a été mesurée toutes les 24 h et l’œstradiol dosé dans les milieux de culture. Le DEHP et le MEHP inhibent la croissance des follicules et diminuent la production d’œstradiol aux deux doses les plus fortes. Ces deux molécules diminuent également le niveau d’ARNm du gène de l’aromatase et de deux facteurs contrôlant le cycle cellulaire (Ccnd2 et Cdk4) (Gupta et coll., 2010 ). L’addition d’œstradiol dans le milieu de culture prévient l’inhibition de croissance induite par le DEHP et le MEHP ainsi que la réduction des niveaux d’œstradiol et la diminution de l’expression des régulateurs du cycle cellulaire. Ainsi, le DEHP et le MEHP peuvent directement inhiber la croissance des follicules préovulatoires (à antrum). Cependant, il a été montré une différence de sensibilité des follicules au DEHP par rapport au MEHP, et proposé que l’aromatase (enzyme qui convertit la testostérone en œstradiol) soit une cible directe du DEHP. Les deux molécules pourraient agir à travers des voies différentes (Gupta et coll., 2010
). L’addition d’œstradiol dans le milieu de culture prévient l’inhibition de croissance induite par le DEHP et le MEHP ainsi que la réduction des niveaux d’œstradiol et la diminution de l’expression des régulateurs du cycle cellulaire. Ainsi, le DEHP et le MEHP peuvent directement inhiber la croissance des follicules préovulatoires (à antrum). Cependant, il a été montré une différence de sensibilité des follicules au DEHP par rapport au MEHP, et proposé que l’aromatase (enzyme qui convertit la testostérone en œstradiol) soit une cible directe du DEHP. Les deux molécules pourraient agir à travers des voies différentes (Gupta et coll., 2010 ).
).
 ). L’addition d’œstradiol dans le milieu de culture prévient l’inhibition de croissance induite par le DEHP et le MEHP ainsi que la réduction des niveaux d’œstradiol et la diminution de l’expression des régulateurs du cycle cellulaire. Ainsi, le DEHP et le MEHP peuvent directement inhiber la croissance des follicules préovulatoires (à antrum). Cependant, il a été montré une différence de sensibilité des follicules au DEHP par rapport au MEHP, et proposé que l’aromatase (enzyme qui convertit la testostérone en œstradiol) soit une cible directe du DEHP. Les deux molécules pourraient agir à travers des voies différentes (Gupta et coll., 2010
). L’addition d’œstradiol dans le milieu de culture prévient l’inhibition de croissance induite par le DEHP et le MEHP ainsi que la réduction des niveaux d’œstradiol et la diminution de l’expression des régulateurs du cycle cellulaire. Ainsi, le DEHP et le MEHP peuvent directement inhiber la croissance des follicules préovulatoires (à antrum). Cependant, il a été montré une différence de sensibilité des follicules au DEHP par rapport au MEHP, et proposé que l’aromatase (enzyme qui convertit la testostérone en œstradiol) soit une cible directe du DEHP. Les deux molécules pourraient agir à travers des voies différentes (Gupta et coll., 2010 ).
).Chez la souris (C57BL/6jxCBA/Ca), un modèle de culture in vitro de follicules préantraux a été développé pour tester les effets du MEHP (10 ; 20 ; 50 ; 100 ; 200 μM) (Lenie et Smitz, 2009 ). Il est à noter que les follicules sont prélevés à des stades plus jeunes et maintenus en culture plus longtemps que dans l’expérience précédente. Il est rapporté une légère augmentation des niveaux de testostérone produits par les follicules traités au MEHP consistant avec une accumulation du substrat (testostérone) due à une diminution de l’aromatisation en œstrogènes ; cela est confirmé par une diminution du ratio E2/T dès la dose de 50 μM de MEHP. Il est également montré une production prématurée de progestérone et une capacité réduite à produire des œstrogènes ainsi qu’une augmentation du métabolisme de l’œstradiol (Lenie et Smitz, 2009
). Il est à noter que les follicules sont prélevés à des stades plus jeunes et maintenus en culture plus longtemps que dans l’expérience précédente. Il est rapporté une légère augmentation des niveaux de testostérone produits par les follicules traités au MEHP consistant avec une accumulation du substrat (testostérone) due à une diminution de l’aromatisation en œstrogènes ; cela est confirmé par une diminution du ratio E2/T dès la dose de 50 μM de MEHP. Il est également montré une production prématurée de progestérone et une capacité réduite à produire des œstrogènes ainsi qu’une augmentation du métabolisme de l’œstradiol (Lenie et Smitz, 2009 ). Ces observations conduisent à l’hypothèse selon laquelle le MEHP pourrait perturber le déroulement de la différenciation du follicule préantral causant ainsi une lutéinisation prématurée de celui-ci.
). Ces observations conduisent à l’hypothèse selon laquelle le MEHP pourrait perturber le déroulement de la différenciation du follicule préantral causant ainsi une lutéinisation prématurée de celui-ci.
 ). Il est à noter que les follicules sont prélevés à des stades plus jeunes et maintenus en culture plus longtemps que dans l’expérience précédente. Il est rapporté une légère augmentation des niveaux de testostérone produits par les follicules traités au MEHP consistant avec une accumulation du substrat (testostérone) due à une diminution de l’aromatisation en œstrogènes ; cela est confirmé par une diminution du ratio E2/T dès la dose de 50 μM de MEHP. Il est également montré une production prématurée de progestérone et une capacité réduite à produire des œstrogènes ainsi qu’une augmentation du métabolisme de l’œstradiol (Lenie et Smitz, 2009
). Il est à noter que les follicules sont prélevés à des stades plus jeunes et maintenus en culture plus longtemps que dans l’expérience précédente. Il est rapporté une légère augmentation des niveaux de testostérone produits par les follicules traités au MEHP consistant avec une accumulation du substrat (testostérone) due à une diminution de l’aromatisation en œstrogènes ; cela est confirmé par une diminution du ratio E2/T dès la dose de 50 μM de MEHP. Il est également montré une production prématurée de progestérone et une capacité réduite à produire des œstrogènes ainsi qu’une augmentation du métabolisme de l’œstradiol (Lenie et Smitz, 2009 ). Ces observations conduisent à l’hypothèse selon laquelle le MEHP pourrait perturber le déroulement de la différenciation du follicule préantral causant ainsi une lutéinisation prématurée de celui-ci.
). Ces observations conduisent à l’hypothèse selon laquelle le MEHP pourrait perturber le déroulement de la différenciation du follicule préantral causant ainsi une lutéinisation prématurée de celui-ci.Cellules de granulosa
En 2001 puis 2003, une équipe américaine a développé un modèle de culture primaire de cellules de granulosa de rat (Fisher 344) afin d’étudier les effets du MEHP (50 μM) (Lovekamp-Swan et coll., 2003 ). Les auteurs ont montré que le MEHP diminuait la production d’œstradiol et l’activité de l’enzyme aromatase, et que ces effets sont similaires à ceux obtenus en traitant les cellules avec un activateur de peroxisome proliferator-activated receptor (PPAR) alpha. Ils ont également montré que le MEHP pouvait agir via les deux récepteurs PPAR (α et γ) présents dans ces cellules pour réguler des gènes clefs de la différenciation des cellules de la granulosa (aromatase notamment) (Lovekamp-Swan et coll., 2003
). Les auteurs ont montré que le MEHP diminuait la production d’œstradiol et l’activité de l’enzyme aromatase, et que ces effets sont similaires à ceux obtenus en traitant les cellules avec un activateur de peroxisome proliferator-activated receptor (PPAR) alpha. Ils ont également montré que le MEHP pouvait agir via les deux récepteurs PPAR (α et γ) présents dans ces cellules pour réguler des gènes clefs de la différenciation des cellules de la granulosa (aromatase notamment) (Lovekamp-Swan et coll., 2003 ).
).
 ). Les auteurs ont montré que le MEHP diminuait la production d’œstradiol et l’activité de l’enzyme aromatase, et que ces effets sont similaires à ceux obtenus en traitant les cellules avec un activateur de peroxisome proliferator-activated receptor (PPAR) alpha. Ils ont également montré que le MEHP pouvait agir via les deux récepteurs PPAR (α et γ) présents dans ces cellules pour réguler des gènes clefs de la différenciation des cellules de la granulosa (aromatase notamment) (Lovekamp-Swan et coll., 2003
). Les auteurs ont montré que le MEHP diminuait la production d’œstradiol et l’activité de l’enzyme aromatase, et que ces effets sont similaires à ceux obtenus en traitant les cellules avec un activateur de peroxisome proliferator-activated receptor (PPAR) alpha. Ils ont également montré que le MEHP pouvait agir via les deux récepteurs PPAR (α et γ) présents dans ces cellules pour réguler des gènes clefs de la différenciation des cellules de la granulosa (aromatase notamment) (Lovekamp-Swan et coll., 2003 ).
).Dans les cellules de granulosa isolées de rat, le traitement par le MEHP conduit à l’activation des voies de signalisation contrôlées par des récepteurs PPAR α et γ. Les isoformes du récepteur entraînent la suppression de l’aromatase et l’induction de fatty acid binding protein (FABP). L’activation de PPARα et PPARγ altère la production et le métabolisme des stéroïdes entraînant une différenciation anormale des cellules de granulosa in vitro.
Afin d’élucider les mécanismes par lesquels le MEHP régule négativement la transcription de l’aromatase (CYP19), des cellules KGN dérivées d’une lignée humaine tumorale de cellules de granulosa ont été utilisées. À toutes les doses de MEHP testées en culture (1, 10, 100 et 300 μM), l’activité enzymatique et la transcription du gène codant l’aromatase sont diminuées. Il a été également montré dans cette étude que le MEHP induit l’expression de GIOT-1 (Gonadotrophin-inducible ovarian transcription factor-1), un répresseur transcriptionnel présent à la fois dans les cellules de la thèque interne et de la granulosa de l’ovaire. Le modèle proposé est le suivant : le MEHP inhibe l’expression du gène de l’aromatase dans les cellules KGN en induisant l’expression du répresseur GIOT-1 lui-même induit par NR4As (Ohno et coll., 2009 ). Cette réduction significative de l’expression du récepteur aux œstrogènes, observée avec le MEHP, n’est pas retrouvée avec le DEHP, DBP ou MBP (Ohno et coll., 2009
). Cette réduction significative de l’expression du récepteur aux œstrogènes, observée avec le MEHP, n’est pas retrouvée avec le DEHP, DBP ou MBP (Ohno et coll., 2009 ).
).
 ). Cette réduction significative de l’expression du récepteur aux œstrogènes, observée avec le MEHP, n’est pas retrouvée avec le DEHP, DBP ou MBP (Ohno et coll., 2009
). Cette réduction significative de l’expression du récepteur aux œstrogènes, observée avec le MEHP, n’est pas retrouvée avec le DEHP, DBP ou MBP (Ohno et coll., 2009 ).
).Des cellules KK-1 dérivées d’une lignée humaine tumorale de granulosa ont également été utilisées pour tester l’effet du MEHP (25-100 μM) sur la stéroïdogenèse basale et induite par hCG (human chorionic gonadotrophin) (Gunnarsson et coll., 2008 ). Le MEHP à 100 μM induit une augmentation de la synthèse basale des stéroïdes en augmentant le taux de cholestérol disponible pour la stéroïdogenèse. Les auteurs formulent l’hypothèse que le MEHP stimulerait la stéroïdogenèse basale en activant des facteurs de transcription induits par la famille des récepteurs PPAR. L’activation de PPAR induirait alors l’expression de gènes impliqués dans le métabolisme du cholestérol, augmentant ainsi le substrat pour la synthèse des stéroïdes. Cet effet stimulateur aurait lieu avant la formation de la prégnènolone (Gunnarsson et coll., 2008
). Le MEHP à 100 μM induit une augmentation de la synthèse basale des stéroïdes en augmentant le taux de cholestérol disponible pour la stéroïdogenèse. Les auteurs formulent l’hypothèse que le MEHP stimulerait la stéroïdogenèse basale en activant des facteurs de transcription induits par la famille des récepteurs PPAR. L’activation de PPAR induirait alors l’expression de gènes impliqués dans le métabolisme du cholestérol, augmentant ainsi le substrat pour la synthèse des stéroïdes. Cet effet stimulateur aurait lieu avant la formation de la prégnènolone (Gunnarsson et coll., 2008 ).
).
 ). Le MEHP à 100 μM induit une augmentation de la synthèse basale des stéroïdes en augmentant le taux de cholestérol disponible pour la stéroïdogenèse. Les auteurs formulent l’hypothèse que le MEHP stimulerait la stéroïdogenèse basale en activant des facteurs de transcription induits par la famille des récepteurs PPAR. L’activation de PPAR induirait alors l’expression de gènes impliqués dans le métabolisme du cholestérol, augmentant ainsi le substrat pour la synthèse des stéroïdes. Cet effet stimulateur aurait lieu avant la formation de la prégnènolone (Gunnarsson et coll., 2008
). Le MEHP à 100 μM induit une augmentation de la synthèse basale des stéroïdes en augmentant le taux de cholestérol disponible pour la stéroïdogenèse. Les auteurs formulent l’hypothèse que le MEHP stimulerait la stéroïdogenèse basale en activant des facteurs de transcription induits par la famille des récepteurs PPAR. L’activation de PPAR induirait alors l’expression de gènes impliqués dans le métabolisme du cholestérol, augmentant ainsi le substrat pour la synthèse des stéroïdes. Cet effet stimulateur aurait lieu avant la formation de la prégnènolone (Gunnarsson et coll., 2008 ).
).Une autre étude faisant appel à des cellules de granulosa humaines saines récupérées à partir de follicules lors de procédure de fécondation in vitro, a montré l’effet inhibiteur du MEHP (0-500 μM) sur l’activité et le niveau d’ARNm de l’aromatase. Aucun effet n’est observé sur la production de progestérone (Reinsberg et coll., 2009 ).
).
 ).
).Chez le rat, sur des cultures primaires de cellules de granulosa, le MEHP (100 μM) réduit l’accumulation d’AMPc de 40 % lors de stimulation par la FSH de ces cellules. De plus, la production de progestérone est inhibée de manière dose-dépendante par le MEHP (Treinen et coll., 1990 ).
).
 ).
).Plus récemment, un système de cultures de cellules de granulosa ex vivo a été développé pour étudier les effets du DEHP sur la stéroïdogenèse de ces cellules (Svechnikova et coll., 2007 ). Des rates femelles sont exposées par gavage oral à 500 mg/kg/j de DEHP pendant 10 jours. Les dosages sériques réalisés sur ces animaux révèlent une diminution de deux à cinq fois des niveaux de progestérone et de d’œstradiol, respectivement. Puis des cultures primaires de cellules de granulosa issues des ovaires de ces animaux sont analysées : elles produisent moins (-30 %) de progestérone en réponse à une stimulation par la LH et la FSH. Ainsi, ces cellules de granulosa traitées in vivo ont une capacité moindre de réponse aux hormones gonadotropes. De plus, il a été montré que le transport du cholestérol dans la mitochondrie est altéré dans les cellules traitées en comparaison avec les témoins.
). Des rates femelles sont exposées par gavage oral à 500 mg/kg/j de DEHP pendant 10 jours. Les dosages sériques réalisés sur ces animaux révèlent une diminution de deux à cinq fois des niveaux de progestérone et de d’œstradiol, respectivement. Puis des cultures primaires de cellules de granulosa issues des ovaires de ces animaux sont analysées : elles produisent moins (-30 %) de progestérone en réponse à une stimulation par la LH et la FSH. Ainsi, ces cellules de granulosa traitées in vivo ont une capacité moindre de réponse aux hormones gonadotropes. De plus, il a été montré que le transport du cholestérol dans la mitochondrie est altéré dans les cellules traitées en comparaison avec les témoins.
 ). Des rates femelles sont exposées par gavage oral à 500 mg/kg/j de DEHP pendant 10 jours. Les dosages sériques réalisés sur ces animaux révèlent une diminution de deux à cinq fois des niveaux de progestérone et de d’œstradiol, respectivement. Puis des cultures primaires de cellules de granulosa issues des ovaires de ces animaux sont analysées : elles produisent moins (-30 %) de progestérone en réponse à une stimulation par la LH et la FSH. Ainsi, ces cellules de granulosa traitées in vivo ont une capacité moindre de réponse aux hormones gonadotropes. De plus, il a été montré que le transport du cholestérol dans la mitochondrie est altéré dans les cellules traitées en comparaison avec les témoins.
). Des rates femelles sont exposées par gavage oral à 500 mg/kg/j de DEHP pendant 10 jours. Les dosages sériques réalisés sur ces animaux révèlent une diminution de deux à cinq fois des niveaux de progestérone et de d’œstradiol, respectivement. Puis des cultures primaires de cellules de granulosa issues des ovaires de ces animaux sont analysées : elles produisent moins (-30 %) de progestérone en réponse à une stimulation par la LH et la FSH. Ainsi, ces cellules de granulosa traitées in vivo ont une capacité moindre de réponse aux hormones gonadotropes. De plus, il a été montré que le transport du cholestérol dans la mitochondrie est altéré dans les cellules traitées en comparaison avec les témoins.Chez les ruminants, une étude a été menée chez la vache faisant appel à des cultures primaires de cellules de granulosa récupérées sur des ovaires d’abattoir. Les cultures ont été traitées soit avec du DEHP soit du MEHP (0,1, 1 et 10 ng/ml). Les deux molécules stimulent la sécrétion d’ocytocine par les cellules de granulosa, avec un effet plus important du MEHP que du DEHP. De plus, la sécrétion d’ocytocine est stimulée plus efficacement par les faibles doses de MEHP. La perturbation de la sécrétion d’ocytocine peut avoir un effet négatif sur le déroulement du cycle œstrien (Wang et coll., 2010).
Ovocytes
Une seule étude a testé l’effet direct du MEHP sur la maturation in vitro de l’ovocyte et le début du développement embryonnaire chez la souris. Des ovocytes dénudés de leurs cellules de granulosa ont été cultivés en présence de 50, 100, 200, et 400 μM de MEHP pendant 24 h, puis les ovocytes ont été fécondés et les embryons cultivés pendant 4 jours. La proportion d’ovocytes qui progressent jusqu’au stade métaphase II est significativement diminuée, de manière dose dépendante. Le nombre d’embryons ayant atteint le stade 2 cellules, 24 h après fécondation, est de 28 % à 400 μM de MEHP contre 49 % pour les témoins cultivés sans MEHP. Aucun des embryons traités avec du MEHP quelle que soit la dose n’atteint le stade 8 cellules (Dalman et coll., 2008 ).
).
 ).
).Utérus
Au vu des effets observés in vitro sur la production d’œstradiol, on pouvait s’attendre à des effets sur l’utérus, un organe sensible aux œstrogènes. Cependant, peu d’études ont recherché des effets sur l’utérus in vitro.
Chez les bovins, il a été développé des cultures primaires de cellules endométriales. Celles-ci ont été traitées avec différentes doses de DEHP et MEHP (0,1, 1 et 10 ng/ml). Il en ressort que les deux molécules stimulent la sécrétion de la prostaglandine PGF2 alpha et inhibent la sécrétion de la prostaglandine PGE2 dans ces cellules. Le ratio PGF2/PGE2 est altéré, il passe de 1/1 chez les témoins, à 1/4-1/10 chez les traités. Ce ratio est très important dans l’établissement de la gestation, son altération pouvant entraîner une augmentation des contractions et une accélération de la régression du corps jaune (Wang et coll., 2010).
Chez l’Homme, des cultures primaires de cellules endométriales récupérées lors d’hystérectomie ont été cultivées avec du DBP aux doses de 0, 1, 50 et 100 μM. À toutes les doses, le traitement avec le DBP entraîne une diminution de la prolifération des cellules endométriales endothéliales (Bredhult et coll., 2007 ).
).
 ).
).Glande mammaire
Plusieurs phtalates (DEHP, BBP, MBP, DINP et DIDP) ont été testés sur des lignées cellulaires dérivées de tumeurs de glandes mammaires, dont les cellules MELN et MCF-7 exprimant le récepteur alpha aux œstrogènes. L’objet de l’étude était d’évaluer la capacité de ces phtalates à induire l’expression de VEGF, un facteur de croissance impliqué dans la néo-vascularisation et la progression des tumeurs mammaires, qui est régulé par les œstrogènes. Il a été montré que le BBP et le DEHP (10-5-10-7M) régulent positivement l’expression de VEGF dans les cellules MELN via un mécanisme dépendant du récepteur alpha des œstrogènes. Le BBP se révèle le composé le plus actif (Buteau-Lozano et coll., 2008 ).
).
 ).
).Une étude menée également sur des cellules tumorales mammaires humaines (MCF-7) rapporte une augmentation de l’expression du récepteur aux œstrogènes ERα après culture en présence de 10 μM de BBP et du récepteur ERβ en présence de la même dose de BBP ou de DEHP (Kang et coll., 2005 ). Le DBP ne semble pas avoir d’effet sur le niveau d’expression des ER. Cependant, une baisse de méthylation est retrouvée au niveau du promoteur du gène ERα après culture avec n’importe quelle famille de phtalates. Il est à souligner que les résultats présentés dans cet article sont de faible qualité et qu’il n’existe pas de méthodes de quantification précise.
). Le DBP ne semble pas avoir d’effet sur le niveau d’expression des ER. Cependant, une baisse de méthylation est retrouvée au niveau du promoteur du gène ERα après culture avec n’importe quelle famille de phtalates. Il est à souligner que les résultats présentés dans cet article sont de faible qualité et qu’il n’existe pas de méthodes de quantification précise.
 ). Le DBP ne semble pas avoir d’effet sur le niveau d’expression des ER. Cependant, une baisse de méthylation est retrouvée au niveau du promoteur du gène ERα après culture avec n’importe quelle famille de phtalates. Il est à souligner que les résultats présentés dans cet article sont de faible qualité et qu’il n’existe pas de méthodes de quantification précise.
). Le DBP ne semble pas avoir d’effet sur le niveau d’expression des ER. Cependant, une baisse de méthylation est retrouvée au niveau du promoteur du gène ERα après culture avec n’importe quelle famille de phtalates. Il est à souligner que les résultats présentés dans cet article sont de faible qualité et qu’il n’existe pas de méthodes de quantification précise.Une étude a été réalisée comparant l’activité œstrogénique de plusieurs phtalates (BBP, DCHP, DEHP, DBP) dans des modèles in vitro et in vivo (rat Sprague-Dawley, 600 mg/kg/j du jour 14 à 16 postnatal, observation au jour 17) en mesurant l’expression d’un gène cible des œstrogènes, la Calbindine-D9k. Les cellules utilisées sont des cellules MCF-7 issues d’une lignée cellulaire humaine de cancer du sein. Il apparaît qu’aucun des phtalates utilisés n’induit l’expression de l’ARN ou de la protéine Calbindine-D9k dans l’utérus des animaux traités. En revanche, ces phtalates sont capables d’induire la prolifération des cellules MCF-7 en culture (effet œstrogénique). Il est intéressant de noter que selon le test utilisé pour mettre en évidence un effet œstrogénique d’une molécule, on peut obtenir des résultats contradictoires (Hong et coll., 2005 ).
).
 ).
).Enfin, une autre étude menée sur des cellules MCF-7 montre que la culture en présence de 1, 10 et 100 μM de DEHP perturbe l’expression d’un large spectre de gènes impliqués dans le développement du système nerveux central (Hokanson et coll., 2006 ). La signification biologique de ce résultat reste incertaine.
). La signification biologique de ce résultat reste incertaine.
 ). La signification biologique de ce résultat reste incertaine.
). La signification biologique de ce résultat reste incertaine.
En conclusion, l’effet des phtalates en culture organotypique est extrêmement variable sur la production de testostérone et ne permet pas encore de conclure à une atteinte testiculaire directe dans le testicule fœtal humain. Des effets néfastes des phtalates sur les cellules germinales et les cellules de Sertoli apparaissent en revanche clairement et de manière cohérente mais le mécanisme d’action des phtalates sur ces types cellulaires est encore à identifier et nécessitera des études complémentaires. Il semble donc qu’il n’existe pas de lien causal entre une éventuelle baisse de la production de testostérone induite par les phtalates et la chute du nombre de cellules germinales.
Les études in vitro montrent clairement une diminution de la production d’œstradiol par les cellules folliculaires ovariennes suite à l’exposition au DEHP et son principal métabolite le MEHP. Cependant, il a été montré une différence de sensibilité des follicules au DEHP versus au MEHP, et proposé que l’aromatase (enzyme qui convertit la testostérone en œstradiol) soit une cible directe du DEHP. Les deux molécules pourraient agir à travers des voies différentes. D’après ces études, l’action du DEHP et du MEHP s’effectuerait via les récepteurs PPAR. Des mécanismes d’action ont été proposés pour le MEHP mais doivent être vérifiés in vivo et dans d’autres espèces que chez les rongeurs afin d’être validés.
D’autres organes que l’ovaire apparaissent également des cibles potentielles des phtalates, comme l’hypophyse ou l’hypothalamus au niveau cérébral ou encore l’utérus et la glande mammaire comme en témoignent quelques études in vitro. Il semblerait que l’action sur ces organes se fasse via les récepteurs aux œstrogènes. Cependant, l’action via PPAR n’a pas été étudiée sur d’autres organes que l’ovaire.
Bibliographie
[1] BORCH J, METZDORFF SB, VINGGAARD AM, BROKKEN L, DALGAARD M. Mechanisms underlying the anti-androgenic effects of diethylhexyl phthalate in fetal rat testis.
Toxicology. 2006;
223:144- 155

[2] BREDHULT C, BACKLIN BM, OLOVSSON M. Effects of some endocrine disruptors on the proliferation and viability of human endometrial endothelial cells in vitro.
Reprod Toxicol. 2007;
23:550- 559

[3] BUTEAU-LOZANO H, VELASCO G, CRISTOFARI M, BALAGUER P, PERROT-APPLANAT M. Xenœogens modulate vascular endothelial growth factor secretion in breast cancer cells through an estrogen receptor-dependent mechanism.
J Endocrinol. 2008;
196:399- 412

[4] CHAUVIGNE F, MENUET A, LESNE L, CHAGNON MC, CHEVRIER C, et coll. Time- and dose-related effects of di-(2-ethylhexyl) phthalate and its main metabolites on the function of the rat fetal testis in vitro.
Environ Health Perspect. 2009;
117:515- 521

[5] CULTY M, THUILLIER R, LI W, WANG Y, MARTINEZ-ARGUELLES DB, et coll. In utero exposure to di-(2-ethylhexyl) phthalate exerts both short-term and long-lasting suppressive effects on testosterone production in the rat.
Biol Reprod. 2008;
78:1018- 1028

[6] DALMAN A, EIMANI H, SEPEHRI H, ASHTIANI SK, VALOJERDI MR, et coll. Effect of mono-(2-ethylhexyl) phthalate (MEHP) on resumption of meiosis, in vitro maturation and embryo development of immature mouse oocytes.
Biofactors. 2008;
33:149- 155

[7] FERRARA D, HALLMARK N, SCOTT H, BROWN R, MCKINNELL C, et coll. Acute and long-term effects of in utero exposure of rats to di(n-butyl) phthalate on testicular germ cell development and proliferation.
Endocrinology. 2006;
147:5352- 5362

[8] FISHER JS, MACPHERSON S, MARCHETTI N, SHARPE RM. Human ‘testicular dysgenesis syndrome’: a possible model using in-utero exposure of the rat to dibutyl phthalate.
Hum Reprod. 2003;
18:1383- 1394

[9] GAIDO KW, HENSLEY JB, LIU D, WALLACE DG, BORGHOFF S, et coll. Fetal mouse phthalate exposure shows that Gonocyte multinucleation is not associated with decreased testicular testosterone.
Toxicol Sci. 2007;
97:491- 503

[10] GUNNARSSON D, LEFFLER P, EKWURTZEL E, MARTINSSON G, LIU K, SELSTAM G. Mono-(2-ethylhexyl) phthalate stimulates basal steroidogenesis by a cAMP-independent mechanism in mouse gonadal cells of both sexes.
Reproduction. 2008;
135:693- 703

[11] GUPTA RK, SINGH JM, LESLIE TC, MEACHUM S, FLAWS JA, YAO HH. Di-(2-ethylhexyl) phthalate and mono-(2-ethylhexyl) phthalate inhibit growth and reduce estradiol levels of antral follicles in vitro.
Toxicol Appl Pharmacol. 2010;
242:224- 230

[12] HALLMARK N, WALKER M, MCKINNELL C, MAHOOD IK, SCOTT H, et coll. Effects of monobutyl and di(n-butyl) phthalate in vitro on steroidogenesis and Leydig cell aggregation in fetal testis explants from the rat: comparison with effects in vivo in the fetal rat and neonatal marmoset and in vitro in the human.
Environ Health Perspect. 2007;
115:390- 396

[13] HOKANSON R, HANNEMAN W, HENNESSEY M, DONNELLY KC, MCDONALD T, et coll. DEHP, bis(2)-ethylhexyl phthalate, alters gene expression in human cells: possible correlation with initiation of fetal developmental abnormalities.
Hum Exp Toxicol. 2006;
25:687- 695

[14] HONG EJ, JI YK, CHOI KC, MANABE N, JEUNG EB. Conflict of estrogenic activity by various phthalates between in vitro and in vivo models related to the expression of Calbindin-D9k.
J Reprod Dev. 2005;
51:253- 263

[15] HOWDESHELL KL, WILSON VS, FURR J, LAMBRIGHT CR, RIDER CV, et coll. A mixture of five phthalate esters inhibits fetal testicular testosterone production in the sprague-dawley rat in a cumulative, dose-additive manner.
Toxicol Sci. 2008;
105:153- 165

[16] KANG SC, LEE BM. DNA methylation of estrogen receptor alpha gene by phthalates.
J Toxicol Environ Health A. 2005;
68:1995- 2003

[17] LAMBROT R, MUCZYNSKI V, LECUREUIL C, ANGENARD G, COFFIGNY H, et coll. Phthalates impair germ cell development in the human fetal testis in vitro without change in testosterone production.
Environ Health Perspect. 2009;
117:32- 37

[18] LEHRAIKI A, RACINE C, KRUST A, HABERT R, LEVACHER C. Phthalates impair germ cell number in the mouse fetal testis by an androgen- and estrogen-independent mechanism.
Toxicol Sci. 2009;
111:372- 382

[19] LENIE S, SMITZ J. Functional AR signaling is evident in an in vitro mouse follicle culture bioassay that encompasses most stages of folliculogenesis.
Biol Reprod. 2009;
80:685- 95

[20] LI H, KIM KH. Effects of mono-(2-ethylhexyl) phthalate on fetal and neonatal rat testis organ cultures.
Biol Reprod. 2003;
69:1964- 1972

[21] LIN H, GE RS, CHEN GR, HU GX, DONG L, et coll. Involvement of testicular growth factors in fetal Leydig cell aggregation after exposure to phthalate in utero.
Proc Natl Acad Sci. U S A:2008a;
105:72187222

[22] LOVEKAMP-SWAN T, JETTEN AM, DAVIS BJ. Dual activation of PPARalpha and PPARgamma by mono-(2-ethylhexyl) phthalate in rat ovarian granulosa cells.
Mol Cell Endocrinol. 2003;
201:133- 141

[23] MAHOOD IK, HALLMARK N, MCKINNELL C, WALKER M, FISHER JS, et coll. Abnormal Leydig Cell aggregation in the fetal testis of rats exposed to di (n-butyl) phthalate and its possible role in testicular dysgenesis.
Endocrinology. 2005;
146:613- 623

[24] MAHOOD IK, MCKINNELL C, WALKER M, HALLMARK N, SCOTT H, et coll. Cellular origins of testicular dysgenesis in rats exposed in utero to di(n-butyl) phthalate.
Int J Androl. 2006;
29:148- 154

[25] MCKINNELL C, MITCHELL RT, WALKER M, MORRIS K, KELNAR CJ, et coll. Effect of fetal or neonatal exposure to monobutyl phthalate (MBP) on testicular development and function in the marmoset.
Hum Reprod. 2009;
24:2244- 2254

[26] MYLCHREEST E, SAR M, WALLACE DG, FOSTER PM. Fetal testosterone insufficiency and abnormal proliferation of Leydig cells and gonocytes in rats exposed to di(n-butyl) phthalate.
Reprod Toxicol. 2002;
16:19- 28

[27] OHNO S, YUKINAWA F, NODA M, NAKAJIN S. Mono-(2-ethylhexyl) phthalate induces NR4A subfamily and GIOT-1 gene expression, and suppresses CYP19 expression in human granulosa-like tumor cell line KGN.
Toxicol Lett. 2009;
191:353- 359

[28] REINSBERG J, WEGENER-TOPER P, VAN DER VEN K, VAN DER VEN H, KLINGMUELLER D. Effect of mono-(2-ethylhexyl) phthalate on steroid production of human granulosa cells.
Toxicol Appl Pharmacol. 2009;
239:116- 123

[29] ROUILLER-FABRE V, LAMBROT R, MUCZYNSKI V, COFFIGNY H, LECUREUIL C, et coll. Development and regulations of testicular functions in the human foetus.
Gynecol Obstet Fertil. 2008;
36:898- 907

[30] SVECHNIKOVA I, SVECHNIKOV K, SÖDER O. The influence of di-(2-ethylhexyl) phthalate on steroidogenesis by the ovarian granulosa cells of immature female rats.
J Endocrinol. 2007;
194:603- 609

[31] THOMPSON CJ, ROSS SM, GAIDO KW. Di(n-butyl) phthalate impairs cholesterol transport and steroidogenesis in the fetal rat testis through a rapid and reversible mechanism.
Endocrinology. 2004;
145:1227- 1237

[32] TREINEN KA, DODSON WC, HEINDEL JJ. Inhibition of FSH-stimulated cAMP accumulation and progesterone production by mono(2-ethylhexyl) phthalate in rat granulosa cell cultures.
Toxicol Appl Pharmacol. 1990;
106:334- 340

[33] WANG Y, SONG L, HONG X, CUI L, ZHANG Z, et coll. Low concentrations mono-butyl phthalate stimulates steroidogenesis by facilitating steroidogenic acute regulatory protein expression in mouse Leydig tumor cells (MLTC-1).
Chem Biol Interact. 2006;
164:15- 24

[34] WILSON VS, LAMBRIGHT C, FURR J, OSTBY J, WOOD C, et coll. Phthalate ester-induced gubernacular lesions are associated with reduced insl3 gene expression in the fetal rat testis.
Toxicol Lett. 2004;
146:207- 215

→ Aller vers SYNTHESE