Les cellules eucaryotes assurent la transcription des ARN grâce à trois polymérases spécialisées alors que les archéobactéries n’en possèdent qu’une seule. Dans tous les cas, c’est la même protéine, la TATA-boxbinding protein ou TBP, qui permet l’initiation de la transcription. La protéine TBP est extrêmement bien conservée depuis les archéobactéries jusqu’aux eucaryotes supérieurs. Au cours de la phylogenèse, à partir d’un ancêtre des vertébrés tétrapodes, elle a acquis un domaine N-terminal supplémentaire qui participe à l’évolution et au raffinement des complexes de la machinerie transcriptionnelle dans les organismes multicellulaires. L’équipe de E.E. Schmidt a voulu déterminer la fonction de ce domaine N-terminal. En utilisant les techniques de recombinaison homologue chez la souris, 111 des 135 acides aminés de cette région spécifique des vertébrés ont été éliminés, créant des souris tbpΔN qui possèdent ainsi une TBP proche de celle des archéobactéries.
Il est surprenant de constater que cette délétion n’altère ni les étapes précoces du développement, ni l’organogenèse. Pourtant, la survie des embryons est affectée dans les jours qui suivent l’organogenèse. En effet, les résultats indiquent que plus de 97 % des embryons homozygotes pour cette délétion et 30 % des embryons hétérozygotes ne peuvent se développer au-delà de la moitié de la gestation. Un certain nombre d’animaux homozygotes et hétérozygotes pour l’allèle tbpΔN peuvent cependant naître et survivre au-delà du sevrage. Dans ce cas, ils sont sains et fertiles à l’âge adulte.
Aucun défaut cellulaire ou tissulaire n’est observé chez les embryons porteurs de tbpΔN . Dans seulement 25 % des cas, le placenta des embryons homozygotes mutants présente des altérations histologiques: les circulations sanguines foetales et maternelles sont mélangées, et des caillots de sang maternel se forment. De plus, les cellules géantes du trophoblaste montrent une activité de phagocytose excessive par rapport à la normale. Ces données ont conduit les auteurs à postuler que la mort des embryons était due à des défauts du placenta. Pour valider cette hypothèse, ils ont créé des chimères par agrégation dans lesquelles des embryons diploïdes mutants tbpΔN au stade morula sont fusionnés avec des embryons sauvages tétraploïdes de même stade puis réimplantés chez une mère porteuse. Dans les chimères, les cellules tétraploïdes ne participent qu’à la formation des annexes extra-embryonnaires dont le placenta, alors que les embryons ne sont formés que par des cellules diploïdes mutantes. Dans ces cas de chimères, tous les embryons survivent. Il semble donc que la portion Nterminale de la TBP est seulement nécessaire aux étapes précoces du développement du placenta, ou à son bon fonctionnement.
Les auteurs ont ensuite utilisé des souris dont les gènes rag1 ou β2-m ont été inactivés. L’inactivation du gène Rag codant pour la recombinase indispensable au réarrangement du récepteur pour l’antigène des lymphocytes T et B entraîne l’absence de cellules T et B matures fonctionnelles et donc un déficit immunitaire sévère. Les souris β2-m−/− n’ont pas de β2-microglobuline (β2-m), petite protéine qui s’associe à une chaîne α transmembranaire pour former les molécules de classe I du complexe majeur d’histocompatibilité (CMH). Parmi celles-ci, on distingue des molécules très polymorphes (classe Ia) qui présentent une grande variété de peptides aux lymphocytes T, et des molécules peu (ou pas) polymorphes (classe Ib). D’autres molécules homologues dites class I-like ne font pas partie du CMH mais possèdent une structure très proche et sont associées à la β2-m. Toutes ces molécules sont absentes de la surface des cellules des souris β2-m−/− . Tous les embryons tbpΔN/ΔN survivent chez une mère immunodéficiente rag1 −/−. La moitié des embryons [tbpΔN/ΔN, β2-m −/−] est protégée chez une mère immunocompétente.
Ainsi, les avortements caractéristiques des femelles tbpΔN/ΔN ne se produisent que si les lymphocytes maternels expriment normalement le récepteur de l’antigène et sont fonctionnels; ceux-ci reconnaîtraient une molécule du placenta dont l’expression requiert la β2-m, et qui ne s’exprimerait que chez les embryons ayant une mutation de TBP (Figure 1). Cette interaction dépendrait, au moins partiellement, de l’expression de la β2-m chez le fœtus, puisque la moitié des embryons [tbpΔN/ΔN, β2-m −/−] est protégée. La reconnaissance de cette molécule par les lymphocytes T, B ou NKT (natural killer T cells) activerait un rejet maternel.
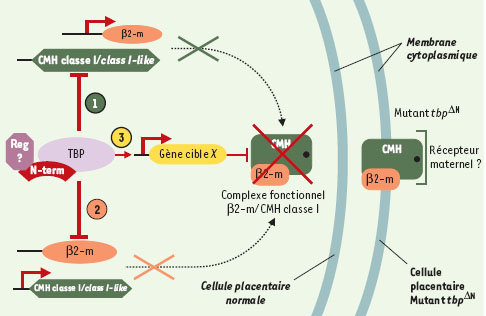
| Figure 1.
Modèles de l’implication de TBP dans la régulation de l’expression des gènes de classe I du CMH ou class I-like. Les trois hypothèses formulées par les auteurs sont résumées sur ce schéma. Chacune dépend d’un élément régulateur associé au complexe de transcription fixé à la TATA box. Selon les deux premières hypothèses, cet élément régulateur agirait comme un répresseur empêchant soit la transcription du gène de la β2-m, soit celle des chaînes lourdes des gènes de classe I du CMH ou class I-like. Dans ces deux cas, le gène non réprimé peut s’exprimer mais ne peut former de complexe fonctionnel à la membrane (modèles 1 et 2). Dans le troisième modèle, le complexe β2-m/CMH peut se former mais un autre gène, réglé positivement par la TBP, peut bloquer l’expression d’une molécule fonctionnelle de CMH (modèle 3). Dans chacune de ces hypothèses, la délétion du domaine N-terminal de la TBP peut permettre l’expression d’un complexe fonctionnel à la surface des cellules du placenta. |
Les cellules NKT, récemment décrites, ont une activité cytolytique spontanée comme les cellules NK mais portent aussi un récepteur pour l’antigène comparable à celui des lymphocytes T. Contrairement aux cellules NK, ces cellules sont absentes chez les souris rag1−/− .
De nombreuses molécules qui s’associent à la β2-m pourraient intervenir dans ce rejet. Les molécules du CMH de classe Ia ne sont pas de bonnes candidates: en effet, ces molécules sont très faiblement exprimées dans l’embryon et sont normalement absentes du placenta de souris [ 3, 4]. À des stades précoces du développement, leur expression forcée par transgenèse est létale pour le foetus, même en l’absence de différences antigéniques entre la mère et le foetus. En outre, leur expression ectopique dans le placenta n’entraîne pas de rejet [ 5, 6]. Parmi les autres molécules class-I like associées à la β2-microglobuline, celles codées par le locus CD1 comprennent au moins 5 isotypes, peu polymorphes, capables de présenter aux lymphocytes T des antigènes de type glycolipidique. Une des molécules CD1 dont l’expression a été détectée dans une lignée tumorale de placenta humain pourrait être responsable du rejet observé chez les embryons mutants, en activant des cellules T ou NKT maternelles.
Cependant, plusieurs points de l’article semblent contredire l’hypothèse d’un rejet immunitaire classique par les lymphocytes T ou B. En effet, on n’observe pas l’infiltration leucocytaire généralement associée à une telle réponse, ces « rejets » se produisent en l’absence de différences antigéniques identifiées entre la mère et le foetus et surtout, il n’y a pas de mémoire immunitaire même après plusieurs gestations. Les auteurs en concluent qu’il est peu vraisemblable que ce phénomène fasse intervenir des mécanismes immunitaires adaptatifs mettant en jeu des cellules T ou B conventionnelles, spécifiques d’antigènes. Une réponse aussi rapide suggère plutôt qu’une molécule class I-like associée à la β2-m serait reconnue par des cellules de type NKT, ce qui expliquerait aussi l’absence de mémoire immunitaire, puisque ces effecteurs produisent une réponse « innée » quasi immédiate mais dépourvue de spécificité et de mémoire. Les auteurs proposent ainsi trois mécanismes hypothétiques de régulation de l’expression des molécules de classe I, ou de l’un de leurs homologues, à la surface des cellules du placenta (Figure 1). Ces données suggèrent que des molécules associées à la β2-m, mais encore non identifiées, jouent un rôle important dans les interactions fœtomaternelles. Elles soulignent aussi l’étonnante complexité du fonctionnement, encore mal connu, du placenta. L’intérêt de ces observations surprenantes réside également dans les nombreuses questions qu’elles suscitent: le caractère stochastique des avortements, qui ne touche pas 100 % des foetus, reste à élucider, de même que la fonction de ce domaine N-terminal de TBP chez les vertébrés sans placenta tels que le poisson-zèbre, le xénope ou l’ornithorhynque.