L’année 2003 marque le 50eanniversaire de la découverte des adénovirus (Ad). Un demi-siècle d’étude intensive des Ad nous a beaucoup appris sur leur biologie,leur structure, l’organisation de leur génome ou les propriétés des différents produits des gènes viraux, et a par ailleurs permis la découverte des mécanismes de réplication de l’ADN et d’épissage des ARN. Dans les années 1980, ces virus ont également permis de démontrer la faisabilité du transfert de gène dans des cellules eucaryotes. Les Ad possèdent en effet des caractéristiques qui font d’eux de bons vecteurs du gène « médicament» pour la thérapie génique : (1)un fort pouvoir infectieux associé à un large spectre de cellules cibles, quiescentes ou en prolifération; (2) une réplication extra-chromosomique de leur génome, qui minimise le risque de mutations insertionnelles ; (3) la possibilité d’y insérer de longs fragments d’ADN exogènes; et (4) la facilité de manipulation et de production à des titres élevés.L’efficacité thérapeutique des essais cliniques utilisant des vecteurs Ad menés jusqu’ici est cependant décevante.L’immunogénicité de ces vecteurs est la première responsable, car, bien que dépourvus d’un groupe de gènes rendant leur réplication défective, la majorité de leur génome viral est toujours présente et son expression aboutit à la production de protéines virales. Les cellules transduites sont donc reconnues et rapidement éliminées par le système immunitaire. La seconde explication de cette faible efficacité est la neutralisation des vecteurs par une immunité humorale développée contre les Ad humains et préexistant dans la quasi-totalité de la population adulte. Les vecteurs dérivés de virus qui ont déjà infecté la majorité de la population ne nous semblent donc pas les plus adaptés aux applications thérapeutiques.La thérapie génique doit donc tirer les leçons de ces échecs en développant des vecteurs plus adaptés à ces contraintes immunologiques.
Une source alternative de vecteurs est constituée par des Ad isolés chez les non-humains (chien, singe, mouton,vache ou poule) qui sont capables d’infecter des cellules humaines sans s’y propager [ 1]. Ces vecteurs conservent théoriquement les avantages des Ad,mais, insensibles à l’immunité préexistante contre les Ad humains, ils permettraient ainsi d’administrer des doses inférieures de vecteur pour une même efficacité in vivo.
Depuis plus de 6 ans, nous nous intéressons à l’adénovirus canin de type 2 (CAV-2). Les vecteurs CAV-2 sont des outils adaptés aux applications cliniques car(1) ils transduisent certaines cellules humaines aussi efficacement que les Ad humains; (2) ils ne se répliquent pas dans les cellules humaines, suggérant un très faible risque de propagation dans l’organisme; (3) une faible ou aucune immunité préexistante n’a été détectée chez les individus testés [ 2]; et (4)contrairement aux vecteurs dérivés d’Ad humains, le risque de recombinaison et/ou de co-réplication avec les Ad sauvages dé jà présents dans l’organisme est quasi nul (pour revue, voir [ 3]). En outre, le génome de CAV-2 ne s’intègre pas non plus à celui de la cellule hôte ce qui a l’avantage de minimiser le risque de transformation, mais entraîne aussi la perte d’expression du transgène dans des cellules en prolifération,une expression à long terme nécessitant donc, soit des ré-administrations du vecteur,soit le ciblage des cellules post-mitotiques. Enfin, si la majorité des Ad utilisent la protéine CAR (coxsackievirus adenovirus receptor) comme récepteur principal et certaines intégrines comme récepteur secondaire (activant des cascades de signalisation qui aboutissent à la production de cytokines pro-inflammatoires[ 4]), CAV-2 a l’avantage: (1)de ne pas posséder le motif responsable de l’interaction avec les intégrines [ 5];et (2) de n’infecter que les cellules exprimant CAR [ 6], ce qui restreint son tropisme et pourrait permettre de cibler une population cellulaire au sein d’un tissu [ 7].
In vivo, les vecteurs CAV-2 transduisent efficacement les cellules épithéliales des voies aériennes, in vivo chez la souris ou in vitro chez l’homme [2], encourageant le développement de vecteurs CAV-2 pour traiter la mucoviscidose, maladie récalcitrante à la thérapie génique.L’injection de vecteurs CAV-2 dans différents tissus a cependant mis en évidence leur tropisme préférentiel pour les neurones[7]. Dans le cerveau, cette transduction préférentielle procure aux vecteurs CAV-2 l’avantage de limiter l’expression du transgène aux neurones,sans transduction des cellules gliales, ce qui élimine la réaction inflammatoire qui survient avec les Ad humains [ 8]. C’est vraisemblablement pour ces raisons que dans nos expériences, un vecteur CAV-2 appelé Spike a pu échapper à la surveillance immunitaire et permettre la plus longue expression jamais observée d’un transgène in vivo, soit plus d’un an après son injection dans le cerveau de rat. Spike fait partie de la dernière génération des vecteurs Ad, appelés helperdependent ou, de manière plus imagée,gutless (littéralement «sans tripes»)[ 9], qui sont dépourvus de tous les gènes viraux et apportent donc une solution au problème d’immunogénicité adaptative.L’absence de production de protéines virales limite en effet l’élimination des cellules transduites, permettant une expression à plus long terme du transgène chez des animaux naïfs, mais immunocompétents. En outre, ces vecteurs possèdent une capacité de clonage(jusqu’à 30 kb) qui permet l’intégration de séquences régulatrices, conférant une expression du gène-médicament plus adaptée à sa fonction thérapeutique.
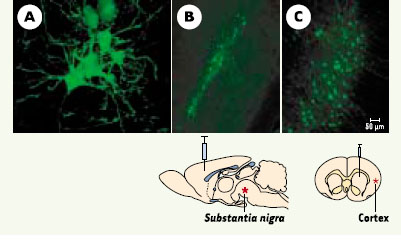
Une autre caractéristique propre à CAV-2 est sa grande efficacité à migrer par transport rétrograde dans les axones. Cette propriété remarquable a été mise en évidence après injection d’un vecteur CAV-2 dans le muscle de la patte arrière de souris: l’expression du transgène (GFP) a pu être détectée dans les motoneurones situés dans la moelle épinière (Figure 1A). Un second exemple significatif est le transport de ce vecteur du site d’injection (dans le striatum du cerveau de rat) jusqu’à des structures éloignées comme la substantia nigra (Figure 1B), le néocortex (Figure 1C), le thalamus et le noyau de Meynert.
| Figure 1.
Transfert de gène in vivo par un vecteur CAV-2 codant pour l’EGFP (enhanced green fluorescent protein). A. Section cubique de 100 μm du rachis dorso-lombaire sacré de souris montrant au moins 6 motoneurones transfectés par CAVGFP après injection dans le gastrocnemius. Sections rostro-caudale de 100 μm de la substantia nigra
(B) ou du néocortex (C) après injection de ~2 × 109 particules dans le striatum de rat. Les images ont été acquises à l’aide d’un microscope confocal à balayage (Axiovert 100M, Zeiss) et le logiciel LSM 510. Les échantillons ont été excités à 488 nm et l’émission de la fluorescence collectée grâce à un filtre BP500-550 nm. |
Les caractéristiques de transduction préférentielle, de transport rétrograde et d’expression à long terme dans les neurones font des vecteurs CAV-2 gutless(pouvant désormais êtres produits à des titres élevés) des outils aux multiples applications tant pour la recherche fondamentale qu’en clinique, en particulier pour les maladies du système nerveux.