> Les cellules eucaryotes ont la particularité d’être divisées en différents compartiments permettant ainsi la régulation de nombreux processus cellulaires. La séparation des compartiments nucléaire et cytoplasmique est assurée par une double bicouche lipidique, l’enveloppe nucléaire. Le contrôle de la communication entre ces deux compartiments est assuré par les pores nucléaires [ 1]. En dépit de sa structure complexe, l’enveloppe nucléaire se dissocie au cours de la mitose dite « ouverte » des eucaryotes supérieurs et ses composants, dont les sous-unités des pores nucléaires qui ne sont pas ancrés dans la membrane, se dispersent à travers le cytoplasme. À la fin de la mitose, le processus est inversé et une nouvelle enveloppe nucléaire se forme autour des chromosomes de chaque cellule fille. En dépit de l’importance fondamentale de ce mécanisme, on ne connaissait jusqu’à présent que peu de choses sur l’assemblage des pores nucléaires en fin de mitose. Mais, récemment, deux études ont mis en évidence le rôle crucial d’un ensemble de protéines dans ce mécanisme et ont, de plus, permis de proposer un nouveau modèle d’assemblage des pores nucléaires [ 2, 3].
Les pores nucléaires (NPC, nuclear pore complexes) sont des structures macromoléculaires très organisées, ancrées dans l’enveloppe nucléaire. Les NPC sont constitués d’un anneau perforé par un canal central et prolongé par des filaments cytoplasmiques et nucléaires. Chez les vertébrés, les pores nucléaires, dont la masse moléculaire est évaluée à 125 MDa, sont composés d’une trentaine de protéines différentes appelées nucléoporines. Parmi ces protéines, seules deux présentent un domaine transmembranaire. Les autres protéines, assemblées en sous-complexes, interagissent entre elles pour former cet édifice (‹).
(‹) m/s 2002, n° 1, p. 41
Certaines nucléoporines caractérisées par des motifs répétés de type Phe-Gly (FG) ont une fonction prédominante dans le transport nucléo-cytoplasmique [1]. La fonction des autres nucléoporines est moins bien déterminée, et certaines d’entre elles assureraient plutôt le maintien de la structure du pore. Parmi ces protéines, Nup107, Nup160, Nup133, Nup96, Nup85 et Sec13 s’assemblent pour former le sous-complexe Nup107–160 [3– 5]. En collaboration avec l’équipe de Jan Ellenberg, (EMBL, Heidelberg, Allemagne) nous avions montré que les nucléoporines Nup107 et Nup133 sont des composants stables des NPC en interphase. De plus, ces deux nucléoporines sont adressées de façon très précoce à l’enveloppe nucléaire en fin de mitose, ce qui suggérait qu’elles puissent être impliquées dans les étapes précoces de l’assemblage des NPC [ 4].
Afin de déterminer le rôle du complexe Nup107–160 dans l’organisation fonctionnelle des NPC, nous avons employé une approche in vivo fondée sur la technique d’interférence ARN qui permet de bloquer spécifiquement l’expression d’un gène en dégradant les ARNm qu’il transcrit [ 6]. Par cette méthode, nous avons observé une déplétion partielle des nucléoporines Nup107 ou Nup133 après 48 ou 72 heures de traitement. Cette déplétion s’accompagnait de la diminution du marquage de nombreuses nucléoporines au niveau de l’enveloppe nucléaire [2]. Un résultat similaire a été obtenu par d’autres équipes en déplétant les nucléoporines Nup107 ou Nup85 [3, 7]. L’observation en microscopie électronique à balayage de la surface de l’enveloppe nucléaire de cellules témoins ou déplétées de Nup133 ou Nup107 (réalisée en collaboration avec l’équipe de Terry Allen, Manchester, UK) a révélé que les cellules dépourvues de l’une de ces deux nucléoporines contenaient trois fois moins de pores nucléaires que des cellules témoins [2].
Ces données confirmaient l’hypothèse selon laquelle le complexe Nup107 joue un rôle important dans l’assemblage des NPC. Cependant, cette déplétion n’était que partielle et s’accompagnait de défauts d’export des ARN messagers et d’import de certaines protéines, ce qui ne permettait pas de conclure à un effet direct du complexe Nup107–160. De ce fait, notre équipe, en collaboration avec l’équipe de Iain Mattaj (EMBL, Heidelberg), ainsi que l’équipe de D. Forbes ont complété cette étude par une approche in vitro, fondée sur la formation de noyaux dans des extraits d’ovocytes de xénope. Cette approche consiste à incuber de la chromatine de sperme démembré avec un extrait soluble d’ovocytes de xénope auxquel on ajoute ensuite des membranes. On peut alors suivre la formation d’une enveloppe autour des chromosomes ainsi que l’assemblage des pores nucléaires. Le complexe Nup107–160 étant stable en mitose, la déplétion complète de l’ensemble de ses constituants a été réalisée grâce à des anticorps dirigés respectivement contre Nup107 et Nup85. Ces études ont permis de mettre en évidence que des extraits totalement dépourvus de complexes Nup107–160 permettaient certes la formation d’une enveloppe nucléaire continue autour de noyaux, mais celle-ci était totalement dépourvue de pores [2, 3].
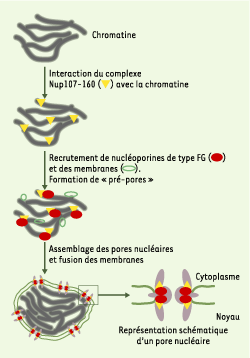
Parallèlement à la mise en évidence du rôle crucial du complexe Nup107–160 dans l’assemblage post-mitotique des NPC, des expériences complémentaires réalisées par l’équipe de Iain Mattaj nous ont permis d’établir un nouveau modèle d’assemblage des pores nucléaires en fin de mitose (Figure 1) [2]. En effet, le modèle proposé jusqu’alors suggérait que les pores nucléaires pouvaient s’assembler au sein d’une enveloppe nucléaire continue [ 8]. Or, nous avons montré que le complexe Nup107–160 interagit avec la chromatine de manière très précoce lors de la formation du noyau, et que ce complexe permet le recrutement de nucléoporines contenant des motifs de type FG, conduisant à la formation de « pré-pores » à la surface de la chromatine. De plus, l’ajout du complexe Nup107–160 purifié doit avoir lieu avant la formation d’une enveloppe nucléaire continue pour permettre l’assemblage des NPC dans des extraits dépourvus de ce complexe. Ainsi, l’assemblage des NPC en fin de mitose débute au niveau de la chromatine, et s’effectue de façon concomitante avec la fusion de l’enveloppe nucléaire. Il reste cependant à déterminer si ce mécanisme est également mis en jeu lors de l’assemblage des pores nucléaires en interphase.