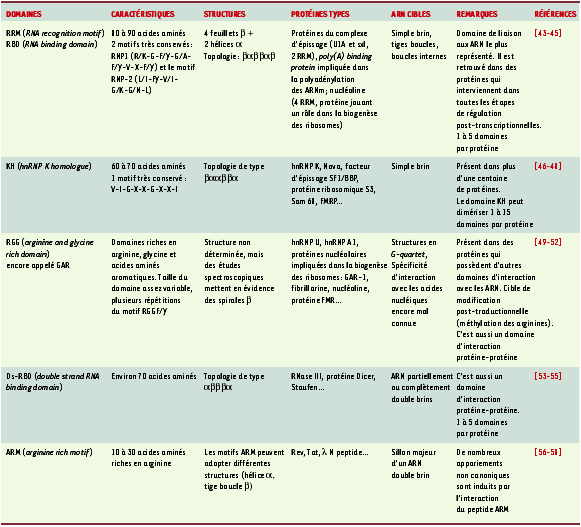
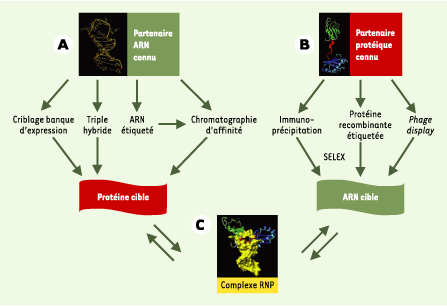
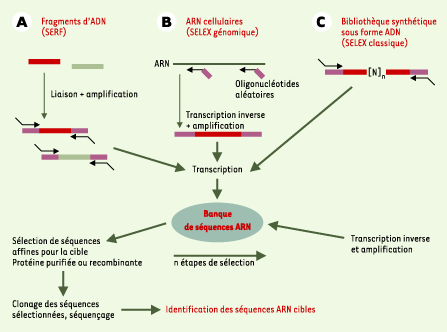
1.
Anantharaman V, Koonin EV, Aravind L. Comparative genomics and evolution of proteins involved in RNA metabolism. Nucleic Acids Res 2002; 30 : 1427–64.
2.
Tuerk C, Gold L. Systematic evolution of ligands by exponential enrichment : RNA ligands to bacteriophage T4 DNA polymerase. Science 1990; 249 : 505–10.
3.
Singer BS, Shtatland T, Brown D, Gold L. Libraries for genomic SELEX. Nucleic Acids Res 1997; 25 : 781–6.
4.
Stelzl U, Nierhaus KH. SERF : in vitro election of random RNA fragments to identify protein binding sites within large RNAs. Methods 2001; 25 : 351–7.
5.
Drolet DW, Jenison RD, Smith DE, Pratt D, Hicke BJ. A high throughput platform for systematic evolution of ligands by exponential enrichment (SELEX). Comb Chem High Throughput Screen 1999; 2 : 271–8.
6.
Ghisolfi-Nieto L, Joseph G, Puvion-Dutilleul F, Amalric F, Bouvet P. Nucleolin is a sequence-specific RNA-binding protein : characterization of targets on pre-ribosomal RNA. J Mol Biol 1996; 260 : 34–53.
7.
Serin G, Joseph G, Faucher C, et al. Localization of nucleolin binding sites on human and mouse pre-ribosomal RNA. Biochimie 1996; 78 : 530–8.
8.
Ginisty H, Serin G, Ghisolfi-Nieto L, et al. Interaction of nucleolin with an evolutionarily conserved pre-ribosomal RNA sequence is required for the assembly of the primary processing complex. J Biol Chem 2000; 275 : 18845–50.
9.
Tsai DE, Harper DS, Keene JD. U1-snRNP-A protein selects a ten nucleotide consensus sequence from a degenerate RNA pool presented in various structural contexts. Nucleic Acids Res 1991; 19 : 4931–6.
10.
Katsamba PS, Park S, Laird-Offringa IA. Kinetic studies of RNA-protein interactions using surface plasmon resonance. Methods 2002; 26 : 95–104.
11.
Darnell JC, Jensen KB, Jin P, Brown V, Warren ST, Darnell RB. Fragile X mental retardation protein targets G quartet mRNAs important for neuronal function. Cell 2001; 107 : 489–99.
12.
Tenenbaum SA, Lager PJ, Carson CC, Keene JD. Ribonomics : identifying mRNA subsets in mRNP complexes using antibodies to RNA-binding proteins and genomic arrays. Methods 2002; 26 : 191–8.
13.
Brown V, Jin P, Ceman S, et al. Microarray identification of FMRP-associated brain mRNAs and altered mRNA translational profiles in fragile X syndrome. Cell 2001; 107 : 477–87.
14.
Schaeffer C, Bardoni B, Mandel JL, Ehresmann B, Ehresmann C, Moine H. The fragile X mental retardation protein binds specifically to its mRNA via a purine quartet motif. Embo J 2001; 20 : 4803–13.
15.
Rodgers ND, Jiao X, Kiledjian M. Identifying mRNAs bound by RNA-binding proteins using affinity purification and differential display. Methods 2002; 26 : 115–22.
16.
Bachler M, Schroeder R, von Ahsen U. StreptoTag: a novel method for the isolation of RNA-binding proteins. Rna 1999; 5 : 1509–16.
17.
Paillard L, Omilli F, Legagneux V, Bassez T, Maniey D, Osborne HB. EDEN and EDEN-BP, a cis element and an associated factor that mediate sequence-specific mRNA deadenylation in Xenopus embryos. Embo J 1998; 17 : 278–87.
18.
SenGupta DJ, Zhang B, Kraemer B, Pochart P, Fields S, Wickens M. A three-hybrid system to detect RNA-protein interactions in vivo. Proc Natl Acad Sci USA 1996; 93 : 8496–501.
19.
Martin F, Schaller A, Eglite S, Schumperli D, Muller B. The gene for histone RNA hairpin binding protein is located on human chromosome 4 and encodes a novel type of RNA binding protein. Embo J 1997; 16 : 769–78.
20.
Sagesser R, Martinez E, Tsagris M, Tabler M. Detection and isolation of RNA-binding proteins by RNA-ligand screening of a cDNA expression library. Nucleic Acids Res 1997; 25 : 3816–22.
21.
Harada K, Martin SS, Frankel AD. Selection of RNA-binding peptides in vivo. Nature 1996; 380 : 175–9.
22.
Jain C, Belasco JG. A structural model for the HIV-1 Rev-RRE complex deduced from altered- specificity rev variants isolated by a rapid genetic strategy. Cell 1996; 87 : 115–25.
23.
Bouvet P, Jain C, Belasco JG, Amalric F, Erard M. RNA recognition by the joint action of two nucleolin RNA-binding domains : genetic analysis and structural modeling. Embo J 1997; 16 : 5235–46.
24.
Danner S, Belasco JG. T7 phage display: a novel genetic selection system for cloning RNA-binding proteins from cDNA libraries. Proc Natl Acad Sci USA 2001; 98 : 12954–9.
25.
Andersen JS, Lyon CE, Fox AH, et al. Directed proteomic analysis of the human nucleolus. Curr Biol 2002; 12 : 1–11.
26.
Scherl A, Coute Y, Deon C, et al. Functional proteomic analysis of human nucleolus. Mol Biol Cell 2002; 13 : 4100–9.
27.
Dragon F, Gallagher JE, Compagnone-Post PA, et al. A large nucleolar U3 ribonucleoprotein required for 18S ribosomal RNA biogenesis. Nature 2002; 417 : 967–70.
28.
Honey S, Schneider BL, Schieltz DM, Yates JR, Futcher B. A novel multiple affinity purification tag and its use in identification of proteins associated with a cyclin-CDK complex. Nucleic Acids Res 2001; 29 : E24.
29.
Rigaut G, Shevchenko A, Rutz B, Wilm M, Mann M, Seraphin B. A generic protein purification method for protein complex characterization and proteome exploration. Nat Biotechnol 1999; 17 : 1030–2.
30.
Mendell JT, Dietz HC. When the message goes awry : disease-producing mutations that influence mRNA content and performance. Cell 2001; 107 : 411–4.
31.
Charlet BN, Savkur RS, Singh G, Philips AV, Grice EA, Cooper TA. Loss of the muscle-specific chloride channel in type 1 myotonic dystrophy due to misregulated alternative splicing. Mol Cell 2002; 10 : 45–53.
32.
Xavier KA, Eder PS, Giordano T. RNA as a drug target: methods for biophysical characterization and screening. Trends Biotechnol 2000; 18 : 349–56.
33.
Schlunzen F, Zarivach R, Harms J, et al. A. Structural basis for the interaction of antibiotics with the peptidyl transferase centre in eubacteria. Nature 2001; 413 : 814–21.
34.
Opalinska JB, Gewirtz AM. Nucleic-acid therapeutics : basic principles and recent applications. Nat Rev Drug Discov 2002; 1 : 503–14.
35.
Sullenger BA, Gilboa E. Emerging clinical applications of RNA. Nature 2002; 418 : 252–8.
36.
Tanabe T, Kuwabara T, Warashina M, Tani K. Taira K, Asano S. Oncogene inactivation in a mouse model. Nature 2000; 406 : 473–4.
37.
Sullenger BA, Gallardo HF, Ungers GE, Gilboa E. Overexpression of TAR sequences renders cells resistant to human immunodeficiency virus replication. Cell 1990; 63 : 601–8.
38.
Darfeuille F, Arzumanov A, Gryaznov S, Gait MJ, Di Primo C, Toulme JJ. Loop-loop interaction of HIV-1 TAR RNA with N3’—>P5’ deoxyphosphoramidate aptamers inhibits in vitro Tat-mediated transcription. Proc Natl Acad Sci USA 2002; 99 : 9709–14.
39.
Ulrich H, Magdesian MH, Alves MJ, Colli W. In vitro selection of RNA aptamers that bind to cell adhesion receptors of Trypanosoma cruzi and inhibit cell invasion. J Biol Chem 2002; 277 : 20756–62.
40.
Drolet DW, Nelson J, Tucker CE, et al. Pharmacokinetics and safety of an anti-vascular endothelial growth factor aptamer (NX1838) following injection into the vitreous humor of Rhesus monkeys. Pharm Res 2000; 17 : 1503–10.
41.
Rusconi CP, Scardino E, Layzer J, et al. RNA aptamers as reversible antagonists of coagulation factor IXa. Nature 2002; 419 : 90–4.
42.
Lawrence D. RNAi could hold promise in the treatment of HIV. Lancet 2002; 359 : 2007.
43.
Birney ES, Kumar S, Krainer AR. Analysis of the RNA-recognition motif and RS and RGG domains: conservation in metazoan pre-mRNA splicing factors. Nucleic Acids Res 1993; 21 : 5803–16.
44.
Allain FH, Gilbert DE, Bouvet P, Feigon J. Solution structure of the two N-terminal RNA-binding domains of nucleolin and NMR study of the interaction with its RNA target. J Mol Biol 2000; 303 : 227–41.
45.
Ginisty H, Amalric F, Bouvet P. Two different combinations of RNA-binding domains determine the RNA binding specificity of nucleolin. J Biol Chem 2001; 276 : 14338–43.
46.
De Boulle K, Verkerk AJ, Reyniers E, et al. A point mutation in the FMR-1 gene associated with fragile X mental retardation. Nat Genet 1993; 3 : 31–5.
47.
Darnell JC, Jensen KB, Jin P, Brown V, Warren ST, Darnell RB. Fragile X mental retardation protein targets G quartet mRNAs important for neuronal function. Cell 2001; 107 : 489–99.
48.
Schaeffer C, Bardoni B, Mandel JL, Ehresmann B, Ehresmann C, Moine H. The fragile X mental retardation protein binds specifically to its mRNA via a purine quartet motif. EMBO J 2001; 20 : 4803–13.
49.
Ghisolfi L, Joseph G, Amalric F, Erard M. The glycine-rich domain of nucleolin has an unusual supersecondary structure responsible for its RNA-helix-destabilizing properties. J Biol Chem 1992; 267 : 2955–9.
50.
Birney E, Kumar S, Krainer AR. Analysis of the RNA-recognition motif and RS and RGG domains : conservation in metazoan pre-mRNA splicing factors. Nucleic Acids Res 1993; 21 : 5803–16.
51.
Bouvet P, Diaz JJ, Kindbeiter K, Madjar JJ, Amalric F. Nucleolin interacts with several ribosomal proteins through its RGG domain. J Biol Chem 1998; 273 : 19025–9.
52.
Hanakahi LA, Sun H, Maizels N. High affinity interactions of nucleolin with G-G-paired rDNA. J Biol Chem 1999; 274 : 15908–12.
53.
Ryter JM, Schultz SC. Molecular basis of double-stranded RNA-protein interactions: structure of a dsRNA-binding domain complexed with dsRNA. EMBO J 1998; 17 : 7505–13.
54.
Ramos A, Grunert S, Adams J, et al. RNA recognition by a Staufen double-stranded RNA-binding domain. EMBO J 2000; 19 : 997–1009.
55.
Conrad C, Rauhut R. Ribonuclease III: new sense from nuisance. Int J Biochem Cell Biol 2002; 34 : 116–29.
56.
Tan R, Frankel AD. Structural variety of arginine-rich RNA-binding peptides. Proc Natl Acad Sci USA 1995; 92 : 5282–6.
57.
Weiss MA, Narayana N. RNA recognition by arginine-rich peptide motifs. Biopolymers 1998; 48 : 167–80.
58.
Campisi DM, Calabro V, Frankel AD. Structure-based design of a dimeric RNA-peptide complex. EMBO J 2001; 20 : 178–86.