| |
| Med Sci (Paris). 2003 December; 19(12): 1280–1287. Published online 2003 December 15. doi: 10.1051/medsci/200319121280.Qu’est-ce que la biomédecine ? Repères socio-historiques Alberto Cambrosio1* and Peter Keating2 1Department of social studies of medicine, université McGill, 3647, rue Peel, Montréal (QC), H3A 1X1, Canada 2Département d’histoire, université du Québec à Montréal, case postale 8888, succursale Centre-ville, Montréal (QC), H3C 3P8, Canada |
Le terme « biomédecine » est désormais entré dans l’usage courant. On le trouve aussi bien dans la presse quotidienne que dans les traités savants, et il figure parmi les catégories qui structurent les politiques et l’administration de la santé [
1,
2]. Et pourtant, il ne semble pas y avoir de consensus sur le référent exact de ce terme qui, comme le notait un ancien directeur de la plus importante organisation de financement de la recherche biomédicale aux États-Unis, les National institutes of health (NIH), renvoie, dans certains cas, à tout l’éventail de pratiques qui s’étendent du purement biologique au purement clinique ([
3], p. 34). L’utilisation même du terme est parfois contestée. Ainsi, en 1968, l’une des figures centrales de la réforme de la médecine française, l’hématologiste Jean Bernard, avait violemment critiqué l’usage de ce terme qui, selon lui, constituait non seulement un barbarisme étymologique, mais camouflait surtout l’apport essentiel de la clinique à la recherche biologique, en laissant sous-entendre l’existence d’une voie à sens unique reliant cette dernière à ses applications cliniques ([
4], p. 342). Plus de 30 ans après, le débat continue. En 1999, par exemple, le président de l’association américaine des biophysiciens publiait dans la prestigieuse revue anglaise Nature un court article dans lequel il définissait la biomédecine comme une entreprise visant à réduire les maladies aux sciences moléculaires [
5]. De son côté, après avoir qualifié le terme biomédecine d’hybride et de mal défini, un chercheur-clinicien des NIH affirma qu’il télescopait de façon indue la biologie et la médecine et négligeait ainsi l’existence de puissants effets de rétroaction entre celles-ci [
6] (voir aussi [
7] et, pour des analyses historiques des relations entre le laboratoire et la clinique [
8–
9]). |
Les enjeux du terme biomédecine Le débat est loin d’être uniquement sémantique ou épistémologique. Pour certains, l’utilisation par les NIH du terme « sciences biomédicales », courante à partir des années 1960, obéit à une logique du détournement, au profit de la biologie moléculaire, de fonds théoriquement dévolus à l’étude des maladies [
10]. Cette critique se double souvent d’une dénonciation de la marginalisation corrélative d’autres domaines plus centrés sur le patient, comme la recherche clinique, l’épidémiologie, voire les recherches sur les systèmes de santé et les sciences du comportement [6]. Il est toutefois évident que, quel que soit le bien-fondé de ces dénonciations, un tel débat présuppose l’existence d’hypothèses implicites ou explicites quant à la façon dont les innovations se produisent au sein de la zone grise reliant, et séparant en même temps, les sciences biologiques et la médecine. Il est intéressant de rappeler la vogue assez récente, dans le monde de l’administration de la recherche biomédicale anglo-saxonne, d’un nouveau terme - translational research - qui vise justement à cadrer les interventions dans cette zone grise. De nombreuses définitions de cette notion ont été offertes, dont certaines renvoient à une traduction unidirectionnelle des résultats de la recherche en outils cliniques. Dans la plupart des cas, cependant, la métaphore dominante est celle du pont à traverser dans les deux directions, les méthodes, principes et substances développés dans les laboratoires devant être transférés à la clinique, pendant que les observations cliniques empruntent le chemin inverse, le tout de façon itérative [
11]. Qu’il s’agisse de construire des ponts ou encore, autre métaphore, d’établir de nouvelles interfaces entre le laboratoire et la clinique, l’enjeu principal demeure la production d’une nouvelle configuration matérielle, institutionnelle et épistémologique qu’on ne saurait réduire ni aux sciences biologiques (le normal) ni à la médecine (le pathologique) ; elle serait biomédicale, justement, dans la mesure où elle impliquerait un réalignement, mais non pas une fusion, du normal et du pathologique. Il s’agit de produire un nouvel espace d’intervention et de représentation au sein duquel de nouvelles entités biomédicales (telles que les marqueurs de surface cellulaire, les oncogènes ou les signatures génétiques identifiées par les puces à ADN), dont l’origine, l’utilisation et la signification relèvent simultanément de processus biologiques et de signes pathologiques, sont appelées à coexister. À la différence du xixe siècle, il ne s’agit plus, comme dans le cas des déclarations de programmes d’un Claude Bernard ou d’un Rudolf Virchow, d’essayer d’appliquer la biologie à la médecine. Si application il y a, il s’agit de prévoir, dans un cadre biomédical, si le résultat d’un projet de recherche ou d’une investigation, voire d’une intervention clinique donnée, vont aboutir à la production de faits biologiques ou cliniques. Ces deux activités demeurent dans une certaine mesure distinctes, mais la distance qui les séparait s’est en grande partie effacée. Le développement de la médecine et des sciences de la vie dans l’après-guerre est ainsi animé par un projet qu’on ne saurait qualifier ni de synthétique, ni de syncrétique, et qui se déploie simultanément au niveau institutionnel et au niveau du contenu des pratiques. |
Développements institutionnels et transformation des pratiques Pour ce qui est du côté institutionnel, il suffit de rappeler la croissance exponentielle des fonds consacrés, dans le monde occidental, à la recherche biomédicale, ainsi que la vague de réformes qui, dans l’après-guerre, ont considérablement élargi la notion de santé publique en y incorporant la recherche médicale. De ce point de vue, l’année 1948 est emblématique, car elle voit la naissance de deux institutions majeures dans le monde anglo-saxon. Au Royaume-Uni, la création du National health service (NHS) attribue au ministère de la Santé le pouvoir de financer et de superviser la recherche biomédicale : entre 1950 et 1970, le NHS, en association avec le Medical research council, établit 46 unités de recherche clinique au sein d’hôpitaux et d’universités [
12]. Aux États-Unis, la création des NIH se traduit rapidement en un financement massif de la recherche biomédicale par le gouvernement fédéral : dans les 25 ans qui suivent la fin de la guerre, la contribution du NIH passe de 27 millions de dollars à 1,7 milliard de dollars [
13] et, en 1975, cette source assure désormais le financement de 70 % des dépenses [
14]. Parallèlement, entre 1950 et 1980, le nombre de cliniciens-universitaires est multiplié par 12 et les écoles de médecine se tournent vers la recherche : en 1980, elles attribuent désormais 42 % des doctorats dans le domaine des sciences de la vie ([13], p. 251) (sur l’histoire de la recherche clinique, voir [
15–
16]). Au niveau du contenu des pratiques, la démonstration de notre thèse est plus complexe et se laisse difficilement résumer dans l’espace d’un court article. Nous avons donc choisi de l’illustrer à l’aide d’un exemple, en renvoyant le lecteur intéressé par plus de détails au livre que nous avons consacré à ce sujet [
17]. Comparons les Figures 1 et 2 : la Figure 1, tirée d’un manuel classique d’hématologie paru juste avant la seconde guerre mondiale ([
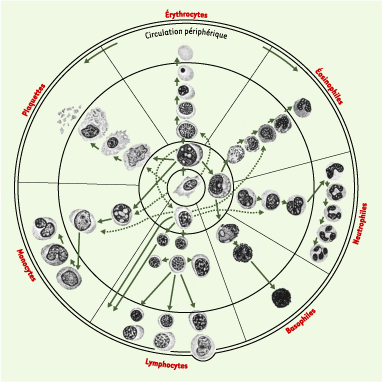
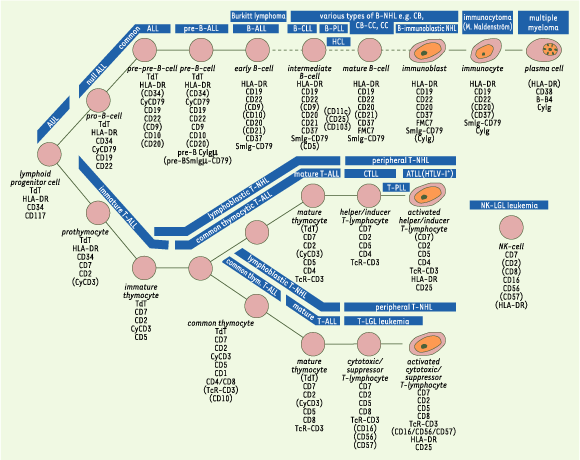
18], p. 2026), représente la filiation normale et pathologique des cellules sanguines : les lignées normales (donc aboutissant à la formation des différentes composantes cellulaires du sang chez les individus sains) sont représentées par des traits continus, alors que les traits pointillés représentent les filiations pathologiques (aboutissant, par exemple, à des cancers). La Figure 2 remonte quant à elle au milieu des années 1990, et représente le processus normal et pathologique de différenciation d’un sous-ensemble de cellules sanguines, les cellules lymphoïdes ([
19], p. 91). Il y a, entre ces illustrations, deux différences majeures qui incarnent, d’une façon quasi prototypique, le passage de la médecine à la biomédecine. La première concerne la représentation des cellules elles-mêmes. Dans l’illustration de 1938, les cellules, bien que dessinées de façon schématique, montrent clairement leurs caractéristiques morphologiques. On voit bien que cette illustration traduit le savoir visuel de générations de pathologistes et d’hématologistes penchés sur leur microscope. L’illustration de 1996, sauf (et encore) pour le cas de quelques cellules différenciées, renonce à toute dimension morphologique : chaque cellule est illustrée par un cercle au-dessous duquel figure une liste des marqueurs ou molécules de surface correspondant à son étape de différenciation. Le savoir-faire visuel a ici été remplacé par l’utilisation d’une technique qui, grâce à une combinaison d’anticorps, de molécules fluorescentes, de lasers et d’outils informatisés, produit une description (appelée immunophénotypique) des cellules en fonction du type et du nombre de molécules exprimées à leur surface. Cette technologie est venue s’ajouter aux autres technologies disponibles en nombre croissant sur les plateaux techniques de la plupart des hôpitaux et qui, prises dans leur ensemble, concrétisent l’ascension fulgurante de la biologie médicale.
 | Figure 1.Représentation morphologique des lignées de différenciation des cellules du sang, en 1938. Les lignes continues indiquent les filiations normales, les lignes en pointillé les filiations pathologiques (d’après [ 18], p. 2026). |
La deuxième différence renvoie explicitement à la question des relations entre le normal et le pathologique, et nous incite à revisiter un sujet déjà analysé de façon magistrale par Georges Canguilhem [
20]. La figure de 1938 prévoit l’existence de deux chemins distincts de différenciation correspondant à la situation normale, d’une part, et à certaines singularités pathologiques, d’autre part. En corollaire, il existerait une science du normal, permettant au biologiste d’étudier le développement des différentes lignées cellulaires du système sanguin dans différentes populations d’organismes, et une science du pathologique, pratiquée par d’autres professionnels, dans un cadre institutionnel différent, qui se préoccupe de cerner les lésions et les processus, notamment de dédifférenciation ou de régression à un phénotype fœtal, affectant certains individus et qui, par définition, ne relèvent pas du normal. La figure de 1996 télescope ou, mieux, aligne ces deux situations. Le ruban bleu au-dessus de chaque cellule comporte, en effet, le nom du type particulier de leucémie qui correspond à un état de différenciation donné, l’état pathologique étant désormais attribué non plus à un processus de dédifférenciation ou de régression, mais à l’arrêt de la maturation cellulaire au niveau d’une étape particulière du processus normal de différenciation. En d’autres termes, il n’existerait qu’un seul chemin de différenciation cellulaire, qui rendrait compte des situations pathologiques comme des situations normales, et dont l’étude a tendance à relever d’un même cadre institutionnel et professionnel. La situation est en réalité plus complexe car, comme nous l’avons souligné, il s’agit moins de réduire le pathologique au normal que d’aligner ces deux éléments. En effet, l’arrêt de maturation des cellules pathologiques à une étape donnée de leur différenciation normale implique, on a vite dû le reconnaître, des altérations subtiles de cette dernière, notamment un décalage ou découplage des processus qui contrôlent et agencent les phénomènes de prolifération et de différenciation. Ce découplage a d’ailleurs par la suite été redéfini en des termes de génétique moléculaire qui en ont modifié profondément la signification. Mais l’essentiel est que ces événements pathologiques, même lorsqu’ils retiennent leur singularité, ne prennent tout leur sens que dans le cadre d’une description dont la caractéristique principale est justement l’alignement d’entités normales et pathologiques représenté, dans le cas de la Figure 2, par leur juxtaposition.
 | Figure 2.Représentation immunophénotypique des processus normaux et pathologiques de différenciation des cellules lymphoïdes, en 1996 (d’après [ 19], p. 91). |
|
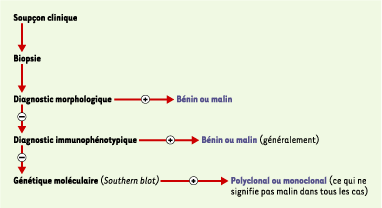
La notion de plate-forme biomédicale Mais comment un tel alignement est-il possible ? C’est justement pour rendre compte de ce processus que nous avons introduit la notion de « plate-forme biomédicale ». Cette dernière renvoie à un dispositif au cœur duquel on retrouve de nouvelles entités - dans notre exemple, les marqueurs de surface - qui se conjuguent à des techniques - dans notre exemple, l’immunophénotypage - et à d’autres éléments comme les savoirs et savoir-faire les concernant. Un tel dispositif sert de lieu de médiation et de régulation de la jonction entre le biologique et le médical. Encore une fois, un exemple, plutôt que de longues discussions, servira à préciser nos propos. La Figure 3, tirée d’un manuel de 1991, montre la séquence des plates-formes (morphologie, immunophénotypage, génétique moléculaire) intervenant dans le diagnostic des tumeurs lymphoïdes ([
21], p. 124). Cette séquence correspond à la séquence habituelle d’utilisation de ces dispositifs dans le cas d’un patient donné, ainsi qu’à la séquence historique de leur développement. Toutefois, comme on peut le constater, ces différentes plates-formes coexistent. En d’autres termes, la mise au point de chaque nouvelle plate-forme, tout en témoignant de la poursuite du processus d’innovation biomédicale, ne signifie pas la disparition des plates-formes qui l’ont précédée.
 | Figure 3.Étapes séquentielles du diagnostic des tumeurs lymphoïdes, d’après un schéma de 1991. Hiérarchie de la procédure analytique : chaque étape voit augmenter la sensibilité, le coût et la complexité des techniques utilisées. La progression dans l’algorithme peut être stoppée dès qu’un diagnostic définitif est posé (d’après [ 21], p. 124). |
La coexistence du nouveau avec l’ancien nécessite cependant un travail d’alignement entre les indications produites par ces différents dispositifs. Il s’agira, notamment, de développer des stratégies décisionnelles clinico-biologiques pour les situations où, par exemple, la morphologie indique la présence d’une maladie qui devrait en principe s’accompagner d’un phénotype différent de celui qui est constaté. Ce travail d’alignement ne relève pas uniquement du domaine des décisions diagnostiques quotidiennes, mais s’étend également à l’établissement de catégories nosologiques et à des domaines comme les essais cliniques, qui sont à l’origine de nouvelles stratégies thérapeutiques. Les débats entourant la définition d’une nouvelle classification des lymphomes, la classification dite REAL (revised european-american lymphoma classification, mais le double sens de l’acronyme n’est pas un hasard…) sont très instructifs à cet égard [
22]. Si les plates-formes mobilisent un ensemble de techniques en partie interchangeables (les marqueurs de surface peuvent ainsi être mis en évidence sur lamelle ou par cytométrie), leur spécificité découle de la présence en leur centre de nouvelles entités biomédicales. Ces dernières sont à la fois matérielles et conceptuelles : elles inaugurent et reproduisent une nouvelle notion - par exemple, la notion de marqueur de surface - tout en mobilisant des réactifs bien concrets - par exemple, des anticorps monoclonaux disponibles commercialement - qui se lient, à leur tour, à des équipements et des pratiques faisant l’objet de processus de régulation et de standardisation – par exemple, la création d’une nomenclature internationale CD (cluster of differentiation) des marqueurs (Figure 4). Ainsi, chaque nouvelle entité marque l’avènement d’un nouvel espace de représentation proprement biomédical.
 | Figure 4. Matérialité d’une notion : flacons de marqueurs de surface (CD19 et CD38) (photographie Alberto Cambrosio). |
|
L’émergence des marqueurs de surface : immunologie ou pathologie ? Si les débuts d’une plate-forme se confondent avec la production de nouvelles entités biomédicales au sein d’un système expérimental donné (pour cette dernière notion, voir [
23]), il est impératif d’examiner avec plus de détails l’émergence de ces dernières. Rapportons-nous, encore une fois, au cas des marqueurs de surface, ce qui nous permettra de poser à nouveau la question des rapports entre la clinique et le laboratoire. Il est en effet habituel, et en partie exact, de relier la mise en évidence de la présence à la surface des cellules du système immunitaire de molécules jouant un rôle essentiel au niveau de l’interaction cellulaire au développement, dans l’après-guerre, des recherches en immunologie cellulaire qui ont abouti à la distinction entre cellules T et cellules B et, à partir de là, à la mise au point de techniques pour la définition de différentes sous-classes lymphocytaires (sur l’histoire de cet épisode et, plus généralement, de l’immunologie, voir [
24]). Mais on oublie souvent que cette histoire toute biologique a un pendant du côté de la pathologie, notamment dans les travaux d’Edward A. Boyse et Lloyd J. Old, qui antidatent la distinction entre cellules T et B et qui, à partir de la recherche d’antigènes spécifiques de cancers, mirent en évidence vers 1970 la présence d’antigènes dits « de différenciation ». Ce terme est fort significatif car, en marquant ses distances par rapport aux notions d’antigènes tumoraux ou d’antigènes de transplantation, il renvoie à des entités qui, tout en étant associées au cancer, se retrouvent aussi sur des cellules normales (pour plus de détails, voir [17]). On sautera ici les étapes qui ont mené de cette première percée au programme visant à créer une immunologie de la surface cellulaire [
25], ainsi qu’à l’établissement d’une plate-forme d’immunophénotypage qui fit ses premières preuves dans le domaine des leucémies. Il faut en revanche retenir que, tout au long de ce processus, la nature et la présence des marqueurs furent établies simultanément au sein de systèmes expérimentaux biologiques et médicaux. De nombreux travaux, dont plusieurs ont été effectués en France (notamment par Maxime Seligmann), ont contribué à ce domaine. On peut toutefois s’arrêter plus particulièrement sur ceux d’un chercheur anglais, Melvyn F. Greaves, dont les travaux ont abouti, entre 1974 et 1984, à la production d’une « sous-classification « biologique » acceptable [des leucémies] en quatre catégories ayant chacune des caractéristiques hématologiques et des pronostics cliniques différents » ([
26], p. 303–4). M.F. Greaves travailla d’abord dans une unité d’immunologie des tumeurs, financée en tant qu’unité extra-muros par l’Imperial cancer research fund (ICRF), une des plus importantes institutions britanniques de soutien à la lutte contre le cancer, et dirigée par l’immunologiste N.A. Mitchison au sein du fameux Institut de recherche biomédicale de Mill Hill, dans la banlieue de Londres. Il dirigea ensuite, à partir de 1976, son propre laboratoire d’immunologie des membranes cellulaires, au sein du complexe de l’ICRF à Londres, avant d’obtenir en 1984 la direction du Centre de biologie cellulaire et moléculaire des leucémies établi par le Leukaemia research fund à l’Institut de recherches sur le cancer, toujours à Londres. Cette courte histoire institutionnelle fait ressortir le rôle de l’ICRF, un fait dont on appréciera l’intérêt en sachant qu’au début des années 1970, le nouveau directeur scientifique de l’ICRF, Michael Stoker, avait redéfini l’approche de son institution en misant non plus sur des recherches centrées directement sur le traitement des malades, mais sur ce qu’il appela « recherche stratégique » qui, tout en ayant une pertinence pour le cancer, pouvait aussi profiter à d’autres domaines. À tous ceux qui lui objectaient que la révolution biologique des décennies précédentes n’avait eu que peu d’impacts sur la médecine, il leur demandait de patienter ! L’unité d’immunologie des tumeurs et le laboratoire d’immunologie des membranes sont autant d’initiatives qui découlent de ce changement de cap opéré par M. Stoker. Dans le cadre de cet article, il s’agit moins de juger si l’investissement dans les travaux de M.F. Greaves peut être conçu comme une confirmation de la validité de l’option stratégique choisie par le nouveau directeur de l’ICRF que de noter que la dimension institutionnelle et le contenu des pratiques, que nous avions auparavant distingués pour des raisons analytiques, sont en effet étroitement imbriqués. |
Le tournant biomoléculaire Après l’immunophénotypage, qu’en est-il de la biologie moléculaire, dernière née dans le domaine de la biomédecine, et notamment de la relation entre nouvelle génétique et cancer ? Il est ici aussi difficile de résumer en quelques mots une démonstration complexe. Tout en renvoyant le lecteur à un autre de nos textes pour une analyse plus détaillée [
27], on peut simplement rappeler que, dans ce domaine également, les études socio-historiques souffrent d’un certain déséquilibre lié à ce qu’elles ne tiennent le plus souvent compte que des percées effectuées dans les laboratoires de biologie, dont elles décrivent ensuite les applications dans le domaine clinique (pour un résumé synthétique de l’histoire de la biologie moléculaire, voir [
28]). Pourtant, une telle fiction ne résiste pas à une analyse sérieuse. Si l’on examine, par exemple, le développement des enzymes de restriction et, corrélativement, des RFLP (restriction fragment length polymorphisms), on s’aperçoit que la première description des RFLP a été effectuée dans un cadre clinique (voir notamment les travaux de Yuet Kan et Andrée Dozy sur la thalassémie). Pour ce qui est de la théorie des oncogènes, on ne saurait ignorer la contribution de la cytogénétique aux recherches dans ce domaine, notamment en liaison avec les travaux sur les translocations chromosomiques au sein des lymphomes de Burkitt et des leucémies (voir notamment les travaux de Gilbert Lenoir et de George Klein). L’hypothèse selon laquelle la théorie des oncogènes aurait initialement été développée dans le cadre de recherches fondamentales en virologie, puis appliquée aux humains dans le milieu clinique, est intenable. Dès lors, il apparaît approprié de renoncer à la métaphore balistique de l’impact clinique de la nouvelle génétique et, du même coup, de situer la nouvelle génétique au sein d’un mouvement de plus longue haleine correspondant au développement de la biomédecine au cours des dernières décennies. La dernière percée technologique dans ce domaine, les puces à ADN, confirme une telle analyse. Ce type de dispositif se compose de centaines, voire de milliers de gènes accrochés à un support physique de la grandeur d’un centimètre carré. En hybridant une puce avec des extraits d’un échantillon donné, on peut détecter lesquels, parmi les gènes présents dans les cellules de l’échantillon, sont activés. Loin donc de concentrer l’attention sur la présence d’un oncogène en particulier, les puces à ADN permettent de cerner le profil global d’expression génétique d’une population cellulaire et, notamment, de retrouver la signature d’un type particulier de tumeur, surtout lorsque les résultats de centaines d’expériences menées avec des puces individuelles sont combinés électroniquement au sein d’une image de synthèse. Ces développements, dont l’importance se traduit par l’explosion exponentielle des publications qui leur sont consacrées, pourraient laisser croire qu’on a enfin trouvé une façon de contourner le travail patient des pathologistes, en aboutissant à un diagnostic sur la base d’un simple test biologique. La situation est cependant plus compliquée. On peut déduire la nature proprement biomédicale du dispositif par le fait que, sur les images résultant de ces expériences, les profils génétiques correspondant à des situations biologiques normales sont souvent juxtaposés à des profils génétiques de situations pathologiques, retrouvant ici le type d’alignement qui avait été recherché dans le cas de l’immunophénotypage. La puce elle-même se compose souvent simultanément de gènes pouvant être qualifiés de normaux et d’oncogènes, c’est-à-dire de gènes sélectionnés spécifiquement en raison de leur participation à des processus pathologiques. De plus, on peut facilement montrer que la conception de l’expérience et l’interprétation de ces résultats passent obligatoirement par l’utilisation de catégories nosologiques préexistantes, qui découlent notamment du travail accompli à l’aide d’autres plates-formes (pour une analyse détaillée, voir [
29]). Dans le cas des puces à ADN, nous sommes en d’autres termes une fois encore confrontés non pas à un transfert vers la clinique d’outils dérivés du laboratoire de biologie, mais au développement d’une nouvelle plate-forme par le biais d’un même cadrage biomédical. |
En guise de conclusion, il est intéressant de revenir sur l’origine du terme biomédecine, que la plupart des dictionnaires situent dans l’après-guerre. Le terme fait son apparition officielle à la fin des années 1940, dans le cadre des recherches menées à Los Alamos sur les effets biologiques et médicaux des émissions radioactives provoquées par les explosions atomiques. Il est ensuite repris, au début des années 1960, par l’agence spatiale américaine NASA, qui s’intéresse de près au monitoring des fonctions vitales des astronautes. Une décennie plus tard, il se transforme, du moins aux États-Unis, en une catégorie standard de la politique et de l’administration de la santé [
30]. Les dictionnaires anglo-saxons gardent une trace de ces origines lorsqu’ils définissent la biomédecine comme un domaine où s’effectue l’analyse des effets d’un environnement hostile (l’espace, la radioactivité) sur le corps humain. Mais ces mêmes dictionnaires offrent également une définition qui renvoie, elle, à la notion épistémologique d’une hybridation entre biologie et médecine. Ces deux définitions, tout en étant distinctes, se recoupent sur un point essentiel, le croisement entre le pathologique et le normal. Elles forment une sorte d’image en miroir : dans le premier cas, des corps normaux exposés à un environnement pathologique et, dans le deuxième cas, des corps affectés par diverses pathologies, qui réclament d’une science du normal une solution à leurs problèmes. Ce recoupement n’est pas uniquement sémantique. En effet, les recherches menées à Los Alamos ont abouti à la production de résultats et d’instruments à l’origine du développement de la médecine nucléaire [
31]. Quant à la NASA, le monitoring des astronautes et l’instrumentation s’y rattachant ont également connu une traduction « terrestre » : comme le remarquait un intervenant de l’époque, « si on peut faire du monitoring chez des singes en orbite, il n’y a aucune raison de ne pas en pratiquer chez les patients » ([
32], p. 200). Dans les deux cas, on le voit bien, on ne saurait sous-estimer l’importance du développement de nouvelles technologies de mesure, qu’il ne s’agit pas de réduire à de simples instruments ou de concevoir comme des variables indépendantes [
33]. En effet, qui dit mesure dit biologie : contrairement aux lésions pathologiques, les variables biologiques fluctuent de façon continue et s’appliquent à des populations. Elles ouvrent ainsi la porte à de nouvelles pratiques comme le monitoring au sein de populations ou le dépistage de patients potentiels [
34]. Jean Bernard l’avait bien compris qui, à l’issue d’un colloque sur l’automatisation en hématologie, faisait remarquer que le futur de cette discipline dépendait de l’automatisation, puisque celle-ci impliquait bien plus qu’une simple accélération du travail de laboratoire. Selon Jean Bernard, l’automatisation et les pratiques qui l’entourent renvoyaient à la transgression d’une série de dichotomies fondamentales (quantitatif/qualitatif, aspect/fonction) et à l’émergence d’un nouvel espace de représentation au sein duquel, comme nous l’avons signalé à propos des marqueurs de surface et de l’immunophénotypage par cytométrie, l’examen morphologique des cellules sous le champ optique d’un microscope fait place à l’analyse d’images produites par des instruments électroniques [
35]. La biologie a, pourrait-on dire, encerclé la médecine. Que ce soit sous la forme de tests prédiagnostiques, du monitoring de populations entières ou de procédures thérapeutiques chez certains patients, l’examen de variables biologiques quantifiables est aujourd’hui omniprésent dans le champ médical. Mais on ne saurait en conclure que la médecine se réduit désormais aux sciences biologiques ! Bien au contraire, on peut justement souligner que la biomédecine correspond à un projet nécessairement inachevé et en continuel devenir, qui implique le réalignement constant des pratiques cliniques et des pratiques de laboratoire au sein de nouvelles plates-formes. Toute analyse socio-historique ou politique d’innovation biomédicale qui ne tiendrait compte que d’un seul côté de cette équation (le laboratoire) se méprendrait sur la dynamique profonde de ce processus. |
1. Tubiana M. Histoire de la pensée médicale. Les chemins d’Esculape. Paris : Flammarion, 1995 : 713 p. 2. Gaudillière JP. Inventer la biomédecine. La France, l’Amérique et la production des savoirs du vivant (1945-1965). Paris : La Découverte, 2002 : 392 p. 3. Ahrens EH. The crisis in clinical research : Overcoming institutional obstacles. New York : Oxford University Press, 1992, 236 p. 4. Picard JF. De la médecine expérimentale (1865) à l’INSERM (1964). In : Debru C, Gayon J, Picard JF, ed. Les sciences biologiques et médicales en France, 1920-1950. Paris : CNRS, 1994 : 329–44. 5. Dill KA. Strengthening biomedicine’s roots. Nature 1999; 400 : 309–10. 6. Schechter AN. Medicine and biology are more than biomedicine. Nature 1999; 401 : 424. 7. Schechter AN. The crisis in clinical research : Endangering the half-century National institutes of health consensus. JAMA 1998; 280 : 1440–2. 8. Löwy I. Between bench and bedside. Science, healing, and interleukin-2 in a cancer ward. Cambridge, Mass. : Harvard University Press, 1996 : 370 p. 9. Sinding C. Le clinicien et le chercheur. Des grandes maladies de carence à la médecine moléculaire, 1880-1980. Paris : Presses Universitaires de France, 1991 : 284 p. 10. Feinstein AR. The crisis in clinical research. Bull Hist Med 1995; 69 : 288–91. 11. Chabner BA, Boral AL, Multani P. Translational research : Walking the bridge between idea and cure. Seventeenth Bruce F. Cain memorial award lecture. Cancer Res 1998; 58 : 4211–6. 12. Thomson AL. Half a century of medical research. London : HMSO, 1973–1975. 13. Rothstein WG. American medical schools and the practice of medicine : A history. New York : Oxford University Press, 1987 : 408 p. 14. Geiger RL. Science and the university. In : Krige J, Pestre D, ed. Science in the twentieth century. Amsterdam : Harwood Academic, 1997 : 159–74. 15. Boot CC. Clinical Research. In : Bynum WF, Porter R, ed. Companion encyclopedia of the history of medicine. Vol. I. London : Routledge, 1993 : 205–29. 16. Lawrence C. Clinical Research. In : Krige J, Pestre D, ed. Science in the twentieth century. Amsterdam : Harwood Academic, 1997 : 439–59. 17. Keating P, Cambrosio A. Biomedical platforms. Realigning the normal and the pathological in late-twentieth-century medicine. Cambridge, MA : MIT Press, 2003 : 560 p. 18. Downey H. Handbook of hematology. Vol. 3. New York : Hafner, 1965. 19. Van Dongen JJM, Adriaansen HJ. Immunobiology of leukemia. In : Henderson ES, Lister TA, Greaves MF, ed. Leukemia. 6th ed. Philadelphia : Saunders, 1996 : 83–130. 20. Canguilhem G. Le normal et le pathologique. Paris : Presses Universitaires de France, 1972, 226 p. 21. Whittaker MH, Willman CL. A practical guide to the use of molecular genetic techniques in the diagnosis of lymphoid malignancies. In : Fenoglio-Preiser CM, Willman CL, ed. Molecular diagnostics in pathology. Baltimore : Williams and Wilkins, 1991 : 123–48. 22. Keating P. Cambrosio A. Real compared to what ? diagnosing leukemias and lymphomas. In : Lock M, Young A, Cambrosio A, ed. Living and working with the new medical technologies. Intersections of inquiry. Cambridge, UK : Cambridge University Press, 2000 : 103–34. 23. Rheinberger HJ. Toward a history of epistemic things. Synthesizing proteins in the test tube. Stanford : Stanford University Press, 1997 : 325 p. 24. Moulin AM. Le dernier langage de la médecine. Histoire de l’immunologie de Pasteur au sida. Paris : Presses Universitaires de France, 1991; 447 p. 25. Raff MC. Cell-surface immunology. Sci Am 1976; 234 : 30–9. 26. Austoker J. A history of the Imperial cancer research fund, 1902-1986. Oxford : Oxford University Press, 1988 : 375 p. 27. Keating P, Cambrosio A. The new genetics and cancer. The contributions of clinical medicine in the era of biomedicine. J His Med Allied Sci 2001; 56 : 321–52. 28. Morange M. Histoire de la biologie moléculaire. Paris : La Découverte, 1994 : 358 p. 29. Keating P, Cambrosio A. Signs, markers, profiles, and signatures : Clinical hematology meets the new genetics (1980-2000). New Genetics and Society 2004; 23 (sous presse). 30. Thomas L. Aspects of biomedical science policy. Washington : National academy of sciences - Institute of medicine, 1972 : 16 p. 31. Lenoir T, Hays M. The Manhattan project for biomedicine. In : Sloan PR, ed. Controlling our destinies. Historical, philosophical, ethical, and theological perspectives on the Human genome project. South Bend, Indiana : University of Notre Dame Press, 2000 : 29–62. 32. Reiser SJ. Medicine and the reign of technology. Cambridge, UK : Cambridge University Press, 1981 : 317 p. 33. Keating P, Limoges C, Cambrosio A. The automated laboratory. The generation and replication of work in molecular genetics. In : Fortun M, Mendelsohn E, ed. The Practices of human genetics. Dordrecht : Kluwer, 1999 : 125–42. 34. Kaufert PA. Screening the Body : The pap smear and the mammogram. In : Lock M, Young A, Cambrosio A, ed. Living and working with the new medical technologies. Intersections of inquiry. Cambridge, UK : Cambridge University Press, 2000 : 165–83. 35. Bernard J. Summing up. Blood Cells 1980; 6 : 499–500. |