| |
| Med Sci (Paris). 2003 February; 19(2): 231–238. Published online 2003 February 15. doi: 10.1051/medsci/2003192231.Méthodes non invasives de mesure de la densité minérale osseuse Christian Roux* Centre d’Évaluation des Maladies Osseuses, Institut de Rhumatologie, Hôpital Cochin, 27, rue du Faubourg Saint- Jacques, 75014 Paris, France |
Par des méthodes non invasives, il est actuellement possible de mesurer, de manière précise et reproductible, la densité minérale osseuse du squelette périphérique ou axial, et de distinguer les zones trabéculaires et corticales. Ces méthodes, regroupées sous le terme de densitométrie, permettent de faire le diagnostic de l’ostéoporose et d’estimer le risque de fracture ultérieure [
1]; elles sont indispensables à la décision thérapeutique. |
Absorptiométrie Cette technique est la technique de référence. Elle repose sur la mesure de l’absorption d’un faisceau de photons X. Cette absorption dépend de l’énergie d’émission, de la nature et de l’épaisseur du milieu traversé. La loi générale de l’absorption est I = I oe -μX où I o est l’énergie initiale émise, I l’énergie résiduelle, μ le coefficient d’atténuation (dont l’expression est l’inverse d’une longueur) et x, l’inconnue, est l’épaisseur du tissu. Chaque tissu traversé est caractérisé par un coefficient d’atténuation μ et, si l’on assimile le corps humain à deux compartiments (1 = os, 2 = parties molles), alors I = I oe -μ1d1 - μ2d2 où d est la masse surfacique. Une telle équation peut être résolue en considérant constante l’épaisseur des parties molles (principe de l’absorptiométrie mono-énergétique), ou en utilisant deux énergies incidentes (basse et haute) constituant ainsi un système de deux équations à deux inconnues: c’est le principe de l’absorptiométrie biphotonique. Les coefficients μ sont connus et exprimés à partir de références: l’hydroxyapatite pour l’os, et une composition moyenne standard de tissus maigre et gras pour les parties molles. Le terme d est exprimé en g/cm 2; il est en pratique appelé « densité ». C’est le résultat fourni par les examens d’absorptiométrie biphotonique (DXA, dual photon X ray absorptiometry). Les deux énergies sont obtenues soit en faisant varier la tension du tube à rayons X afin d’obtenir deux spectres ( pulses à 70 et 140 kVp), soit en filtrant l’émission par des terres rares (cérium, néodyme), le tube restant alimenté par une énergie constante. Les corrections pour les contenus graisseux varient d’un constructeur à l’autre et sont une des causes des différences de résultats. Le faisceau de rayons X peut être finement resserré en pinceau (single beam ou pencil beam) et les mesures sont alors faites point par point. Le faisceau peut également être en éventail, tous les points d’une même ligne étant mesurés simultanément (fan beam ou array mode). La ligne est perpendiculaire au sujet, le déplacement de l’appareil se fait dans le sens longitudinal. Cette technique utilise une barrette de détecteurs; l’association d’un faisceau et de multidétecteurs diminue beaucoup le temps d’examen. Ce système en faisceau entraîne une distorsion géométrique prise en compte par le calcul. Des appareils récents proposent une détection encore plus rapide avec une plaque de détecteurs; ils sont en cours d’évaluation. Les appareils de DXA peuvent mesurer toutes les pièces du squelette. La Figure 1 illustre les deux zones de mesures utiles en clinique: le rachis lombaire et l’extrémité supérieure du fémur. Des mesures du poignet, du squelette complet, de la main sont parfois réalisées.
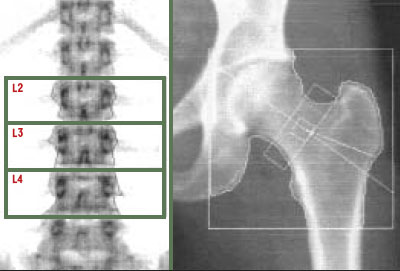
 | Figure 1.
Absorptiométrie biphotonique à rayons X du rachis lombaire et de l’extrémité supérieure du fémur. Les cadres definissent les regions d’analyse. Les limites osseuses (en ligne brisee) sont determinees de maniere automatique par le logiciel de reconnaissance des contours. |
Scanner Le scanner, ou tomodensitométrie quantitative, est la seule technique capable de fournir un résultat exprimé par unité de volume, donc une densité vraie. C’est un outil de recherche, qui n’a pas sa place en pratique clinique. Des scanners pour os périphériques (pQCT) sont proposés, en particulier pour la partie distale du radius: il est possible sur la coupe de distinguer l’enveloppe corticale, et d’en mesurer l’épaisseur, la surface et la densité. Ces mesures sont en cours d’évaluation [
2]. Ultrasons Plusieurs appareils permettent aujourd’hui de mesurer les variations de paramètres ultrasonores mesurés en transmission, lors de la traversée d’un tissu osseux périphérique (calcanéum, phalange). Ces appareils sont petits, peu coûteux, simples à utiliser et, pour certains, portables. La mesure est très rapide et sans irradiation. Néanmoins, il existe une très grande diversité technologique, ce qui rend impossible la comparaison de résultats obtenus avec des appareils différents. Deux paramètres sont mesurés en routine : l’atténuation et la vitesse du faisceau. L’atténuation dépend de l’absorption (fonction de la structure physique et chimique du milieu) et de la dispersion (fonction de la longueur d’onde et du milieu traversé). La relation entre la fréquence d’émission et l’atténuation est polynomiale mais peut être considérée comme quasi linéaire dans la bande fréquentielle de 0,2-0,6 MHz. La pente de cette droite, appelée broadband ultrasound attenuation (BUA) s’exprime en dB/MHz. La vitesse des ultrasons appelée speed of sound (SOS) ou bone velocity (Vb) dépend de la densité du milieu et de certaines de ses propriétés mécaniques, en particulier de l’élasticité; elle s’exprime en m/s. De nombreux travaux expérimentaux ont montré que les ultrasons pouvaient mesurer certains paramètres de la qualité de l’os, en particulier son élasticité. L’atténuation des ultrasons est dépendante de l’orientation des travées osseuses, donc de l’anisotropie [
3]. Ces résultats sont obtenus lors de mesures pluridirectionnelles ex vivo. Lors de mesures unidirectionnelles en transmission, comme celles pratiquées en clinique, de nombreux résultats ex vivo et in vivo ont montré que les paramètres ultrasonores dépendent essentiellement de la densité osseuse [
4]. Il est possible qu’une part des résultats soit expliquée par la structure de l’os, ce qui fait tout l’intérêt potentiel de la technique. Toutefois, à ce jour, ces mesures ne doivent pas être considérées comme des mesures directes de la qualité osseuse mais comme des mesures densitométriques périphériques [
5]. C’est dans ce contexte que nous verrons plus loin leur intérêt clinique par rapport à la méthode de référence. |
Performances des appareils d’absorptiométrie biphotonique Irradiation L’irradiation provoquée par un examen d’absorptiométrie biphotonique à rayons X est de 1 à 4 μSv en fonction du type d’appareil et de la zone examinée; il n’y a donc pas d’effet radiobiologique observable [
6]. Ces chiffres sont de l’ordre de l’irradiation naturelle en France. Ils sont très inférieurs à ceux d’examens radiologiques habituels. Précision La précision est l’estimation de l’erreur faite en estimant la valeur réelle de l’objet mesuré. En densitométrie, elle est calculée en comparant la valeur obtenue au poids des cendres de l’os [
7]. La corrélation est généralement élevée et on estime l’erreur inférieure à 10 % pour les mesures du rachis. Cette erreur serait légèrement supérieure pour la mesure de l’extrémité supérieure du fémur, mais il existe peu de données. L’inexactitude de la mesure est liée essentiellement aux variations de graisse intraosseuse, et de parties molles autour de l’os. Cette erreur de mesure doit être distinguée des causes d’erreur de la mesure, comme l’arthrose rachidienne (articulaire postérieure ou discale) qui peut entraîner des difficultés d’analyse et une surestimation du résultat. Reproductibilité La reproductibilité est l’estimation de l’erreur de mesure faite sur un même échantillon lors de la répétition des mesures. Elle conditionne l’intérêt de cette répétition. Elle est généralement exprimée par le coefficient de variation (CV): elle est de l’ordre de 1 à 2 % pour les mesures du rachis lombaire et du fémur, en incidence antéro-postérieure, chez les sujets jeunes. Chez le sujet ayant une ostéoporose, ce coefficient de variation est plus souvent de l’ordre de 3 à 5 %. On admet qu’une variation des valeurs de densitométrie n’est pas liée à une erreur de mesure pour un individu si cette variation dépasse 2,77 CV, soit 2,8 % au rachis lombaire chez un sujet jeune, et 8 % au même site chez un sujet ayant une ostéoporose. Cette reproductibilité est bien meilleure que celle de la plupart des dosages biologiques. Nous avons montré que l’erreur de mesure est indépendante de la densité; il est souhaitable d’obtenir des seuils de variation exprimés en valeur absolue [
8]. À condition de respecter l’indispensable contrôle de qualité des machines et d’être rigoureux quant aux conditions de réalisation des examens, la principale source de variation est la variation biologique. En clinique, la reproductibilité n’est pas un paramètre suffisant pour juger de l’intérêt de la répétition des mesures, qui dépend aussi de la sensibilité au changement du site osseux mesuré: les mesures périphériques sont très reproductibles, mais le radius et le calcanéum semblent insensibles aux traitements antiostéoporotiques. |
Interprétation des résultats Le résultat de l’absorptiométrie biphotonique à rayons X est la densité osseuse (BMD, bone mineral density en g/cm2). D’autres paramètres sont calculés: le contenu minéral osseux (BMC, bone mineral content, en g), la surface osseuse (en cm2). La densité (BMD) ainsi mesurée dépend de la quantité de matrice osseuse calcifiée et de son degré de minéralisation. Elle peut donc varier en fonction du degré de minéralisation, alors que la quantité de matrice ne varie pas. C’est pourquoi les termes « densité osseuse » et « masse osseuse » ne sont pas synonymes, et ce dernier ne doit pas être employé à propos de la densitométrie. Compte tenu de la variation de la densité osseuse avec l’âge et de la variabilité inter-individuelle, les résultats peuvent être exprimés en écart-types (Z et T scores). Le diagnostic de l’ostéoporose est fait aujourd’hui sur le T score (Figure 2). Le résultat peut aussi être « traduit » en estimation du risque de fracture. Le T score est l’écart entre la valeur du patient et la valeur moyenne des sujets normaux de même âge et de même sexe: pour des valeurs ayant une répartition gaussienne, 95 % des valeurs de la population se distribuent entre Z = + 2 et Z = - 2. Par définition, 14 % des sujets considérés comme normaux ont une densité située entre une et deux déviations standards au-dessous de la moyenne. On voit donc les limites de l’utilisation de ce score, en particulier chez les sujets âgés, faisant appeler « normaux » des sujets ayant des valeurs très basses.
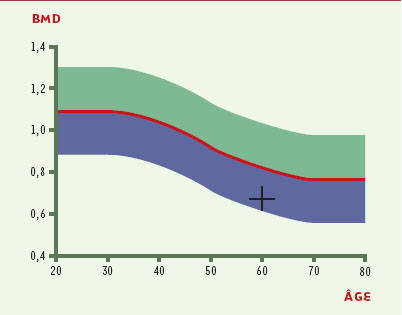
 | Figure 2.
Résultat d’une densitométrie du rachis lombaire par absorptiométrie biphotonique à rayons X.Chez cette femme de 60 ans, la densité (BMD) des quatre vertébres lombaires (L1-L4) est 0,671 g/cm2 (indiqué par la croix noire), soit un T score de -3,42. Ce T score indique une ostéoporose. La courbe de reférénce (en rouge) est indiquee ainsi que deux écarts-types de part et d’autre (zones bleue et verte). Le T score est calculé é à partir de l’écart entre la valeur du patient et la valeur moyenne des adultes jeunes (20 ans) de même sexe. Il s’exprime en écart-types et est calculé automatiquement par la machine. |
Le T score est l’écart entre la valeur du patient et la valeur moyenne des adultes jeunes (20 ans) de même sexe. Ce T score s’exprime en écart-types. Compte tenu du lien établi par des études épidémiologiques, entre la diminution de la densité osseuse et l’augmentation du risque de fracture, un groupe d’experts réunis par l’Organisation Mondiale de la Santé a proposé une définition de l’ostéoporose reposant sur le T score [
9]: l’ostéoporose est définie par T ≤ -2,5, et l’ostéopénie par -2,5 < T ≤ -1. Avec une telle definition, compte tenu de la distribution gaussienne de la BMD et de sa diminution avec l’âge, 0,7 % seulement des femmes jeunes et 30 % des femmes de 45 à 80 ans, ont une ostéoporose. L’usage du T score nécessite bien entendu de maîtriser la valeur de référence, c’est-à-dire la valeur moyenne de la densité osseuse des adultes jeunes et l’écart-type correspondant. Celui-ci varie entre 10 et 15 %. Or, il apparaît des discordances importantes entre les valeurs de référence des constructeurs, mais aussi entre celles des constructeurs et celles des investigateurs. Selon que l’on utilise la courbe du constructeur ou la courbe locale, la proportion de femmes londoniennes ayant une ostéoporose passe de 15 à 6 % pour une mesure au rachis, et de 23 à 3 % pour une mesure au col fémoral [
10]. Il est recommandé d’utiliser des références adaptées à la population mesurée ou la norme NHANES [
11]. Le changement de valeur de référence d’un constructeur abandonnant ses valeurs pour celles du NHANES a fait diminuer la prévalence de l’ostéoporose fémorale de 49 à 28 % [
12], pourcentage qui est plus proche de la réalité. Ces discordances, mises en évidence pour l’absorptiométrie biphotonique, doivent rendre prudent quant aux données fournies par les nouvelles techniques: il est indispensable d’exiger des constructeurs des garanties sur les valeurs de référence fournies avec les nouvelles machines de densitométrie périphérique et par ultrasons. Ce seuil diagnostique ne s’applique pas à tous les sites osseux mesurés. Lors de la mesure de la densité osseuse trabéculaire vertébrale par scanner, la valeur moyenne des individus atteint le seuil T - 2,5 vers 65 ans alors que pour des mesures ultrasonores du calcanéum, ce seuil est franchi au-delà de 100 ans [
13]. Le site de la mesure est donc un point important à prendre en compte [
14]: les coefficients de corrélation des densités osseuses mesurées à différents sites sont de l’ordre de 0,4 à 0,7, ce qui explique que, pour un même individu, on ne puisse estimer ou calculer la densité à un site à partir des résultats obtenus à un autre site. Par exemple, chez les femmes de moins de 65 ans, il existe une discordance de 20 à 30 % entre les données du rachis et du col fémoral [14,
15]. À cet âge, il est intéressant de privilégier les sites riches en os trabéculaire, en particulier le rachis. Après 65 ans, en revanche, les remaniements dégénératifs rachidiens sont fréquents rendant souvent difficile l’interprétation de la densitométrie rachidienne, la mesure fémorale doit donc être privilégiée. Ces résultats illustrent l’hétérogénéité de la maladie, la variabilité de la perte osseuse aux différents sites mesurés, et la précision variable des mesures. Cela pose le problème de la standardisation du site de mesure pour le diagnostic de l’ostéoporose: le diagnostic de l’hypertension se fait au bras et non à la carotide ou à l’artère fémorale, où les résultats sont différents. La recommandation internationale est de faire le diagnostic de l’ostéoporose par une mesure de densité à l’extrémité supérieure du fémur (zone totale), ou au rachis; les seuils diagnostiques actuels ne s’appliquent pas aux sites périphériques. On peut tenter de s’affranchir du T score en définissant l’ostéoporose sur un « risque absolu » de fracture. On peut en effet calculer le « risque à 10 ans » d’une fracture: pour un T score fémoral ≤ -2,5 le risque d’avoir une fracture dans les 10 ans serait de 11,3 % à 50 ans, 19,3 % à 65 ans, 25,6 % à 85 ans [
16]. Ce risque est estimé à partir du résultat d’études prospectives par régression logistique. Connaissant les coefficients de régression pour l’âge et la BMD, on peut fixer un seuil de risque de fracture jugé inacceptable, qui devient le seuil de BMD (en valeur absolue) servant à la décision thérapeutique [15]. Cette notion de risque à 5 ou 10 ans nécessite d’être validée mais elle est, en clinique, très intéressante; en effet, elle permet d’envisager des séquences thérapeutiques de quelques années, tenant compte d’un éventuel effet rémanent des traitements, plutôt que d’envisager un irréalisable traitement « à vie ». |
La densitométrie en clinique Validation et interprétation des mesures De nombreuses études transversales ont montré que les sujets ayant des fractures liées à l’ostéoporose ont des densités osseuses plus basses que les sujets de même âge sans fracture. Il existe toutefois un chevauchement des valeurs: certains sujets n’ayant pas eu de fracture ont des densités très basses, voisines de celles de certains sujets ayant eu une fracture. Cette constatation a longtemps jeté le discrédit sur la méthode, en raison d’une erreur d’interprétation: la densitométrie n’est pas utile au diagnostic de fracture mais au diagnostic de diminution de la masse osseuse, comme la mesure de la pression artérielle n’est pas utile au diagnostic d’accident vasculaire mais au diagnostic de la maladie hypertensive. La diminution de la densité osseuse est ainsi une maladie (l’ostéoporose) et représente un facteur de risque (de fracture). L’ostéoporose est une maladie générale du squelette caractérisée par une diminution de la densité osseuse et une détérioration de la micro-architecture osseuse, ayant pour conséquence une augmentation de la fragilité osseuse et du risque de fracture. Les mesures quantitatives n’explorent pas les paramètres qualitatifs de l’os, mais les études biomécaniques montrent que la densité est le déterminant essentiel de la solidité osseuse [
17]. Des travaux expérimentaux montrent la possibilité d’accès à des caractéristiques osseuses non quantitatives par analyse d’images (de radiographies standard, de scanner ou d’imagerie par résonance magnétique) [
18]. Leur intérêt clinique par rapport à la densitométrie reste à préciser. Ce sont les études prospectives qui ont permis de démontrer la relation entre densité osseuse et survenue de fracture. Elles montrent que le risque de fracture augmente de manière exponentielle avec la diminution de la densité osseuse [
19–
23]. Le Tableau I résume les risques relatifs de fracture en fonction du site mesuré. Toutes les fractures sont prédites de la même manière par toutes les mesures. Seul le risque de fracture de l’extrémité supérieure du fémur est mieux estimé par la mesure directe de ce site. Ce mode d’expression en risques relatifs est commode et montre que, en théorie, un individu ayant un T score de 3 écart-types au col fémoral aura un risque de 2,63, soit environ 17 fois plus grand qu’un individu ayant un T score à 0. Mais ceci est un risque relatif, et non absolu, et il faut prendre en compte la mauvaise sensibilité des mesures: la sensibilité dépasse 50 % seulement pour les gradients de risque supérieurs à 3. Par conséquent, comme la mesure de la pression artérielle, la mesure de la densité osseuse ne permet pas de répondre à la question: « qui fera une fracture? » (ou qui fera un accident vasculaire cérébral?), elle permet de classer un sujet dans une catégorie à risque plus ou moins grand.
 | Tableau I.
Risque relatif (avec intervalle de confiance à 95 %) de fracture pour une diminution d’un écart-type de la densité osseuse.
(D’après [23]).
|
La stratégie d’utilisation des mesures périphériques (absorptiométrie monophotonique du poignet, mesure ultrasonore du calcanéum ou des phalanges) par rapport à la technique de référence n’est pas connue. Elles pourraient servir d’examen de dépistage chez des patientes ménopausées nécessitant des mesures par absorptiométrie biphotonique à rayons X, mais cela augmente les coûts. De plus, l’interprétation des résultats obtenus par ces techniques périphériques doit être faite avec précaution: s’il paraît logique de considérer que des valeurs basses signent un risque de fracture augmentée [
24,
25], l’existence de valeurs normales nécessite un contrôle du rachis ou du col fémoral, en raison du risque de faux négatifs. En conclusion, les discordances des différentes mesures font déconseiller la prise de décision thérapeutique sur la seule base d’une mesure périphérique [
26]. Indications réglementaires de la densitométrie Le diagnostic de l’ostéoporose à la ménopause est l’indication la plus fréquente de la densitométrie. Néanmoins, une mesure systématique de BMD n’est pas justifiée, en particulier du fait de la mauvaise sensibilité des mesures. En l’absence de stratégies validées, on peut recommander la mesure par dual photon X ray absorptiometry (DXA) chez les sujets à risque d’ostéoporose. C’est la proposition de l’Agence Nationale d’Accréditation et d’Évaluation en Santé (ANAES) ( Tableau II). Cela s’applique bien aux femmes récemment ménopausées. Compte tenu du rôle majeur de l’âge dans le risque d’ostéoporose, il serait intéressant toutefois de vérifier la pertinence d’une telle proposition chez les femmes de plus de 65 ans.
 | Tableau II.
Indications des mesures de densité minérale osseuse par absorptiométrie biphotonique à rayons X selon l’ANAES (Agence nationale d’accréditation et d’évaluation en santé, service recommandations et références professionnelles, avril 2001).
|
À l’échelle individuelle, chez l’homme comme chez la femme, il peut être utile de disposer d’une mesure de densité osseuse afin d’évaluer l’effet de certaines maladies (endocrinopathies, tumeur maligne…) ou de certains traitements. Usage clinique des mesures L’utilisation clinique doit distinguer deux situations: dans un premier temps, le diagnostic de l’ostéoporose et l’évaluation du risque de fracture et, dans un deuxième temps, la surveillance du traitement par des mesures répétées. Diagnostic de l’ostéoporose et estimation du risque de fracture L’ostéoporose, définie comme étant une diminution de la densité osseuse, est souvent associée à des facteurs de risque, corticothérapie prolongée, intoxication tabagique, morphotype réduit, ménopause précoce… La pratique a toutefois montré qu’il était très difficile de prédire pour un individu donné la valeur de la densité osseuse. Celle-ci ne doit pas être estimée mais mesurée. L’évaluation du risque de fracture est une démarche différente [
27], qui repose essentiellement sur l’âge et le degré de l’ostéoporose mesurée en densitométrie, mais aussi sur les antécédents personnels et maternels de fracture et les risques de chute. Ces facteurs de risque doivent être adaptés à l’âge et au type de fracture dont le risque est estimé: l’antécédent maternel de fracture du col fémoral n’a pas la même valeur à 50 ou 75 ans. On voit que les facteurs de risque cliniques ont deux usages théoriques: ils permettent de sélectionner les femmes chez qui une mesure de BMD paraît utile et ils vont permettre de pondérer le résultat, pour mieux estimer le risque de fracture. On a vu la difficulté d’interprétation du seuil en densitométrie: une femme ayant un T score à -2,4 sera ostéopénique comme une autre femme ayant un T score à -1,1, mais le risque qu’elle ait une fracture peut être double. C’est la raison pour laquelle la densité osseuse doit être considérée comme un des éléments de réflexion du praticien, avec les autres facteurs de risque de fracture. Cette définition a cependant un grand intérêt « opérationnel » au rachis et à l’extrémité supérieure du fémur. Dans une population de femmes ménopausées sans fracture vertébrale (68 ans en moyenne), le nombre de sujets à traiter par un bisphosphonate pour prévenir la survenue d’une fracture vertébrale est de 35 si le T score est inférieur à -2,5, 59 si le T score est entre -2,5 et -2, et 363 si le T score est entre -2 et -1,6 [
28]. La mise en route d’un traitement prolongé anti-ostéoporotique sera décidée sur ces éléments, mais aussi sur les bénéfices attendus et les coûts de ce traitement. Il est donc possible de distinguer le seuil diagnostique et le seuil de décision thérapeutique. Ce point est d’ailleurs classique dans les maladies chroniques: un traitement antihypertenseur se décide sur le chiffre de la pression artérielle, mais aussi en fonction du sexe, des antécédents vasculaires personnels et familiaux, de la cholestérolémie, de l’intoxication tabagique… Surveillance thérapeutique L’évaluation densitométrique de la réponse osseuse à un traitement est possible, mais elle a des limites pratiques. Les traitements actuels, antiostéoclastiques (œstrogénothérapie, bisphosphonates, raloxifène), provoquent des augmentations de la densité osseuse de 1 à 6% seulement après 2 à 3 ans de traitement. En raison de la reproductibilité de la technique, un intervalle de deux ans doit être respecté lors des mesures au rachis lombaire chez les femmes jeunes. Chez les personnes plus âgées, les mesures densitométriques pratiquées à l’extrémité supérieure du fémur doivent être plus espacées encore. Au-delà des problèmes de reproductibilité et de sensibilité au changement, l’intérêt clinique de la répétition des mesures doit être discuté. La variation densitométrique mesure en effet un critère intermédiaire d’efficacité: il est difficile d’en déduire un bénéfice individuel de diminution du risque de fracture. L’effet « anti-fracture » des traitements anti-ostéoclastiques apparaît dès la première année, alors que le gain en densité osseuse n’est pas terminé. Il existe une discordance apparente entre l’augmentation de la densité (quelques %) et la réduction du risque de fracture (jusqu’à 50 %): la première explique 4 à 35 % seulement de la seconde [
29,
30]. Enfin, l’interprétation est compliquée par l’inévitable phénomène de régression vers la moyenne des valeurs individuelles extrêmes [
31]. Alors qu’une valeur basse de densité osseuse est un facteur de risque certain de fracture, une variation de densité sous traitement n’est pas liée de manière simple à la diminution du risque de fracture. Il est possible que les traitements ostéoformateurs (parathormone par exemple) fassent dans l’avenir modifier cette attitude. Sur le plan conceptuel, on peut penser que les traitements agissent aussi sur des paramètres qualitatifs: connexion des travées osseuses, arrêt de perforation des travées les plus minces, qui seront peut-être accessibles à des mesures qualitatives encore expérimentales [
32]. |
Les mesures de la densité osseuse sont des techniques fiables à condition de respecter un strict contrôle de qualité. Elles permettent de faire le diagnostic de l’ostéoporose et de classer les individus dans des groupes à risque de fracture. La recherche des sujets à risque, pouvant bénéficier de cette mesure, est légitime. L’intérêt de la densitométrie ne se conçoit que dans le cadre d’une évaluation multifactorielle du risque de fracture ostéoporotique. C’est cette estimation du risque qui permet la décision thérapeutique. La technique d’absorptiométrie biphotonique à rayons X va être inscrite à la nouvelle nomenclature, étape indispensable au remboursement très attendu de ces mesures. |
1. Kanis JA, Glüer CC, for the Committee of Scientific Advisors, International Osteoporosis Foundation. An update on the diagnosis and assessment of osteoporosis with densitometry. Osteoporosis Int 2000; 11: 192–202. 2. Grampp S, Lang PV, Jergas M, et al. Assessment of the skeletal status by peripheral quantitative computed tomography of the forearm: short term precision in vivo and comparison to dual Xray absorptiometry. J Bone Miner Res 1995; 10: 1566–76. 3. Glüer CC, Wu CY, Jergas M, Goldstein SA, Genant HK. Three quantitative ultrasound parameters reflect bone structure. Calcif Tissue Int 1994; 55: 46–52. 4. Chappard C, Laugier P, Fournier B, Roux C, Berger G. Assessment of the relationship between broadband ultrasound attenuation and bone mineral density at the calcaneum using BUA imaging and DXA. Osteoporosis Int 1997; 7: 316–22. 5. Roux C, Fournier B, Laugier P, et al. Broadband ultrasound attenuation imaging: a new imaging method in osteoporosis. J Bone Miner Res 1996; 11: 1112–8. 6. Lewis MK, Black GM, Fogelman I. Patient dose in dual X-ray absorptiometry. Osteoporosis Int 1994; 4:11–5. 7. Ho CHP, Kim RW, Schaffler MB, Sartoris DJ. Accuracy of dual-energy radiographic absorptiometry of the lumbar spine: a cadaver study. Radiology 1990; 176: 171–3. 8. Ravaud P, Reny JL, Giraudeau B, Porcher R, Dougados M, Roux C. Smallest detectable difference in individual bone mineral density measurements. J Bone Miner Res 1999; 14: 1449–56. 9. World Health Organization (WHO). Assessment of fracture risk and its application to screening for post menopausal osteoporosis: Report of a WHO study group. WHO Technical Report Series n° 843. Genève : OMS, 2000. 10. Ahmed AIH, Black GM, Rymer JM, Fogelman I. Screening for osteopenia and osteoporosis: do the accepted normal ranges lead to over diagnosis? Osteoporosis Int 1997; 7: 432–8. 11. Looker AC, Orwoll ES, Johnston CC, et al. Prevalence of low femoral bone density in older US adults from NHANES III. J Bone Miner Res 1997; 1761–8. 12. Chen Z, Maricic M, Lund P, Tesser J, Gluck O. How the new Hologic hip normal reference values affect the densitometric diagnosis of osteoporosis. Osteoporosis Int 1998; 8: 423–7. 13. Faulkner KG, Von Stetten E, Miller P. Discordance in patient classification using T-scores. J Clin Densit 1999 : 3 : 343–50. 14. Greenspan SL, Maitland- Ramsey L, Myers E. Classification of osteoporosis in the elderly is dependent on sitespecific analysis. Calcif Tissue Int 1996; 58: 409–14. 15. Lu Y, Genant HK, Shepherd J, et al. Classification of osteoporosis based on bone mineral densities. J Bone Miner Res 2001; 16: 901–10. 16. Kanis JA, Johnell O, Oden A, Dawson A, De Laet C, Jonsson B. Ten year probabilities of osteoporotic fractures according to BMD and diagnostic thresholds. Osteoporosis Int 2001; 12: 989–95. 17. Moro M, Hecker AT, Bouxsein ML, Myers ER. Failure load of thoracic vertebrae correlates with lumbar bone mineral density measured by DXA. Calcif Tissue Int 1995; 56: 206–9. 18. Majumdar S, Genant HK. A review of the recent advances in magnetic resonance imaging in the assessment of osteoporosis. Osteoporosis Int 1995; 5: 79–92. 19. Cummings SR, Black DM, Nevitt MC, Browner WS, Cauley JA, Ensrud K, and the Study of Osteoporotic Fractures Research Group. Bone density at various sites for prediction of hip fractures. Lancet 1993; 341: 72–5. 20. Nevitt MC, Johnell O, Black DM, Ensrud K, Genant HK, Cummings SR, for the Study of Osteoporotic Fractures Research Group. Bone mineral density predicts non-spine fractures in very elderly women. Osteoporosis Int 1994; 4: 325–31. 21. Kröger H, Huopio J, Honkanen R, et al. Prediction of fracture risk using axial bone mineral density in a perimenopausal population: a prospective study. J Bone Miner Res 1995; 10: 302–6. 22. Torgerson DJ, Campbell MK, Thomas RE, Reid DM. Prediction of perimenopausal fractures by bone mineral density and other risk factors. J Bone Miner Res 1996; 11: 293–7. 23. Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of occurrence of osteoporotic fractures. Br Med J 1996; 312: 1254–9. 24. Black DM, Cummings SR, Melton LJ III. Appendicular bone mineral and a woman’s lifetime risk of hip fracture. J Bone Miner Res 1992; 7: 639–45. 25. Hans D, Dargent-Molina P, Schott AM, et al. Ultrasonographic heel measurements to predict hip fracture in elderly women: the EPIDOS prospective study. Lancet 1996; 348: 511–4. 26. Ayers M, Prince M, Ahmadi S, Baran DT. Reconciling quantitative ultrasound of the calcaneus with X-ray based measurements of the central skeleton. J Bone Miner Res 2000; 15: 1850–5. 27. Cummings SR, Nevitt MC, Browner WS, et al. for the Study of Osteoporotic Fractures Reseach Group. Risk factors for hip fracture in white women. N Engl J Med 1995; 332: 767–73. 28. Cummings SR, Black DM, Thompson DE, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures. JAMA 1998; 280: 2077–82. 29. Sarkar S, Mitlak BH, Wong M, Stock JL, Black DM, Harper KD. Relationships between bone mineral density and incident vertebral fracture risk with raloxifene therapy. J Bone Miner Res 2002; 17 : 1–10. 30. Li Z, Meredith MP, Hoseyni MS. A method to assess the proportion of treatment effect explained by a surrogate end point. Stat Med 2001; 20: 3175–88. 31. Cummings SR, Palermo L, Browner W, et al. Monitoring osteoporosis therapy with bone densitometry: misleading changes and regression to the mean. JAMA 2000; 283: 1318–21. 32. Muller R, Hildebrand T, Hauselman HJ, Ruegsegger P. In vivo reproducibility of threedimensional structural properties of non invasive bone biopsies using 3DpQCT. J Bone Miner Res 1996; 11: 1745–50. |