| |
| Med Sci (Paris). 2003 April; 19(4): 453–458. Published online 2003 April 15. doi: 10.1051/medsci/2003194453.Asymétries de parenté et conflits d’intérêt génétique chez les fourmis Luc Passera1* and Serge Aron2 1Centre de recherches sur la Cognition Animale, Cnrs - Université Paul-Sabatier, 118, route de Narbonne, 31062 Toulouse Cedex 4, France 2Unité des Communautés Animales, Université Libre de Bruxelles, 1050 Bruxelles, Belgique |
L’apparition de la vie sociale au détriment de la vie solitaire au sein de colonies plus ou moins complexes est l’une des transitions majeures de l’évolution, au même titre que l’apparition du code génétique, d’un noyau bien délimité lors du passage des procaryotes aux eucaryotes ou que la substitution de la reproduction sexuée à la reproduction asexuée [
1]. La vie sociale est apparue à de nombreuses reprises au cours de l’évolution et toujours de manière indépendante. Connue essentiellement chez les insectes, les vertébrés non humains (en particulier les primates), et bien sûr chez l’homme, on l’a découverte récemment chez les microorganismes [
2]. Le caractère commun à tous ces organismes est l’existence d’une coopération qui peut prendre diverses formes, mais qui implique toujours que des individus ou des cellules s’engagent dans une tâche commune pour en tirer un bénéfice mutuel [
3]. Par exemple, les biofilms microbiens élaborés par de nombreuses bactéries et trouvés dans une variété d’habitats ont le même rôle protecteur que les nids construits par les termites ou les fourmis. La coopération prend souvent une dimension altruiste quand elle est marquée par l’existence d’unités - cellules ou individus - se sacrifiant pour le bien commun des autres membres de la colonie. Les cellules d’Escherichia coli, qui s’autodétruisent en élaborant des toxines (colicines) dirigées contre des micro-organismes menaçants, peuvent se comparer aux individus guetteurs chez l’écureuil à terrier que leurs cris d’alarme désignent à l’appétit d’un prédateur ou encore à ces abeilles ouvrières dont la mutilation volontaire (autotomie) de l’aiguillon planté dans la peau d’un maraudeur équivaut à un « suicide » certain. Bien sûr, la notion d’altruisme telle qu’elle est utilisée par les biologistes du phénomène social fait référence aux effets positifs que procure un acteur sur la reproduction d’un bénéficiaire. Ce terme n’a aucune connotation morale. Si la vie sociale est marquée par la coopération et l’altruisme, elle est aussi marquée par les conflits: la lutte pour le pouvoir est bien connue chez les vertébrés. Des poules à l’homme en passant par les bovins et les primates, les occasions de conflits ne manquent pas, qui par les intimidations, menaces et agressions physiques déterminent le rang hiérarchique de chacun. On pourrait penser que les sociétés d’insectes échappent à ce travers. La sagesse populaire voit souvent dans la ruche ou la fourmilière un havre de coopération et de paix. Il est vrai que la coopération telle qu’on la rencontre chez les hyménoptères sociaux (abeilles, bourdons, guêpes et fourmis) prend un aspect particulier, l’existence d’individus spécialisés dans la reproduction aboutissant à une division du travail. On distingue alors des individus morphologiquement et physiologiquement différenciés en castes. Les reines sont des femelles de grande taille qui monopolisent la reproduction. Les ouvrières, elles aussi de sexe femelle, sont plus ou moins stériles, ne s’accouplent pas et consacrent leur énergie à élever leurs soeurs et leurs frères. Cette harmonie est trompeuse et cache des conflits multiples entre reines et ouvrières ou entre ouvrières. |
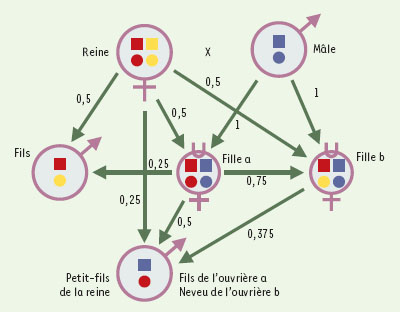
La sélection de parentèle L’origine de ces comportements altruistes est à rechercher dans une singularité des hyménoptères: les mâles se développent à partir d’oeufs vierges, phénomène appelé la parthénogenèse arrhénotoque. Ils sont haploïdes, alors que les femelles - reines comme ouvrières - sont issues d’oeufs fécondés et sont diploïdes. Cette détermination du sexe est dite haplodiploïde et a des conséquences génétiques importantes. Les mâles, étant haploïdes, ne subissent pas de réduction chromosomique pour fabriquer des spermatozoïdes à n chromosomes. En d’autres termes, l’absence de méiose implique que tous les spermatozoïdes d’un même mâle sont génétiquement identiques. Considérons un couple d’hyménoptères (reine et mâle) et leur descendance (Figure 1) : la reine possède 2n chromosomes; le mâle, haploïde, ne possède que n chromosomes. Lors de la méiose, la probabilité que deux filles héritent de leur mère les mêmes chromosomes varie de 0% (si les deux ovules dont elles sont issues portent des chromosomes différents) à 100 % (si les deux ovules dont elles sont issues portent les mêmes chromosomes); en moyenne, les filles ont donc 50 % de chance d’hériter des mêmes chromosomes maternels. Comme la part maternelle ne représente que la moitié du génome des filles (l’autre moitié étant héritée du père), en moyenne les filles du couple auront donc en commun 25 % des chromosomes de la mère. À cela, il faut ajouter la contribution paternelle. Tous les spermatozoïdes étant semblables, les filles héritent de l’intégralité du stock génétique du père, de telle sorte que 50 % de leur génome est identique. Par conséquent, les filles auront entre elles un coefficient de parenté moyen r de 0,75 (0,5 issu du père + 0,25 issu de la mère), alors que ce même coefficient de parenté sera de 0,5 entre une mère et ses filles ou ses fils. De même, la corrélation génétique r entre frères et soeurs sera de 0,25 et celle entre une ouvrière-fille et son neveu (fils issu de la ponte d’une soeur) sera de 0,375. Les liens de parenté génétique observés chez les animaux haplodiploïdes apparaissent donc très différents de ce qu’ils sont chez les organismes diploïdes.
 | Figure 1.
Asymétries génétiques associées à l’haplodiploïdie. Coefficients de corrélation génétique entre les parents et leurs descendants. On a choisi 2n = 4. On remarquera que les ouvrières-filles (cercle surmonté d’un u) sont plus proches de leurs soeurs (r = 0,75) que de leurs frères (r = 0,25). En revanche, la reine-mère présente le même coefficient de parenté (r = 0,50) avec ses fils et ses filles. |
Ces asymétries génétiques entre les individus au sein d’une même société ont des répercussions importantes sur le comportement des individus. Elles ont conduit Hamilton à proposer le concept de sélection de la parentèle, qui a révolutionné la compréhension de l’évolution sociale [
4]. Les ouvrières ont plus de gènes en commun avec leurs soeurs qu’elles n’en auraient avec des filles éventuelles. Dans cette situation, le succès reproductif indirect des ouvrières qui élèvent leurs soeurs est supérieur au succès reproductif direct qu’elles auraient en ayant elles-mêmes des filles ou des fils. L’altruisme de reproduction manifesté par les ouvrières est justifié du point de vue génétique puisqu’il leur permet d’optimiser leur propre succès reproductif global (inclusive fitness). C’est une excellente justification à leur stérilité. |
La lutte feutrée entre reine et ouvrières Par l’observation attentive des asymétries génétiques au sein d’une même société, Trivers et Hare [
5] ont remarqué qu’elles devraient entraîner des conflits d’intérêts entre mère et fille au sujet de la reproduction. Un des conflits majeurs concerne l’investissement énergétique que chaque caste doit consentir dans l’élevage des descendants repro-ducteurs. La reine, qui présente une parenté génétique identique avec ses filles et ses fils (r = 50 %), est sélectionnée au cours de l’évolution pour favoriser un investissement équivalent dans les deux sexes de la descendance. Le point de vue des ouvrières est différent: elles partagent 75 % de leurs gènes avec leurs soeurs, futures reines, contre seulement 25 % avec leurs frères, les futurs mâles. Leur intérêt est donc de consacrer trois fois plus d’énergie à élever des sexués femelles que des mâles. Quelles sont les armes des deux castes ? Les reines ont la maîtrise du sexe des oeufs qu’elles pondent: elles peuvent donc biaiser le sex-ratio primaire, c’est-à-dire la proportion de chaque sexe parmi les oeufs pondus, pour privilégier leurs intérêts. Les ouvrières, qui ont en charge l’élevage des larves, peuvent favoriser l’élevage de nouvelles reines à partir du pool de larves femelles et/ou éliminer des larves mâles en négligeant leur élevage ou en les dévorant. Elles parviennent ainsi à obtenir le sex-ratio secondaire (proportion de chaque sexe au sein des adultes sexués) conforme à leurs intérêts. Quel sera le résultat de ce bras de fer ? Si c’est le contrôle royal qui est le plus fort, on doit s’attendre à ce que l’investissement énergétique dans les deux sexes soit équilibré. Si ce sont les ouvrières qui imposent leur point de vue, le sex-ratio final sera biaisé en faveur des femelles. Ces prédictions doivent être évaluées sur de larges populations car, en fonction des ressources alimentaires par exemple, il n’est pas exclu d’observer de fortes variations du sex-ratio entre colonies d’une même population. |
Les ouvrières ont (le plus souvent) le dernier mot! Les ouvrières ayant en quelque sorte le dernier mot, il semble bien que ce soit le plus souvent cette caste qui contrôle la valeur du sex-ratio, comme le montrent divers travaux expérimentaux. Par exemple, la proportion d’énergie investie dans le sexe femelle chez Colobopsis nipponicus est exactement de 0,75 [
6] et de 0,747 chez Leptothorax tuberum [
7]. Ces résultats sont confirmés par les observations faites sur la fourmi des bois nordique, Formica truncorum [
8,
9]. Cette espèce présente la particularité d’être parfois polygyne, c’est-à-dire de réunir plusieurs reines pondeuses non apparentées dans la même société. Dans cette situation, les ouvrières appartiennent à plusieurs lignées matriarcales qui, si elles restent fortement apparentées à l’intérieur d’une même lignée, n’ont plus grandchose en commun d’une lignée à l’autre. La polygynie diminue donc l’intérêt génétique que manifestent les ouvrières pour les larves royales qu’elles élèvent. Il apparaît en effet que, dans les îles finlandaises peuplées par la forme monogyne, l’élevage de sexués femelles est clairement favorisé avec un sex-ratio de 0,70 en faveur des reines, alors qu’il est inversé dans les îles peuplées par la forme polygyne, avec un sex-ratio de 0,16. Cette même espèce a aussi la particularité de présenter des populations monogynes au sein desquelles les reines sont accouplées avec un seul mâle (situation qualifiée de monandre), et d’autres accouplées avec deux ou trois mâles (situation polyandre). En situation de polyandrie, les ouvrières ne sont plus que des demisoeurs appartenant à autant de lignées patriarcales qu’il y a eu de pères différents. Si la corrélation génétique moyenne entre deux vraies soeurs est de 0,75, elle tombe à 0,50 lorsque la reine est fécondée par deux mâles différents. En revanche, la parenté génétique entre les ouvrières et leurs frères reste fixée à 0,25 quel que soit le degré de polyandrie puisque tous les frères sont les fils parthénogénétiques de la même reine (les mâles n’ont pas de père). Effectivement, les nids à reine monandre des forêts finlandaises favorisent fortement l’élevage des sexués femelles et le sex-ratio moyen y est de 2,9 femelles sexuées pour un mâle, alors que dans les nids polyandres, il n’y a plus que 1,7 femelles sexuées pour un mâle. Ces résultats indiquent que ce sont principalement les ouvrières qui contrôlent la proportion finale des individus sexués. Le contrôle des ouvrières passe au moins en partie par l’élimination des formes larvaires mâles dans les situations où l’élevage des sexués femelles améliore le succès reproductif des ouvrières. On a pu le vérifier en comparant la valeur du sex-ratio primaire (proportion d’œufs haploïdes, mâles, parmi tous les oeufs) à la valeur du sex-ratio secondaire (proportion des mâles parmi tous les adultes). Le sexe de l’oeuf est déterminé soit en comptant les chromosomes par la méthode des squashs, soit en utilisant des marqueurs microsatellites. Les valeurs du sex-ratio secondaire sont plus faibles que celles du sex-ratio primaire chez des espèces aussi variées que la fourmi d’Argentine Linepithema humile, une espèce invasive du Midi méditerranéen [
10] ou l’espèce méridionale Pheidole pallidula [
11]. Les résultats obtenus chez la fourmi des bois Formica exsecta sont encore plus éloquents: la valeur du sex-ratio secondaire fléchit dans les sociétés monandres et reste stable dans les sociétés polyandres, en accord avec les intérêts génétiques des ouvrières [
12]. Bien que l’on ignore encore comment les ouvrières identifient les formes mâles, il semble que ce soient les larves et non les oeufs qui sont cannibalisés [
13] (Figure 2),
 | Figure 2.
Un conflit résolu par cannibalisme. Afin d’optimiser leur succès reproductif global, les ouvrières de la fourmi d’Argentine Linepithema humile sont amenées à réduire le nombre élevé de mâles. Pour cela, elles cannibalisent les larves mâles. Le cliché représente cinq larves mâles dont deux ont été attaquées par des ouvrières (cliché L. Passera). |
Toutefois, certaines études indiquent que les ouvrières ne parviennent pas toujours à imposer leur point de vue. C’est particulièrement vrai chez des espèces caractérisées par une forte spécialisation sexuelle des sociétés: certaines sociétés élèvent quasi exclusivement des sexués femelles alors que d’autres se spécialisent dans l’élevage des mâles. C’est le cas de Pheidole desertorum, espèce où les sociétés sont toujours monogynes et la reine n’est fécondée qu’une seule fois. Bien qu’aucun élément génétique n’explique cette spécialisation, une étude de la population de cette espèce révèle qu’exactement la moitié des nids produit des mâles et l’autre moitié des femelles. Au total, l’investissement énergétique en femelles est égal à 0,505, ce qui est exactement l’investissement souhaité par la reine, alors que la structure génétique plaiderait pour un investissement femelle de 0,75 [
14]. Une autre fourmi à reproduction bimodale, la fourmi de feu américaine Solenopsis invicta (→) (Figure 3), présente des caractéristiques qui suggèrent que ni la reine, ni les ouvrières ne parviennent à contrôler totalement le sex-ratio [
15]. En effet, avec un investissement en femelles de 0,607 à l’échelle de la population, on est à mi-chemin entre le contrôle « royal » (investissement optimal en femelles de 0,50) et le contrôle par les ouvrières (investissement optimal en femelles de 0,75). Une particularité biologique rare de cette espèce a permis de mesurer le rôle joué par la reine. Il est en effet possible, chez la fourmi de feu, de faire accepter une reine étrangère à une société dont la reine a été éliminée, alors qu’habituellement une telle opération se traduit par un massacre de l’intruse. On a donc procédé à l’échange de la reine entre des sociétés produisant des sexués mâles et des sociétés produisant des sexués femelles [
16]. Cinq à six semaines après l’introduction de la nouvelle reine, on a totalement inversé le genre du sexe des reproducteurs élevés (Figure 4), Les colonies qui élevaient en grande majorité des sexués femelles élèvent désormais des sexués mâles et, à l’inverse, les sociétés qui élevaient des reproducteurs mâles élèvent à présent des reproducteurs femelles. C’est bien la reine qui est responsable de ce basculement puisqu’en échangeant les reines entre sociétés élevant le même sexe, le sexe femelle par exemple, on continue à obtenir des sexués femelles. Une preuve supplémentaire est fournie par une étude du sexe des oeufs, rendue possible par l’existence de marqueurs microsatellites [16]. Dans les colonies productrices de mâles, on trouve plus de 50 % d’oeufs haploïdes pondus alors qu’ils sont pratiquement inexistants dans les colonies n’élevant que des sexués femelles. Ainsi, en changeant la proportion d’oeufs mâles pondus, les reines parviennent à contrôler, au moins en partie, le sexe des reproducteurs élevés par les ouvrières. Il est clair que dans une société où il n’y a que peu d’oeufs haploïdes, les ouvrières n’ont d’autre choix que d’élever des reines et des ouvrières. Leur marge de manoeuvre est plus large dans les sociétés où les reines pondent beaucoup d’oeufs mâles. Les ouvrières peuvent en supprimer quelques-uns, ce qu’elles font effectivement [
17], mais sans toutefois changer l’option choisie par la reine. Finalement, la lutte feutrée que se livrent les ouvrières et les reines pour contrôler le sexe de la descendance afin de favoriser leurs propres intérêts génétiques aboutit à des résultats assez complexes, car le résultat prend sans doute en compte des facteurs écologiques et des traits de vie encore mal connus. (→) m/s 2000, n° 10, p. 1141
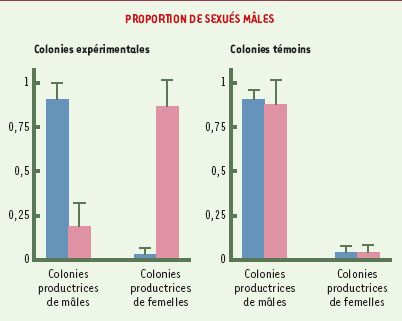
 | Figure 3.
La reine de la fourmi de feu. Chez Solenopsis invicta, c’est la reine qui détermine la valeur du sex-ratio en pondant un nombre plus ou moins grand d’oeufs haploïdes (mâles) (cliché K.G. Ross). |
 | Figure 4.
Le contrôle royal du sex-ratio chez la fourmi de feu. Les histogrammes représentent la proportion de sexués mâles obtenus dans les sociétés spécialisées dans l’élevage des mâles ou dans l’élevage des femelles. Les barres bleues représentent la proportion des mâles avant l’échange de reines et les barres roses après l’échange. Dans les colonies expérimentales (histogramme de gauche) les reines ont été échangées entre colonies produisant initialement des sexes différents. Cela se traduit par une inversion de la proportion de mâles obtenus. Dans les colonies témoins (histogramme de droite), les reines ont été échangées entre colonies produisant initialement des individus de même sexe. La proportion de mâles obtenus est alors inchangée. C’est bien la reine qui détermine la valeur du sex-ratio, |
|
Devenir calife à la place du calife Certaines espèces de fourmis, appartenant à la sousfamille primitive des Ponerinae, ne possèdent pas de reines morphologiquement différenciées. Il s’agit d’un phénomène secondaire, la caste royale ayant été perdue au cours de l’évolution. À l’inverse de la plupart des ouvrières des autres sous-familles, celles des Ponerinae ont conservé un organe appelé spermathèque, dans lequel le sperme du mâle est accumulé et stocké, ce qui leur permet de pondre des oeufs fécondés et donc de remplacer fonctionnellement la reine. Pour marquer leur morphologie ouvrière, elles sont appelées des gamergates [
18]. Toutes les ouvrières sont des gamergates potentielles et si elles ne parviennent pas à acquérir ce statut, elles ont au moins la possibilité d’émettre des oeufs vierges qui produiront des mâles. Cette situation est à l’origine de divers conflits: certains opposent la gamergate à des ouvrières qui veulent la supplanter; d’autres opposent les ouvrières entre elles pour remplacer la gamergate après sa mort. L’exemple de Dinoponera quadriceps est démonstratif de ces luttes intestines. La reproduction est réglée par l’existence d’une hiérarchie de dominance, la gamergate occupant le rang α. Au rang hiérarchique inférieur, on trouve quatre à six ouvrières vierges qui sont habituellement les filles de la gamergate, Ces ouvrières sont pondeuses d’oeufs vierges qui peuvent donc se développer en individus mâles et leur production ovarienne est corrélée à leur rang hiérarchique. Ces individus, qui sont des soeurs, sont engagés dans d’intenses interactions antagonistes pour l’accession à un rang hiérarchique supérieur (interactions agonistiques). Les ouvrières mal classées s’en prennent fréquemment aux ouvrières de rang supérieur, les immobilisant en saisissant leurs pattes et leurs antennes [
19]. L’affaire est d’importance car le rang obtenu dans la hiérarchie est fortement prédictif de la potentialité à devenir la future gamergate, Quand la gamergate en titre meurt, elle est remplacée par l’une des trois ouvrières les mieux placées dans la hiérarchie. La nouvelle promue quitte brièvement son nid pendant la nuit, émet une phéromone sexuelle attractive et s’accouple avec un mâle attiré par son odeur. Désormais, elle est apte à pondre des oeufs diploïdes producteurs d’individus femelles. La gamergate doit lutter en permanence pour ne pas perdre son rang de première pondeuse convoité d’abord par l’individu β. Elle s’impose physiquement au moyen de différents comportements. Outre les flagellations antennaires, elle « bloque » la circulation des concurrentes en les maintenant dans l’intervalle dessiné par les funicules de ses antennes largement ouvertes. Mais surtout, la gamergate utilise un comportement tout à fait inédit (Figure 5), Elle saisit entre ses mandibules une antenne d’une dominée récalcitrante placée en deuxième ou troisième position hiérarchique, ramène vers l’avant son abdomen entre ses pattes, exposant du même coup des glandes abdominales contre lesquelles elle frotte l’antenne de l’ouvrière subordonnée. Ce comportement est destiné à transmettre un signal chimique dont le 9-hentriacontène est un composant essentiel [
20]. La proportion de cette substance est corrélée positivement au statut reproducteur de l’individu et à sa position hiérarchique. Il suffit d’ailleurs d’éliminer l’individu α pour voir, au fil des jours, la concentration en 9-hentriacontène augmenter chez l’individu β.
 | Figure 5.
Conflits entre la gamergate et une ouvrière subordonnée chez Dinoponera quadriceps. Chez ces fourmis sans reine, toutes les ouvrières possèdent une spermathèque et peuvent donc s’accoupler pour devenir l’individu reproducteur (gamergate). Quatre à six ouvrières qui prétendent remplacer la gamergate s’organisent selon une chaîne hiérarchique comportementale. Pour informer les prétendantes à sa succession que son état ovarien ne nécessite pas son remplacement, la gamergate, ici à gauche, expose des glandes ventrales par repliement de son abdomen, saisit entre ses mandibules l’antenne d’une prétendante et la frotte contre les membranes intersegmentaires de son abdomen. Ce faisant, elle transfère une phéromone indicative de son statut social (cliché T. Monnin). |
Les ouvrières qui occupent un rang élevé dans la hiérarchie sont de jeunes ouvrières et elles n’occupent cette situation privilégiée que peu de temps, du fait de l’entrée continuelle de nouveaux individus dans la chaîne hiérarchique. L’individu β doit donc se hâter de supplanter la gamergate, sa position d’outsider é tant très temporaire [
21]. Toutefois, la construction d’un modèle génétique permet de montrer que la prise de pouvoir par β n’est favorable à l’ensemble de la population que si α est resté suffisamment longtemps en place pour avoir produit au moins une moitié des ouvrières de la société partageant le même génotype que l’individu β et ses soeurs. C’est pourquoi, tant que la gamergate est jeune, les ouvrières de la chaîne hiérarchique s’opposent par la force à β en l’immobilisant. Cette « police ouvrière » fait perdre à β son statut dominateur et donc toute chance de remplacer la gamergate [19, 21]. L’ouvrière β lutte pour échapper à cette immobilisation car son intérêt génétique à supplanter la gamergate est évident: après fécondation, elle est en effet mieux apparentée à ses propres descendants mâles et femelles (r = 0,5) qu’aux descendants mâles de ses soeurs restées vierges (r = 0,375) (Figure 1), Un élément clé dans le combat qui oppose l’individu β aux autres ouvrières de la chaîne hiérarchique est l’âge de la gamergate, Encore faut-il que les ouvrières soient en mesure de l’estimer. C’est sans doute un autre rôle attribué au 9-hentriacontène dont on a déjà dit plus haut que sa production était corrélée au statut reproducteur. En frottant l’antenne des ouvrières de la chaîne hiérarchique contre son abdomen, la gamergate les informe « honnêtement » de son âge. Cette phéromone permet aux ouvrières de connaître l’âge de la gamergate et donc de déterminer si son remplacement devient avantageux. En bref, plusieurs paramètres biologiques comme le nombre de reines, le nombre d’accouplements, l’existence d’ouvrières fécondables (gamergates), conduisent à des variations dans les degrés de parenté qui unissent les individus des fourmilières. Ces variations influent fortement sur leurs intérêts génétiques et conduisent à des conflits quant à l’élevage des individus sexués. À ces paramètres biologiques, il faut ajouter des facteurs écologiques (importance des ressources alimentaires) ou des interactions lors de la dispersion des sexués non abordés ici et qui contribuent également à l’allocation des sexes. |
1. Szathmary E, Maynard Smith J. The major evolutionary transitions. Nature 1995; 374: 227–31. 2. Crespi BJ. The evolution of social behavior in microorganisms. TREE 2001; 16: 178–83. 3. Aron S, Passera L. Les sociétés animales. Évolution de la coopération et organisation sociale, Bruxelles: DeBoeck Université, 2000 : 366 p. 4. Hamilton WD. The genetical evolution of social behavior. I and II. J Theor Biol 1964; 7:1–52. 5. Trivers RL, Hare H. Haplodiploidy and the evolution of the social insects. Science 1976; 191: 249–63. 6. Hasegawa E. Sex allocation in the ant Colobopsis nipponicus (Wheeler).1. Population sex ratio. Evolution 1994; 48: 1121–9. 7. Pearson B, Raybould AF, Clarke RT. Breeding behaviour, relatedness and sex-investment ratios in Leptothorax tuberum Fabricius. Entomol Exp Appl 1995; 75: 165–74. 8. Sundström L. Sex ratio bias, relatedness asymmetry and queen mating frequencies. Nature 1994; 367: 266–7. 9. Sundström L. Sex allocation and colony maintenance in monogyne and polygyne colonies of Formica truncorum (Hymenoptera: Formicidae): the impact of kinship and mating structure. Am Nat 1995; 146: 182–201. 10. Aron S, Passera L, Keller L. Queen-worker conflict over sex ratio: a comparison of primary and secondary sex ratios in the argentine ant, Iridomyrmex humilis, J Evol Biol 1994; 7: 403–8. 11. Keller L, Aron S, Passera L. Internest sex-ratio variation and male brood survival in the ant Pheidole pallidula, Behav Ecol 1996; 7: 292–8. 12. Sundström L, Chapuisat M, Keller L. Conditional manipulation of sex ratios by ant workers: a test of kin selection theory. Science 1996; 274: 993–5. 13. Passera L, Aron S. Early sex discrimination and male brood elimination by workers of the Argentine ant. Proc R Soc Lond B 1996; 263: 1041–6. 14. Helms KR. Colony sex ratios, conflict between queens and workers, and apparent queen control in the ant Pheidole desertorum, Evolution 1999; 53: 1470–8. 15. Vargo EL. Sex investment ratios in monogyne and polygyne populations of the fire ant Solenopsis invicta, J Evol Biol 1996; 9: 783–802. 16. Passera L, Aron S, Vargo E, Keller L. Queen control of sex ratio in fire ants. Science 2001; 293: 1308–10. 17. Aron S, Vargo EL, Passera L. Primary and secondary sex ratios in monogyne colonies of the fire ant. Anim Behav 1995; 49: 749–57. 18. Peeters C, Crewe R. Insemination controls the reproductive division of labour in a ponerine ant. Naturwissenschaften 1984; 71: 50–1. 19. Monnin T, Peeters C. Dominance hierarchy and reproductive conflicts among subordinates in a monogynous queenless ant. Behav Ecol 1999; 10: 323–32. 20. Peeters C, Monnin T, Malosse C. Cuticular hydrocarbons correlated with reproductive status in a queenless ant. Proc R Soc Lond B 1999; 266: 1323–27. 21. Monnin T, Ratnieks FLW. Policing in queenless ponerine ants. Behav Ecol Sociobiol 2001; 50: 97–108. |