Les filovirus Ebola et Marburg qui sévissent en Afrique tropicale sont responsables de fièvres hémorragiques contre lesquelles il n’existe ni vaccin, ni traitement efficace. La pathogénie de ces virus est encore peu connue car leur étude ne peut se faire que dans des laboratoires de haute sécurité P4, peu nombreux dans le monde, et le nombre de patients est peu élevé. Les études réalisées à partir de biopsies tissulaires chez les patients [1], ou de singes et de rongeurs infectés expérimentalement [2, 3], et de différentes lignées cellulaires [4–7], indiquent que les filovirus sont pléïotropes et infectent de nombreux tissus. Ces virus pénètrent sans doute dans l’organisme par la peau et les muqueuses où ils infectent les cellules dendritiques et les macrophages. L’ antigène viral est également détecté dans les cellules du parenchyme hépatique, pulmonaire, thymique, pancréatique, et dans celles du tractus gastrointestinal et urinaire, ainsi que dans les cellules fibroblastiques et de l’endothélium vasculaire. En revanche, les cellules T ne sont pas permissives pour le virus [5].
Les filovirus sont des virus enveloppés à ARN de sens négatif monocaténaire et possèdent à leur surface deux glycoprotéines GP1 et GP2 [4]. L’utilisation récente de pseudo-virus, possédant une enveloppe similaire à celle des virus Marburg et Ebola natifs et dont la pénétration cellulaire est identifiée par l’expression de gènes rapporteurs, a montré qu’en dépit de similitudes dans leur séquence génomique, leur tropisme et leur pathogénie, les virus Marburg et Ebola se distinguaient par leur mode de pénétration dans les cellules cibles [5, 7–9]. Le seul récepteur cellulaire connu pour le virus Marburg est le récepteur de l’asialoglycoprotéine [10]. Cependant, ce récepteur n’est pas présent sur toutes les cellules permissives aux virus Marburg et Ebola, suggérant l’existence d’un autre récepteur, commun aux deux virus Marburg et Ebola.
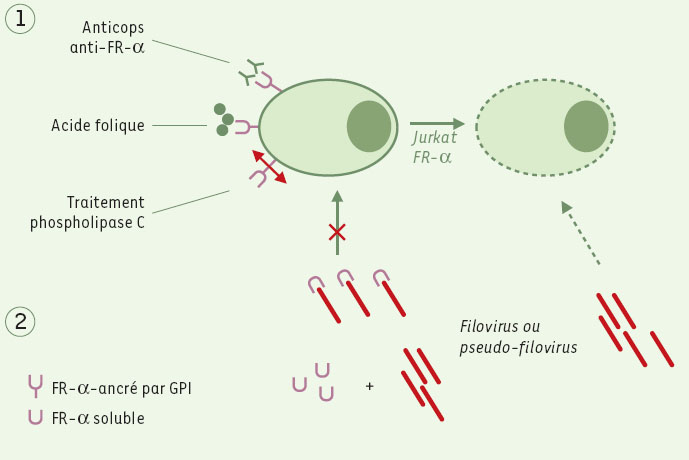
C’est ce récepteur que l’équipe de Chan et al.a cherché à identifier. La stratégie est celle d’un clonage par expression : deux lignées cellulaires humaines, l’une permissive (cellules Hela) et l’autre non permissive (cellules T Jurkat) aux infections par ces virus ont été utilisées. Les cellules Jurkat ont été transduites avec une librairie de gènes dérivés de cellules Hela, par l’intermédiaire de vecteurs rétroviraux. Les cellules Jurkat ont été infectées avec des pseudo-virus Marburg et Ebola contenant un gène de résistance à la blasticidine, ce qui a permis de sélectionner les seules cellules devenues permissives à l’infection virale. Le seul gène dérivé des cellules Hela qui conférait aux cellules Jurkat une sensibilité à l’infection contenait la séquence codant pour un peptide signal et au moins une fraction du gène du récepteur-α du folate (FR-α). FR-α fixe l’acide folique à la surface des cellules et favorise son internalisation. La protéine a un poids moléculaire de 38-39 kDa et contient un résidu glycosyl-phosphatidylinositol (GPI)sensible à la phospholipase C. De plus, des cellules exprimant FR-α mises en présence de cellules exprimant les glyco-protéines GP1 et GP2 des virus Marburg et Ebola, forment à pH acide des synci-tiums, suggérant que ce récepteur est important pour l’activité fusogénique de la GP des filovirus. La diminution de l’infection des cellules après dénaturation des GPI ou après traitement par des molécules antagonistes du FR-α confirmaient que ce récepteur facilitait l’entrée dans la cellule des virus Marburg et Ebola et de leurs pseudotypes (Figure 1).
| Figure 1. Stratégies d’inhibition de l’entrée des filovirus dans les cellules cibles. Deux stratégies sont envisageables. (1) Neutralisation des récepteurs FR-α, soit par des anticorps, soit en les saturant par des folates, ou encore en clivant la queue GPI du récepteur par la phospholipase C. (2) On peut aussi agir sur les filovirus en saturant leurs sites d’ancrage sur les cellules cibles par une forme soluble du récepteur FR-α. |
FR-α est donc un co-facteur exprimé à la surface de la plupart des cellules cibles des deux espèces de filovirus et facilite leur entrée dans ces cellules. Si ce récepteur semble jouer un rôle important dans la propagation des virus Marburg et Ebola dans l’organisme, il n’est sans doute pas unique. D’une part, la pénétration virale peut se faire selon un procédé différent pour les virus Ebola et Marburg puisque le blocage de la N-glycosylation des protéines des cellules cibles réduit l’entrée du virus Ebola et non pas celle du virus Marburg [5, 8]. D’autre part, FR-α n’est pas exprimé sur toutes les cellules permissives aux filovirus, suggérant qu’il existe au moins un autre facteur pour assurer leur entrée. On sait que d’autres virus, dont le VIH, utilisent plusieurs récepteurs cellulaires [11]. Une critique que l’on peut émettre à l’encontre de l’étude de Chan et al. est la faible permissivité des clones de cellules Jurkat exprimant FR-α. Celle-ci s’explique sans doute par d’autres facteurs impliqués dans les processus d’endocytose, notamment la formation des cavéoles d’endocytes [12]. D’autres études seront nécessaires pour reconstituer les étapes d’endocytose et caractériser de façon plus complète le mode de pénétration cellulaire des filovirus. Il est possible que la concentration de la molécule FR-α à la surface des cellules joue un rôle dans le tropisme viral tissulaire. Enfin, cette étude a été réalisée avec le sous-type Zaïre du virus Ebola et il serait intéressant de comparer la fixation au FR-α des différents sous-types de virus Ebola, Soudan, Zaïre, Côte d’Ivoire et Reston. Leur affinité différente pour le récepteur pourrait également moduler le tropisme viral et expliquer la pathogénie différente qui caractérise les infections par ces différents sous-types. Même si FR-α n’est pas l’unique récepteur relayant la pénétration des filovirus, son identification laisse entrevoir une possible voie thérapeutique qui ciblerait les premières étapes de l’infection. L’inhibition de l’entrée du virus par des molécules neutralisant le site de fixation de FR-α, acide folique ou anticorps anti-FR-α, ou par la saturation des glycoprotéines virales par FR-α soluble, sont des approches prometteuses.
L’identification des sites de fixation de la glycoprotéine au FR-α sur l’une ou l’autre molécule, pourrait également offrir une approche peptidique pour bloquer la fixation des filovirus à certaines cellules cibles et ainsi prévenir ou traiter la maladie.