| |
| Med Sci (Paris). 2002 January; 18(1): 55–61. Published online 2002 January 15. doi: 10.1051/medsci/200218155.L’éradication des maladies infectieuses : l’exemple de la poliomyélite Denise Antona Institut de Veille Sanitaire, Département des maladies infectieuses, 12, rue du Val d’Osne, 94415 Saint Maurice Cedex, France |
En 1980, la 33e assemblée mondiale de la santé a certifié la variole éradiquée de la planète, avec le dernier cas déclaré en 1977 en Somalie. Pour la première fois dans l’histoire, une maladie était vaincue par l’homme. Il ne s’agissait pas là de la première tentative d’éradication d’une maladie, et le programme mis en place pour la variole a bénéficié des leçons tirées des échecs de programmes précédents. Pour mémoire, on peut citer les tentatives vis-à-vis de la fièvre jaune (1915-1977) pour laquelle la difficulté essentielle était l’existence d’un réservoir animal, du pian (1954-1967) avec un double problème de sous-estimation du nombre de cas inapparents et de résistance aux traitements, ou du paludisme (1955-1980) avec l’émergence de résistance au DDT chez les anophèles. La stratégie utilisée pour la variole a servi à son tour de modèle pour les deux programmes actuellement en place, ciblant la poliomyélite et la dracunculose. Pour illustrer notre propos, nous prendrons ici l’exemple de la poliomyélite. |
La lutte contre les maladies infectieuses figure parmi les objectifs prioritaires de tout programme de santé publique. L’éradication en représente l’objectif ultime et doit être différenciée des autres objectifs de lutte que sont le contrôle et l’élimination d’une maladie. Il convient de rappeler ici ce que l’on entend par ces différentes notions [1]. - Le contrôle d’une maladie consiste en la réduction, à un niveau acceptable, de l’incidence ou de la prévalence des cas et/ou de la mortalité attribuables à cette pathologie, par la mise en œuvre de mesures adaptées. Cette réduction doit être entretenue par des interventions pérennes.
- L’élimination d’une maladie est le résultat de mesures ayant permis une réduction du nombre de cas de la maladie jusqu’à une incidence nulle. Elle est géographiquement limitée (à l’échelle d’un pays, d’une région, d’un continent). Les mesures d’intervention doivent être maintenues. Pour certaines pathologies, on peut aller jusqu’à cibler l’élimination de l’infection, et dans ce cas il s’agit en plus d’éliminer de l’environnement le micro-organisme responsable et les interventions mises en place doivent alors empêcher toute possibilité de reprise de la transmission de l’infection (toujours dans une zone géographique limitée).
- L’éradication consiste en une réduction permanente de l’incidence de l’infection à zéro cas avec élimination du germe de l’environnement, à l’échelle de la planète entière. Le micro-organisme responsable ne peut persister, de manière confinée, que dans un nombre restreint de laboratoires retenus par les autorités sanitaires au niveau international. Les mesures d’intervention et de prévention ne sont plus nécessaires.
La possibilité d’éradication d’une maladie est fonction de la biologie du germe pathogène qui en est la cause et des outils dont on dispose pour le combattre. Pour un germe donné, la faisabilité technique de l’éradication est conditionnée par l’existence :
- d’un réservoir exclusivement humain, et donc de l’absence de développement du germe chez les animaux ou dans l’environnement;
- d’une stratégie d’action et de mesures d’intervention permettant d’interrompre de façon efficace la transmission du germe en question;
- d’outils diagnostiques d’utilisation aisée, sensibles et spécifiques, permettant l’identification facile et rapide des derniers cas ou des derniers germes circulants [2].
Toutefois, la décision de lancer une initiative d’éradication ne repose pas uniquement sur le fait qu’elle soit possible, mais que ses effets directs et indirects soient positifs. Les initiatives d’éradication se heurtent à des obstacles de différente nature, pouvant être liés à l’absence de volonté politique d’éradication, soit parce que les bénéfices d’un programme d’éradication pour la communauté ne font pas partie des priorités des autorités sanitaires, soit par crainte de perturbations dans la fourniture d’autres services de santé. Parce que les ressources humaines et financières sont limitées en matière de santé, les programmes d éradication doivent être conscients du risque qu’il y a de détourner des ressources affectées à d’autres domaines prioritaires de la santé, en particulier dans des pays où le système de santé en place n’est pas très solide. Un autre obstacle majeur à l’efficacité de tels programmes est ’existence de troubles politiques, sociaux ou armés dans certaines régions du globe. Les programmes d’éradication, outre l’impact définitif sur l’incidence d’une maladie, doivent donc pouvoir aider au renforcement des autres composantes des systèmes de santé, par exemple au renforcement de l’ensemble du programme de vaccination et à la mise en place de systèmes de surveillance sensibles, permettant ainsi aux programmes de surveillance et de contrôle d’autres maladies de bénéficier de l’effort d’éradication. |
Un exemple : le programme d’éradication de la poliomyélite Avant de lancer l’initiative mondiale d’éradication de la poliomyélite, les experts devaient parvenir à un consensus sur son caractère prioritaire. Ce consensus a été progressivement atteint au cours des années 1980. La région OMS (Organisation Mondiale de la Santé) des Amériques a déclenché le processus en 1985 par l’adoption d’une résolution demandant que l’on se mobilise pour éradiquer la poliomyélite de la planète avant 1990. En 1988, la 41e Assemblée mondiale de la santé a adopté cet objectif d’éradication pour l’an 2000 [3]. A cette date, la poliomyélite était présente sur les 5 continents, avec 125 pays endémiques et un nombre total de cas annuels estimé à 350 000 avec une létalité de 5 % à 10 %; ce qui représente près de 1 000 nouveaux cas de paralysie et 50 à 100 décès par jour dans le monde, touchant essentiellement des enfants, alors qu’un vaccin existait déjà depuis 30 ans. De plus, pour chaque cas diagnostiqué, il faut rappeler qu’approximativement 200 personnes sont infectées de façon asymptomatique et susceptibles de transmettre le virus [4, 5]. La priorité donnée à l’éradication de la poliomyélite par rapport à d’autres maladies s’appuie sur les éléments suivants : il s’agit d’une infection humaine sans portage chronique, ni réservoir animal, contre laquelle un vaccin efficace et peu coûteux est disponible, l’immunité conférée dure la vie entière sous réserve de respecter le calendrier vaccinal, et la survie du virus dans l’environnement est relativement courte. Outre le fait de prévenir à jamais les infirmités et les décès dus à la maladie, l’éradication supprimerait la nécessité de vacciner contre la poliomyélite, entraînant une économie totale estimée à 1,5 milliard de dollars par an et, en termes de bénéfices indirects, un renforcement des programmes de vaccination et des systèmes de surveillance, la mise en place d’un réseau mondial de laboratoires ainsi que la formation de milliers de personnels de santé [6]. L’expérience des Amériques, avec 25 pays sur 34 ayant déjà éliminé la maladie en 1988, démontrait pour la première fois que l’élimination de la poliomyélite d’une vaste région était opérationnellement réalisable, et constituait en quelque sorte un laboratoire de terrain pour évaluer les stratégies avant la mise en place d’un effort mondial d’éradication [7]. Les principales stratégies retenues reprennent donc les mesures ayant démontré leur efficacité dans les Amériques, comprenant :
- le renforcement des programmes de vaccination afin de faire régresser rapidement la circulation des poliovirus (obtention et maintien d’une couverture vaccinale de 90 % par 3 doses de vaccin polio oral (VPO) avant l’âge de 1 an en routine, mais aussi l’organisation de journées nationales de vaccination au cours desquelles tous les enfants âgés de moins de 5 ans doivent recevoir systématiquement 2 doses de VPO à un mois d’intervalle quel que soit leur statut vaccinal);
- la surveillance des cas de paralysies flasques aiguës1 (PFA) avec isolement des poliovirus dans les selles. Un réseau mondial de laboratoires des entérovirus a été mis en place pour assurer un isolement, une identification et une caractérisation génomique fiables du poliovirus à partir des échantillons de selles prélevés sur les cas de PFA. Ce réseau est constitué de 148 laboratoires accrédités par l’OMS (7 laboratoires spécialisés, 15 laboratoires de référence et 126 laboratoires nationaux);
- l’organisation d’opérations de « ratissage » (campagnes de vaccination de porte en porte) dans les zones identifiées à risque par la surveillance, afin d’éliminer les derniers réservoirs de transmission des poliovirus.
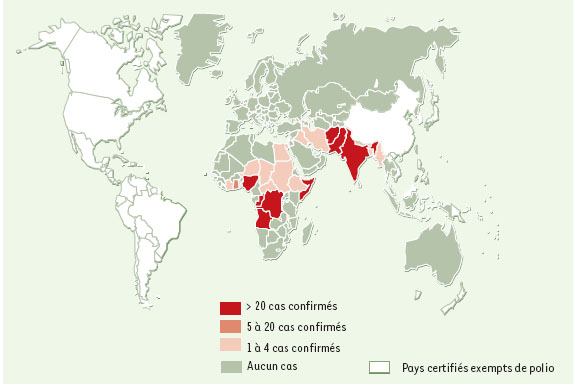
Une fois la transmission du poliovirus sauvage interrompue au niveau de la planète, l’élimination devra être certifiée par la Commission mondiale de certification de l’éradication de la poliomyélite, créée en 1995. Sous les auspices de cette commission, chaque pays a dû réunir un comité national de certification de l’élimination de la poliomyélite, devant apporter la preuve de cette élimination. En France, le comité national est placé sous les auspices de la Direction générale de la santé et regroupe des experts infectiologues, neurologues, virologues, pédiatres, épidémiologistes et ingénieurs sanitaires. Le critère de certification le plus important dans un pays, dans une région et, bien sûr dans le monde, est l’absence d’isolement de poliovirus pendant au moins 3 ans dans des conditions où la surveillance exercée est satisfaisante. Le processus de certification s’intéresse en priorité aux performances du système de surveillance, mais aussi à la couverture vaccinale et aux moyens de détection et de contrôle mis en place en cas d’importation de virus. Après avoir analysé les données de chaque pays, l’élimination ne sera certifiée qu’à un niveau régional (6 régions OMS). Lorsque les 6 régions de l’OMS auront été déclarées exemptes de la poliomyélite, la Commission mondiale sera en mesure de certifier l’éradication mondiale de la poliomyélite. Depuis la mise en place du programme d’éradication, le total des pays dans lesquels la transmission du poliovirus sauvage persistait, n’était plus que de 20 à la fin de l’année 2000 (Figure 1), avec un nombre de cas estimé inférieur à 3 000, soit une réduction du nombre de cas de plus de 99 % au cours de ces 13 dernières années [8].  | Figure 1. Transmission des poliovirus sauvages, par pays, en l’an 2000 (source : données OMS au 27 juin 2001). |
Ces résultats ont été obtenus grâce à d’impressionnants efforts de vaccination, avec l’organisation de journées nationales de vaccination (JNV) à l’échelle d’un pays même ou en coordination avec des pays voisins. A titre d’exemples peuvent être cités : la Chine, qui a réussi à vacciner 83 millions d’enfants de moins de 5 ans lors de JNV massivement suivies en décembre 1993, l’Inde qui a vacciné plus de 90 millions d’enfants au cours de ses premières JNV en décembre 1995 et janvier 1996, l’opération MECACAR, regroupant 18 pays du Moyen-Orient, du Caucase et d’Asie Centrale et au cours de laquelle ont été vaccinés 60 millions d’enfants entre 1995 et 1997. De même, les pays du Sud-Est asiatique (regroupant 8 pays avec la Chine) ont vacciné de façon coordonnée 250 millions d’enfants en décembre 1996 et janvier 1997, et en Afrique l’opération Kick polio out of Africa (36 pays) a permis de vacciner 85 millions d’enfants entre décembre 1996 et janvier 1998. Des cessez-le-feu ont été obtenus dans plusieurs pays pour permettre qu’aient lieu les JNV (exemples : Soudan en 1994 et 1996, Afghanistan 1994, 1996, 1997 ou Tadjikistan en 1995). Toutefois, malgré ces efforts intenses il est devenu très rapidement clair que l’échéance de la certification de l’éradication ne serait pas atteinte en 2000, et l’objectif de certification mondiale de l’éradication a alors été repoussé en 2005 par l’Assemblée mondiale de la santé [9]. Dès 1999, une accélération marquée du programme a été entreprise en se focalisant plus spécialement sur les pays à endémicité élevée ou sièges de conflits armés (augmentation du nombre des JNV, et des opérations de ratissage). |
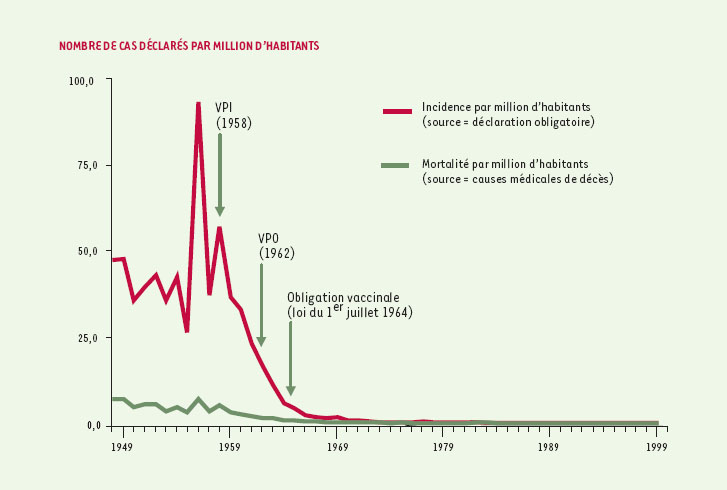
Où en est-on du processus d’éradication de la poliomyélite en 2001 ? Dans la région des Amériques, le dernier cas déclaré remonte à 1991, au Pérou, et la certification de l’élimination de cette maladie y a été prononcée en 1994. Le dernier cas de paralysie dû à un poliovirus sauvage endémique dans la région du Pacifique occidental (incluant la Chine) a été notifié au Cambodge en 1997, et l’élimination y a été certifiée en 2000 [10]. Dans la région européenne de l’OMS, où étaient observés en moyenne 200 cas de poliomyélite par an dans les années 1990, quelques épidémies sont survenues ces dernières années comme aux Pays-Bas en 1992-1993, dans une communauté religieuse refusant les vaccinations, ou en Albanie en 1995-1996. Un poliovirus sauvage endémique a été identifié pour la dernière fois en novembre 1998, en Turquie, et pendant 2 ans la région a été considérée exempte de poliovirus. La région a été de nouveau en alerte quand, au cours du premier semestre 2001, 2 cas de poliovirus de type 1 importés d’Inde ont été notifiés dans une région côtière de Bulgarie, au sein d’une population tsigane non vaccinée [11]. Le caractère importé des cas, alors qu’aucun cas n’avait été déclaré dans ce pays au cours des 10 dernières années, et la mise en place immédiate d’une large campagne de vaccination (mise à jour de la vaccination de 130 000 enfants tsiganes ainsi que campagne de vaccination dans les populations d’enfants bulgares de moins de 7 ans) devraient permettre de ne pas remettre en question la prochaine certification de l’élimination de la polio de la région européenne, mais risque toutefois de la retarder. En France, le dernier cas de poliomyélite autochtone remonte à 1989 et le dernier cas importé en 1995, tous deux concernant des adultes, et le dernier isolement de poliovirus sauvage chez un sujet n’ayant pas voyagé récemment remonte aussi à 1989 (Figure 2) [12]. Il semble donc que la circulation des poliovirus sauvages y soit actuellement interrompue. Mais ce qui s’est passé en Bulgarie doit inviter à une extrême vigilance vis-à-vis d’une possible réintroduction de poliovirus, en raison de la persistance de foyers endémiques dans le monde en développement (Figure 1). C’est le principal risque à prendre en compte dans notre pays. L’identification la plus précoce possible d’un tel phénomène est aujourd’hui assurée par la surveillance renforcée des entérovirus chez l’homme et dans l’environnement, outre la déclaration obligatoire des cas de poliomyélite [13].  | Figure 2. La poliomyélite antérieure aiguë en France de 1949 à 2000. VIP : vaccin polio injectable ; VPO : vaccin polio oral. |
Il est encourageant de noter que d’ores et déjà l’interruption de la transmission du poliovirus de type 2 semble en très bonne voie au niveau mondial. En effet, les derniers pays à avoir signalé des isolements de poliovirus de type 2 ont été l’Afghanistan et le Pakistan en 1997, et l’Inde en 1999. Dans le cadre de la surveillance des PFA, le réseau mondial des laboratoires accrédités par l’OMS a examiné 48 370 échantillons de selles en 1999 et 50 000 en 2000. Au cours de cette même période, ont été identifiés 2 098 isolements de poliovirus sauvage type 1 (1 664 en 1999 et 434 en 2000) et 1 127 isolements de poliovirus sauvage de type 3 (894 en 1999 et 233 en 2000), contre 11 isolements de virus sauvage de type 2, tous observés en Inde en 1999. Depuis 1999, tous les poliovirus isolés de type 2 identifiés étaient dérivés de la souche vaccinale. On pense que ce résultat est lié à la forte immunogénicité du poliovirus 2 présent dans le vaccin polio oral (VPO) ainsi qu’à une propagation plus efficace de cette souche vaccinale aux contacts proches d’une personne vaccinée, par comparaison avec les deux autres types de poliovirus vaccinaux [14]. Mais même si l’interruption de la transmission des poliovirus sauvages de types 1 et 3 semble plus difficile, l’expérience acquise dans les régions certifiées exemptes de polio fait penser que si tous les éléments de la stratégie d’éradication sont mis en place de façon efficace, les mêmes résultats devraient être observés sur ces types de poliovirus. |
L’objectif ultime d’un programme d’éradication est d’arrêter toute intervention et, dans le cas de la polio, il s’agira donc de permettre l’arrêt de la vaccination. La sensibilité des populations aux poliovirus augmentera après cet arrêt avec le risque à long terme de possible transmission épidémique sur une grande échelle. La question qui se pose est donc celle de la stratégie d’arrêt qu’il faudra adopter afin de protéger le mieux possible la population : quand et comment programmer cet arrêt ? L’interruption du VPO de façon synchronisée dans le monde reste la solution la plus logique, à la suite de JNV organisées au niveau mondial, mais plusieurs autres stratégies peuvent être proposées :
- maintenir la vaccination avec le calendrier vaccinal actuel, ce qui permet de maintenir l’immunité dans la population mais ne met pas à l’abri de cas de polio post-vaccinale (PPV) ; par ailleurs, le maintien de l’intervention entraînera une quasi-absence du bénéfice financier tiré de l’éradication;
- éliminer progressivement les souches de VPO et avoir recours à un VPO mono- ou bivalent, mais ceci impliquerait dans un premier temps de pouvoir faire homologuer rapidement de tels vaccins;
- interrompre le VPO de façon sélective pays par pays, mais avec le risque de permettre une réintroduction et la circulation de poliovirus vaccinal dans un pays ayant stoppé toute vaccination, à partir d’une région où l’on vaccine encore;
- substituer le VPO par le vaccin polio injectable (VPI), de façon soit transitoire, soit définitive. Il y a dans les deux cas absence de risque de PPV, mais il s’agit là d’une stratégie très coûteuse. Dans le cas d’une stratégie définitive, continuer à produire du VPI à partir du poliovirus sauvage implique que les producteurs de vaccin resteraient une source potentielle de reprise possible de l’infection.
Il paraît donc prématuré d’avancer aujourd’hui une date possible d’interruption totale de toute vaccination. Plusieurs questions restent préoccupantes. - L’excrétion prolongée du virus vaccinal chez des sujets immunodéprimés, en particulier les patients qui présentent des déficits immunitaires primaires touchant les lymphocytes B, pathologies bien documentées dans les pays industrialisés mais dont la prévalence est inconnue dans les pays en voie de développement. Ces patients présentent une prédisposition aux infections chroniques du système nerveux central par les entérovirus et plusieurs études ont montré qu’ils étaient susceptibles de continuer à excréter du poliovirus pendant des années [15, 16]. On dispose en revanche de peu de données en ce qui concerne l’infection à VIH comme facteur de risque potentiel d’une excrétion virale prolongée.
- La circulation possible de poliovirus Sabin-like revertants (souche d’origine vaccinale ayant retrouvé un génotype neuro-invasif par mutation), et à l’origine de foyers épidémiques. Fin 2000, en Haïti et à Saint-Domingue ont été signalés 20 cas confirmés. Le séquençage des virus a permis d’identifier une souche d’origine vaccinale, de type 1, redevenue virulente et ayant retrouvé les mêmes caractéristiques de transmission que les poliovirus sauvages. Dans ces deux pays, les faibles taux de couverture vaccinale ont permis une circulation prolongée du virus vaccinal dans la population, favorisant cette dérive génétique [17]. La survenue de ces foyers épidémiques dans une zone certifiée exempte de poliovirus sauvage depuis 10 ans souligne la nécessité de rester extrêmement vigilant et de cibler les populations avec de faibles couvertures vaccinales pour des campagnes de vaccination massives avec du VPO, afin d’enrayer non seulement la circulation du poliovirus sauvage mais également celle de possibles virus vaccinaux revertants.
- Le confinement des poliovirus dans des laboratoires : une fois l’éradication certifiée au niveau mondial, la seule source de poliovirus sauvage sera constituée par les laboratoires. Tant que l’on maintient une couverture vaccinale élevée, la transmission éventuelle d’un poliovirus du laboratoire à la communauté aura peu de conséquences. En revanche, si l’on arrête la vaccination, les conséquences d’une telle transmission pourraient s’avérer catastrophiques. Il est donc essentiel de réduire le nombre de laboratoires conservant du poliovirus sauvage ou du matériel infectieux et de prendre les mesures de confinement voulues dans ces derniers. En mai 1999, la 52e Assemblée mondiale de la santé adoptait un plan mondial de confinement en laboratoire des poliovirus sauvages, confinement constituant un pré requis à la certification [18]. Le plan prévoit trois phases de mise en place : pré-éradication, post-éradication et post-vaccinale VPO. Lors de la première phase, les pays pour lesquels la transmission est interrompue doivent prévoir une commission nationale spéciale, chargée d’alerter les laboratoires sur l’imminence de l’éradication, et de dresser un inventaire de tous les laboratoires détenant ou susceptibles de détenir du matériel potentiellement infecté par du poliovirus sauvage. Ces laboratoires doivent alors instituer des procédures de biosécurité de niveau 2 (BSL-2/polio) permettant la manipulation sans danger du matériel infectieux ou potentiellement infectieux contenant du poliovirus sauvage. Lors de la phase de post-éradication, ou dans l’année qui suivra la détection du dernier poliovirus sauvage dans le monde, devront être mises en place des mesures de confinement de niveau 3 (BSL-3/polio) pour tous les laboratoires possédant du matériel infectieux ou potentiellement infectieux contenant du poliovirus sauvage, ou le transfert de ce matériel dans les dépôts désignés par l’OMS ou sa destruction dans des conditions appropriées. La phase post-vaccinale VPO impliquera, à l’arrêt de la vaccination par le VPO, un confinement maximal (BSL-4/polio) du matériel infectieux ou potentiellement infectieux contenant du poliovirus sauvage, et un confinement élevé (BSL-3/polio) des virus VPO et des virus dérivés du VPO.
|
Si le programme d’éradication de la poliomyélite est en très bonne voie et l’annonce de la certification de son éradication de la planète paraît de plus en plus proche, plusieurs questions restent donc en suspens. L’échéance de la certification de l’éradication de la poliomyélite a dû déjà être repoussée de 2000 à 2005. Pour ces 5 années, le programme mis en place prévoit un budget d’un milliard de dollars. Le coût pour éradiquer les derniers cas reste très élevé, principalement lié aux difficultés rencontrées dans les pays encore endémiques, au sein desquels 10 d’entre eux constituent encore d’importants réservoirs de poliovirus sauvages (Inde, Pakistan, Bengladesh, Éthiopie et Nigeria), ou sont sièges de conflits armés (Afghanistan, Angola, Somalie, et Soudan) ou les deux (République démocratique du Congo). De plus, la majorité d’entre eux sont des pays pauvres, avec des structures de santé fragiles. Or trouver les ressources nécessaires pour atteindre le but fixé devient de plus en plus ardu et, pour le moment, les promesses des différents donateurs impliqués dans le programme d’éradication n’atteignent que 600 millions de dollars [19]. De plus, en dehors des questions de ressources financières, la décision de l’arrêt de la vaccination contre la poliomyélite ne sera pas aisée à prendre. Les conséquences d’une interruption de la vaccination demeurent un sujet de préoccupation car elle exige des mécanismes de surveillance clinique et d’environnement extrêmement efficaces et fiables afin de déceler toute ré-introduction ou transmission à bas bruit du virus. Or ce type de surveillance n’est pas à la portée de tous les pays, pas plus que ne l’est le passage d’une vaccination par le VPO à celle par le VPI. Enfin, la persistance du poliovirus oral dans la population et le risque potentiel de dérive génétique avec reprise de neurovirulence sont des questions pour lesquelles les réponses ne sont pas encore tranchées. |
Footnotes |
1. Dowdle WR. The principles of disease elimination and eradication. In : Goodman RA et al., eds. Global disease elimination and eradication as public health strategies. Proceedings of a conference held in Atlanta, Georgia, USA, 23-25 february 1998. Bull WHO 1998; 76 (suppl 2) : 22–5. 2. Centers for Diseases Control and prevention (CDC). Recommendations of the International task force for disease eradication. Morb Mortal Wkly Rep 1993; 42 : RR–16. 3. World Health Assembly. Global eradication of poliomyelitis by the year 2000. World Health Assembly resolution WHA 41.28. Geneva, Switzerland : World Health Organization, 1988. 4. Rey M, Guerin N. Poliomyelite. Encycl Med Chir (Elsevier, Paris), Maladies infectieuses 1997; 8-058-A-10 : 8 p. 5. Hull HF, Ward NA, Hull BP, Milstien JB, de Quadros C. Paralytic poliomyelitis : sea-soned strategies, disappearing disease. Lancet 1994; 343 : 1331–7. 6. Alwyard RB, Hull HF, Cochi SL, Sutter RW, Olive JM, Melgaard B. Disease eradication as a public health strategy : a case study of poliomyelitis eradication. Bull WHO 2000; 78 : 285–97. 7. De Quadros C, Hersh BS, Olive JM, Andrus JK, da Silveira CM, Carrasco PA. Eradication of wild poliovirus from the Americas: acute flaccid paralysis surveillance, 1988-1995. J Infect Dis 1997; 175 (suppl 1): S37–42. 8. CDC. Progress towards poliomyelitis eradication, 2000. Morb Mortal Wkly Rep 2001; 50 : 320-2–331. 9. WHO. Department of vaccines and biologicals. The polio eradication initiative : strategie plan of action, 2001-2005. Geneva, Switzerland : World Health Organization, 2000 (document 00.05). 10. CDC. Certification of poliomyelitis eradication : Western Pacifie region, October 2000. Morb Mortal Wkly Rep 2001; 50 : 1–3. 11. Schrope M. Plans to eradicate polio hit by virus outbreak in Bulgaria. Nature 2001; 411 : 405. 12. Guerin N, Lequellec-Nathan M, Rebiere I, Dubrou S, Aymard M. Surveillance de la poliomyelite et des poliovirus en France. BEH 1997; 12: 51–3. 13. Plan d’action de la commission nationale de certification de l’eradication de la poliomyelite : actualisation du plan d’action de juin 1998. Conduite à tenir devant un cas de polio suspect ou confirme ou devant un isolement de poliovirus. BEH 2000; 46-47 : 201–8. 14. WHO. Transmission of wild poliovirus type 2 : apparent global interruption. Wkly Epidemiol Rec 2001; 13 : 95–7. 15. Rosen FS, Cooper MD, Wedgwood RJP. The primary immunodeficiencies. N Engl J Med 1995; 333 : 431–40. 16. Fine P, Carneiro IAM. Transmissibility and persistence of oral polio vaccine viruses : implications for the global poliomyelitis eradication initiative. Am J Epidemiol 1999; 150 : 1001–21. 17. CDC. Outbreak of poliomyelitis : Dominican republic and Haiti, 2000-2001. Morb Mortal Wkly Rep 2001; 50 : 147. 18. WHO. Department of vaccines and biologicals. World Health Organization global action plan for laboratory containment of wild polioviruses. Geneva, Switzerland : World Health Organisation, 1999 : V and B/99.32. 19. Maurice J. Polio eradication: the last and toughest 1%. Bull WHO 2001; 79 : 582 |