L’homéostasie du fer au niveau de l’organisme repose sur une régulation fine de l’absorption intestinale du fer alimentaire (pour revue, voir [1]). Cette absorption se fait par les entérocytes mûrs situés au sommet de la villosité duodénale et met en jeu un grand nombre de protéines incluant des réductases, des oxydases et des transporteurs membranaires (→). L’expression intégrée et coordonnée de ces différentes protéines dépend de signaux envoyés par l’organisme qui varient en fonction du niveau des réserves tissulaires en fer (on parle du signal store regulator), ou de l’activité érythropoïétique de la moelle osseuse (on parle du signal erythroid regulator). Ce sont les précurseurs situés dans la crypte de la villosité intestinale qui reçoivent ces signaux et qui, en se différenciant le long de la villosité en entérocytes mûrs, permettront le contrôle de l’absorption de fer. Ainsi, dans des conditions physiologiques normales, les entérocytes sont-ils programmés pour s’adapter à la demande en fer de l’organisme. La nature des signaux permettant la programmation des entérocytes a longtemps été recherchée et il semble qu’une des molécules participant à cette programmation ait été récemment identifiée. Il s’agit de l’hepcidine, une protéine synthétisée dans le foie sous la forme d’un pré-propeptide et excrétée dans la circulation sous la forme d’un peptide mûr de 25 acides aminés. Le peptide circulant a été purifié indépendamment par deux groupes sur la base de ses propriétés anti-microbiennes [2, 3].
(→) m/s 2000, n°6-7, p. 833
La découverte de l’implication de l’hepcidine dans le métabolisme du fer repose sur une observation inattendue de notre laboratoire faite dans un modèle de souris déficientes (souris knock-out) pour le facteur de transcription USF2 (upstream stimulatory factor) [4]. Dès l’âge de trois mois, le foie et le pancréas de ces souris sont de couleur marron, suggérant leur surcharge en fer.
De fait, les souris Usf2−/− développent une surcharge martiale avec un tableau clinique en tout point similaire à celui des sujets atteints d’hémochromatose. L’hémochromatose est une maladie génétique à caractère autosomique récessif liée, dans 80 % des cas, à l’existence d’une mutation (C282Y) du gène Hfe-1 (→). Cette affection se caractérise cliniquement par une hyper-absorption digestive de fer qui aboutit à son accumulation dans les tissus. Curieusement, les macrophages de la rate échappent à ce processus d’accumulation du fer. Si aujourd’hui le rôle de la protéine HFE n’est pas entièrement élucidé, on pense qu’une de ses fonctions serait d’opérer une régulation négative de la capture du fer via le complexe transferrine/récepteur de la transferrine. Les souris Usf2−/− miment parfaitement le phénotype du modèle murin d’hémochromatose réalisé par inactivation du gène codant pour la protéine HFE [5]. Or, l’expression du gène hfe est tout à fait normale dans le modèle Usf2−/− . Pour trouver des cibles potentielles pouvant expliquer le développement de la surcharge martiale, nous avons entrepris la construction d’une banque soustractive de foie (souris normale versus souris Usf2−/−). Le criblage de cette banque a permis l’identification de l’hepcidine et la mise en évidence de l’absence complète d’expression d’hepcidine dans le modèle des souris Usf2−/−. Cette inhibition de l’expression du gène codant pour l’hepcidine s’explique très probablement par le fait qu’il se situe juste en aval du gène Usf2 (à moins de 1,5 kb) sur le chromosome 7. L’expression de ce gène serait alors altérée par la présence de la cassette d’inactivation dans le gène Usf2.
(→) m/s 1998, n°12, p. 1387
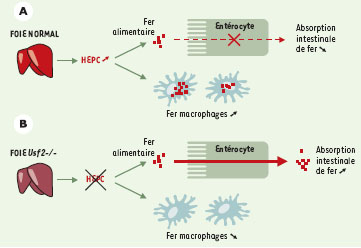
La corrélation entre hepcidine et métabolisme du fer est fortement renforcée par les résultats récents de Pigeon et al. qui montrent que l’expression de l’hepcidine est activée en cas de surcharge en fer, surcharge soit provoquée (les souris soumises à un régime riche en fer), soit génétique (souris knock-out pour la β2-microglobuline)[6]. Ainsi, l’intégration de ces données suggère-t-elle un rôle inhibiteur de l’hepcidine au niveau de l’absorption intestinale de fer. Dans les modèles de surcharge, l’expression du gène codant pour l’hepcidine est augmentée pour permettre de lutter efficacement contre une absorption excessive de fer qui pourrait avoir un effet toxique pour l’organisme. Dans le modèle des souris knock-out Usf2−/−, le gène de l’hepcidine est réprimé, la régulation négative de l’absorption du fer n’est plus opérationnelle, conduisant alors à l’accumulation du métal dans les parenchymes hépatique et pancréatique. Ainsi, l’hepcidine pourrait bien correspondre à l’hormone recherchée depuis 40 ans (le fameux store regulator). Cette découverte constitue maintenant le point de départ de très nombreuses recherches d’intérêt physiopathologique, pharmacologique et clinique. Il y a fort à parier que toute situation physiopathologique conduisant à des variations de l’expression du gène codant pour l’hepcidine puisse être à l’origine d’un dérèglement de l’homéostasie du fer conduisant, suivant le cas, soit à des surcharges martiales, soit à des déficits en fer.
| Figure 1. Modèle proposé pour le rôle inhibiteur de l’hepcidine au niveau de l’absorption intestinale de fer. A. En cas de surcharge alimentaire, l’expression du gène codant pour l’hep-cidine (HEPC) est augmentée pour freiner l’absorption excessive du fer. B. Dans le modèle des souris knock-out Usf2−/−, le gène codant pour l’hepcidine est réprimé, la régulation négative de l’absorption du fer n’est plus opérationnelle, conduisant alors à l’accumulation du métal dans les parenchymes hépatique et pancréatique. Nous proposons également que l’hepcidine puisse participer au mouvement du fer dans les macrophages. En cas de surexpression de l’hepcidine, le macrophage retient son fer alors qu’inversement, dans des cas d’inhibition de l’hepcidine, la quantité de fer dans les macrophages est très largement réduite. |