| |
| Med Sci (Paris). 2002 April; 18(4): 398–400. Published online 2002 April 15. doi: 10.1051/medsci/2002184398.La protéine plasmatique de transfert des phospholipides (PLTP) : un nouveau facteur athérogène Laurent Lagrost* and David Masson Inserm U.498,Faculté de Médecine, 7, boulevard Jeanne d’Arc, BP 87900, 21079 Dijon Cedex, France |
Il est maintenant clairement établi que la protéine plasmatique de transfert des phospholipides (PLTP) occupe une place essentielle dans le métabolisme intra-vasculaire des lipoprotéines de haute densité (HDL) dont le rôle bénéfique est de ramener le cholestérol excédentaire des tissus périphériques vers le foie. Ainsi, les premières études chez la souris, espèce à forte activité PLTP, ont révélé que l’invalidation du gène PLTP s’accompagne de modifications drastiques du profil de distribution des HDL. En particulier, chez la souris homozygote PLTP−/−, les concentrations circulantes de particules HDL sont fortement abaissées, suggérant un important ralentissement de la voie anti-athérogène des HDL [1]. Contre toute attente, l’équipe des Docteurs Xian-Cheng Jiang et Alan R. Tall (Columbia University, New York, USA) vient de démontrer que l’invalidation du gène de la PLTP chez divers modèles de souris hypercholestérolémiques s’accompagne d’une nette diminution des lésions d’athérosclérose et ceci malgré la persistance d’un effet négatif sur les HDL [2]. En fait, l’explication de ces résultats inattendus serait plutôt à rechercher du côté du métabolisme des lipoprotéines potentiellement athérogènes et contenant l’apolipoprotéine B. |
Sécrétion hépatique des lipoprotéines à apolipoprotéine B : une nouvelle fonction pour la PLTP La relation inverse entre la concentration plasmatique des HDL et l’incidence des maladies cardiovasculaires a suscité au cours des vingt dernières années un intérêt considérable pour l’étude de l’origine métabolique des HDL. Alors que c’est dans ce contexte que la PLTP a été initialement étudiée, des données plus récentes ont indiqué qu’elle peut être également impliquée dans le flux sortant du cholestérol cellulaire, les transfert de vitamine E et la sécrétion des VLDL (very low density lipo-proteins) par le foie (Figure 1). La PLTP est exprimée naturellement à des niveaux élevés chez la souris et, de ce fait, les effets additifs résultant de l’expression de la PLTP humaine à des concentrations physiologiques ont été relativement modérés chez la souris transgénique [1, 3, 4]. Ils ont néanmoins permis de valider l’hypothèse selon laquelle la PLTP joue un rôle important dans le métabolisme intravas-culaire des HDL [1, 3, 4]. L’invalidation du gène de la PLTP chez la souris s’est révélée constituer une stratégie plus adaptée au cas particulier de cette espèce à forte activité et les souris PLTP−/− ont achevé de démontrer le rôle clé de la PLTP dans le métabolisme des HDL. Schématiquement, le déficit en activité PLTP conduit à la diminution du HDL-cholestérol, de l’apoli-poprotéine AI et des préβ-HDL, accepteurs initiaux du cholestérol cellulaire dans la première étape de la voie de retour du cholestérol des tissus périphériques vers le foie. Cependant, des travaux récents ont démontré que le rôle de la PLTP ne se limite pas au métabolisme intravas-culaire des HDL puisqu’elle peut également intervenir dans la synthèse et dans la sécrétion des lipoprotéines contenant l’apolipoprotéine B [2] (Figure 1). Ainsi, le déficit en PLTP conduit à la diminution significative des concentrations plasma-tiques d’apolipoprotéine B et du contenu en cholestérol, phospholipides et triglycérides des lipopotéines de très basse et basse densité (VLDL et LDL) potentiellement athérogènes. Chez les animaux apoBTg, les études de turnover, ainsi que les données obtenues sur hépatocytes en culture primaire ont révélé que le déficit en PLTP est associé à une réduction significative de la sécrétion, mais pas de la synthèse hépatique des apolipoprotéines B100 et B48 [2]. Ces résultats démontrent pour la première fois que la PLTP, destinée à être sécrétée dans l’espace intravasculaire, pourrait également exercer une action intracellulaire en réglant la biosynthèse des lipoprotéines contenant l’apolipoprotéine B au niveau du Golgi ou du réticulum endoplas-mique. Si cet effet est avéré chez les souris génétiquement modifiées exprimant l’apoprotéine B humaine (souris apoBTg) ou dont le gène de l’apolipopro-téine E a été invalidé (souris apoE−/−), les concentrations circulantes d’apoli-poprotéine B ne sont toutefois pas modifiées du fait de l’absence d’expression de la PLTP chez les souris dont le gène du récepteur cellulaire des LDL a été invalidé (souris LDLr−/−).
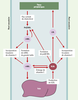 | Figure 1. Rôles de la protéine de transfert des phospholipides (PLTP) dans le métabolisme des lipoprotéines. Alors que les tissus périphériques peuvent acquérir du cholestérol par le biais de l’endocytose et de l’hydrolyse des VLDL/LDL, le cholestérol excédentaire, délétère pour la cellule, peut être ramené au foie, seul organe capable de l’éliminer par voie biliaire. Ce sont les lipoprotéines de haute densité (HDL) qui vont jouer un rôle clé dans cette voie du transport inverse du cholestérol. Au cours de l’étape initiale, les préβHDL, dis-coïdales et naissantes, prennent en charge le cholestérol qui est finalement ramené au foie par les αHDL, sphériques et mûres. Au cours de leur transit dans l’espace intravasculaire, les lipoprotéines peuvent subir l’action de la PLTP qui est impliquée dans : (1) l’étape initiale de flux sortant du cholestérol cellulaire ; (2) la formation de particules αHDL mûres ; (3) la production de particules préβHDL ; (4) l’échange et l’incorporation tissulaire de vitamine E ; et, enfin, (5) l’assemblage et la sécrétion des VLDL hépatiques. HDL : high density lipoprotein ; LDL : low den-sity lipoprotein ; VLDL : very low density lipo-protein. |
|
La PLTP est un facteur athérogène chez la souris hypercholestérolémique L’effet du déficit en PLTP sur l’athéro-genèse a été évalué chez les souris apoE−/−, apoBTg ou LDLr−/− nourries avec un régime hyperlipidique [2]. Chez les souris apoE−/− et apoBTg, la surface des lésions d’athérosclérose de l’aorte proximale est 5 fois moins élevée lorsque le gène de la PLTP est invalidé. Sur la base des données antérieures qui sont en faveur d’un lien direct entre la concentration circulante des lipoprotéines contenant l’apolipoprotéine B et l’incidence de l’athérosclérose, il est concevable que la diminution de la production et de la concentration des lipoprotéines VLDL et LDL puisse expliquer, au moins partiellement, la plus faible athérogénicité observée chez les animaux PLTP−/−. Cependant, la surface des lésions d’athérosclérose est également nettement diminuée, d’un facteur 2, chez la souris LDLr−/− en dépit de l’absence d’effet du déficit en PLTP sur les concentrations circulantes de VLDL et LDL dans cette lignée. Ces résultats indiquent donc qu’un autre mécanisme moléculaire pourrait rendre compte (en partie chez les animaux apoE−/− et apoBTg ou en totalité chez les animaux LDLr−/−) de la plus faible athérogénicité liée à un déficit en PLTP. |
Transferts de vitamine E : une autre fonction pro-athérogène de la PLTP ? Au cours des dernières années, le rôle de la PLTP dans le métabolisme intra-vasculaire des lipoprotéines n’a cessé de devenir plus complexe (Figure 1). Initialement décrite pour sa capacité d’échanger des phospholipides entre les VLDL et les HDL, la PLTP peut également transférer d’autres composés amphipathiques tels les lipopo-lysaccharides, les diacylglycérides, le cholestérol non estérifié ou la vitamine E. Ce dernier composé est particulièrement important à considérer dans le cadre d’une évaluation des propriétés athéro-gènes de la PLTP. En effet, la vitamine E, anti-oxydant liposoluble essentiel, est susceptible de bloquer le processus d’athérogenèse dans sa phase initiale. En fait, la PLTP est capable in vitro de faciliter le transfert de l’α-tocophérol, principal isomère de la vitamine E, entre les lipoprotéines plasma-tiques et également entre les lipoprotéines et la paroi vascu-laire [5]. Chez la souris PLTP−/−, la vitamine E tend à s’accumuler dans les lipoprotéines VLDL et LDL, renforçant leur potentiel anti-oxydatif et diminuant leur athérogénicité [6]. Ces premières données in vivo confirment donc que la PLTP est impliquée dans la distribution plasmatique et tissu-laire de la vitamine E. Cette nouvelle fonction de la PLTP, potentiellement délétère, vient s’ajouter à sa capacité de favoriser l’assemblage et la sécrétion des lipoprotéines pro-athéro-gènes. La PLTP semble donc représenter un nouveau facteur de risque et constitue une cible potentielle dans la prévention et le traitement de l’athérosclérose. |
1. Jiang XC, Bruce C, Mar J, et al. Targeted mutation of plasma phospholipid transfer protein gene markedly reduces high-density lipoprotein levels. J Clin Invest 1999; 103 : 907–14. 2. Jiang XC, Qin S, Qiao C, et al. Apolipoprotein B secretion and atherosclerosis are decreased in mice with phospholipid-transfer protein deficiency. Nat Med 2001; 7 : 847–52. 3. Albers JJ, Tu AY, Paigen B, Chen H, Cheung MC, Marcovina SM. Transgenic mice expressing human phospholipid transfer protein have increased HDL/non-HDL cholesterol ratio. Int J Clin Lab Res 1996; 26 : 262–7. 4. Van Haperen R, van Tol A, Vermeulen P, et al. Human plasma phospholipid transfer protein increases the antiatherogenic potential of high density lipoproteins in transgenic mice. Arterioscler Thromb Vasc Biol 2000; 20 : 1082–8. 5. Desrumaux C, Deckert V, Athias A, et al. Plasma phospholipid transfer protein prevents vascular endothelium dysfunction by delivering alpha-tocopherol to endothelial cells. FASEB J 1999; 13 : 883–92. 6. Jiang XC, Qin S, Lin M, et al. Phospholipid transfer protein (PLTP) deficiency represents an anti-oxidant state in mice. Circulation 2001; 104 : II–232. |