Le lobe pariétal est impliqué dans de nombreux processus cognitifs, particulièrement ceux qui nécessitent la perception visuo-spatiale comme la préhension manuelle, l’atteinte par la main d’un objet, ou l’orientation de l’attention et des yeux [1]. D’autres fonctions ne requérant pas de transformation visuo-spatiale évidente, comme le calcul mental [2] ou la détection de phonèmes [3], entraînent aussi des activations pariétales. Deux explications peuvent rendre compte de la proximité anatomique de telles fonctions. La première serait l’existence de procédés abstraits et génériques communs nécessaires à la réalisation de ces différentes tâches.
Les activations pariétales observées dans le calcul pourraient alors refléter l’engagement de mécanismes génériques de transformation de coordonnées et d’attention. Dans la deuxième hypothèse, le lobe pariétal humain serait composé, comme chez le singe, d’une mosaïque de régions spécifiques qui incluraient une région dédiée à la manipulation de quantités numériques [4].
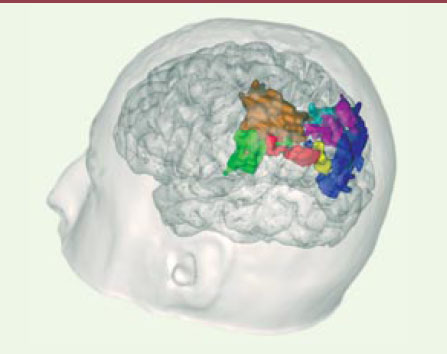
Afin de pouvoir apporter des éléments en faveur de l’une ou l’autre de ces hypothèses, nous avons réalisé une expérience en IRM fonctionnelle chez dix sujets humains [5] (Figure 1) . Ceux-ci ont réalisé six tâches, dont 4 visuo-spatiales (préhension manuelle, pointage avec l’index, saccades oculaires et orientation de l’attention visuelle), une numérique (soustraction à un chiffre) et une langagière (détection de phonèmes dans des mots). Après l’acquisition de ces données, nous avons examiné les relations géométriques entre les différentes activations obtenues. Les résultats ont démontré l’existence d’une carte reproductible des activations pariétales, qui comprend plusieurs régions spécialisées homologues de celles qui sont présentes chez d’autres primates, mais aussi d’autres régions plus particulièrement développées chez l’homme, pour le calcul et le langage.
| Figure 1. L’organisation topographique du cortex pariétal humain révélée par l’IRM fonctionnelle. En vert : préhension manuelle ; en brun : préhension et pointage du doigt ; en violet : tâches visuo-spatiales ; en bleu clair : attention visuelle ; en bleu foncé : saccades oculaires ; en rouge : calcul seul ; en jaune : calcul et langage. |
Ainsi, une activation spécifique d’une tâche de soustraction a été observée de façon bilatérale, à prédominance gauche, dans la partie horizontale du sillon intrapariétal antérieur, et une autre, commune à la soustraction et à la détection phonémique, dans le gyrus angulaire gauche.
La présence de ces deux régions voisines s’accorde avec l’hypothèse théorique selon laquelle il existe deux voies du traitement des nombres : un code non verbal qui impliquerait le sillon intrapariétal bilatéralement et un code verbal impliquant les aires classiques du langage dont le gyrus angulaire gauche [4]. Le code verbal permet des opérations faisant intervenir la mémoire verbale, comme l’addition à un chiffre ou la multiplication (tables apprises par cœur). À l’opposé, nous n’apprenons pas de « table de soustraction », mais la soustraction requiert la manipulation de quantités dans un format non verbal. La région du sillon intrapariétal que nous avons observée pourrait sous-tendre lareprésentation de la relation de proximité existant entre les quantités numériques dans un format non verbal sur une « ligne numérique » mentale [6]. L’insertion de cette région, au sein des autres régions visuo-spatiales, s’accorde pleinement avec l’hypothèse d’une représentation mentale interne de l’espace numérique.
L’étude des intersections entre les autres tâches a permis de révéler une organisation fonctionnelle systématique avec successivement dans le sens antéro-postérieur des régions spécifiques à la préhension manuelle, aux tâches manuelles, aux tâches visuospatiales, à l’attention visuelle et aux saccades oculaires.
Cette organisation observée chez l’humain nous a permis de proposer quelques homologies avec celle du cortex pariétal du singe. Celles-ci restent très hypothétiques, car ni les tâches ni les méthodes de recueil des données ne sont directement comparables à celles qui sont pratiquées chez le singe. Cependant, la portion antérieure du lobe pariétal activée spécifiquement pour la préhension manuelle pourrait correspondre à l’aire antérieure intrapariétale (AIP) du singe, dont les neurones entrent en activité, notamment quand il attrape et manipule des objets [7]. Nous avons aussi observé une activation préfrontale inférieure bilatérale qui pourrait être l’homologue de la région F5 du singe impliquée dans l’exécution et la reconnaissance des actions [8]. Ce circuit fronto-pariétal pourrait être impliqué dans le guidage visuel des mouvements manuels.
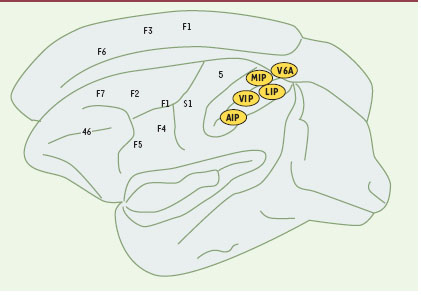
La région pariétale antéro-supérieure gauche activée spécifiquement lors des tâches manuelles pourrait être l’homologue de l’aire médiane intrapariétale (MIP) du singe qui joue un rôle dans la perception de l’espace péri-personnel en termes d’accessibilité par le bras ou par un outil [9, 10] (Figure 2) . À travers ses connexions avec les aires pariétales postérieures (V6A et LIP), et le cortex prémoteur, l’aire MIP joue un rôle capital dans la direction spatiale des mouvements de la main [11]. Cette fonction est clairement requise durant la tâche de pointage mais aussi probablement durant la tâche de préhension. L’autre région située dans le lobule pariétal supérieur et spécifique à ces tâches manuelles pourrait correspondre à l’aire PE du singe qui est impliquée dans l’élaboration des informations proprioceptives [8].
| Figure 2. Organisation des aires pariétales chez le singe macaque (d’après [8]). Les aires AIP, 5/MIP et LIP sont des homologues plausibles des régions observées respectivement dans la préhension, les mouvements de la main et les saccades chez l’homme. |
Les tâches d’attention et de saccades activent de façon commune la partie dorsale bilatérale du lobe pariétal. Ces deux tâches activent aussi de façon conjointe les deux champs oculomoteurs frontaux et supplémentaires, démontrant ainsi la relation étroite existant entre l’attention et les mouvements oculaires. Une région spécifique aux saccades oculaires a également été observée de façon bilatérale dans la partie postérieure du lobe pariétal et dans le précunéus gauche. Ces régions, significativement plus activées dans les saccades, l’attention ou les deux, pourraient être les homologues des régions pariétales postérieures du singe (7a, latérale intrapariétale [LIP], V6, V6a, et Pec). Toutes ces aires contiennent des neurones impliqués dans le codage de stimulus visuels dont l’activité est modulée selon que l’animal se prépareou non à faire un mouvement vers ces stimulus [8, 12].
L’aire activée conjointement par les quatre tâches visuo-spatiales, située dans la partie postérieure du lobule pariétal supérieur, pourrait correspondre à l’aire V6a du singe qui est sélective pour les mouvements de la main et des yeux. L’agencement topographique des aires MIP et V6a, chez le macaque, correspond respectivement à celui de nos régions spécifiques aux tâches manuelles et visuo-spatiales.
Concernant la région spécifique aux saccades oculaires, elle pourrait correspondre au complexe V6 du singe, région visuelle de haut niveau, où l’activité neurale est fortement modulée par la position des yeux. La région intrapariétale postérieure bilatérale correspondrait alors au champ oculomoteur postérieur, homologue des aires LIP du singe [13].
Notre étude a donc permis d’identifier deux aires intrapariétales associées à des fonctions particulièrement développées dans l’espèce humaine : le calcul et la manipulation des sons du langage. Ces aires sont entourées par des aires visuo-spatiales plausiblement homologues aux régions AIP, MIP, V6A et LIP du singe. L’évolution de l’espèce humaine s’est accompagnée d’une expansion et d’une différenciation considérable du lobule pariétal inférieur. Nos données suggèrent que les aires AIP et LIP se sont progressivement séparées dans l’espace cortical du fait d’une expansion du lobule pariétal inférieur où les activations en relation avec les capacités de calcul et de langage ont été observées.
Certains animaux montrent des capacités rudimentaires de calcul [6]. Nos résultats suggèrent qu’un précurseur évolutionniste des processus de calcul chez le primate, s’il existe, pourrait se situer dans la partie antérieure du sillon intrapariétal. Tout récemment, une équipe japonaise vient de confirmer cette prédiction en enregistrant, dans cette région, des neurones qui répondent spécifiquement à un nombre approximatif d’actions [14]. Ainsi, même dans les fonctions cognitives de haut niveau comme le calcul, de profondes homologies peuvent être mises en évidence dans l’organisation du cerveau des primates humains et non humains. En dépit d’importantes variations de surface corticale, l’organisation géométrique des aires cérébrales paraît en grande partie similaire.