Même si les connaissances sur la physiopathologie de la maladie d’Alzheimer ont beaucoup progressé depuis une dizaine d’années, les mécanismes causals de cette pathologie sont loin d’être élucidés. La connaissance des différents facteurs de risque de cette maladie reste donc primordiale dans le but non seulement de mieux comprendre la pathogénie de la maladie mais aussi de la prévenir afin d’en diminuer l’incidence.
Il convient tout d’abord de bien différencier les maladies d’Alzheimer précoces, d’origine surtout génétique, des formes sporadiques plus tardives. Certaines formes de maladie d’Alzheimer peuvent en effet être attribuées à des mutations génétiques, identifiées au niveau des chromosomes 21, 14 ou 1. Ces mutations sont responsables des formes précoces de maladie d’Alzheimer, survenant bien avant 65 ans, mais ne représentant au total que moins de 5 % des cas.
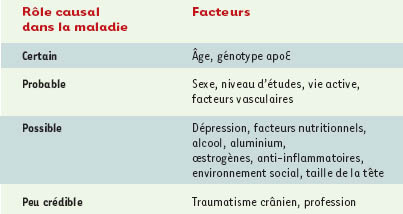
Nous ne développerons ici que les facteurs de risque de maladie d’Alzheimer sporadiques, qui surviennent plus tardivement dans la vie (après 65 ans), et représentent la grande majorité des cas. Plusieurs facteurs de risque ont été identifiés, ou tout au moins suspectés, à partir d’études épidémiologiques, révélant que la maladie d’Alzheimer est, en fait, une pathologie multi-factorielle, faisant intervenir une combinaison de facteurs à la fois individuels (avec probablement des prédispositions génétiques) et environnementaux, l’ensemble de ces facteurs interagissant.
L’âge
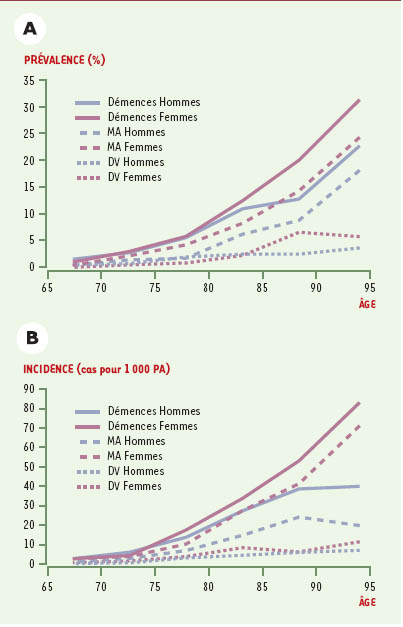
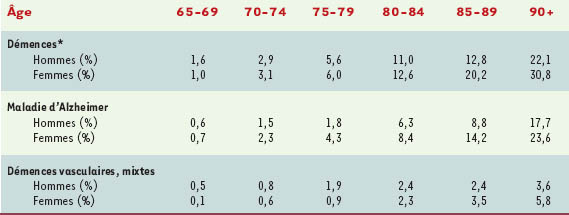
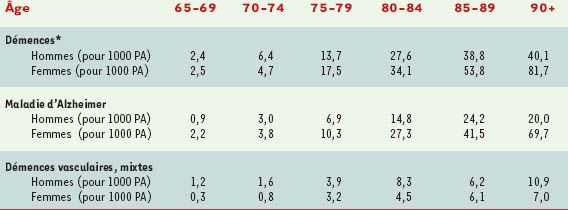
Il s’agit sans conteste du principal facteur de risque de maladie d’Alzheimer comme nous l’avons vu plus haut [
5], l’incidence doublant pratiquement par tranche d’âge de 5 ans après 65 ans.
Le sexe féminin
Les femmes ont un risque plus élevé de développer une maladie d’Alzheimer que les hommes [
4], particulièrement après l’âge de 80 ans [
6]. Dans l’étude Paquid, l’incidence de la maladie d’Alzheimer était, avant 80 ans, plus élevée chez les hommes que chez les femmes, alors que c’est l’inverse après 80 ans. Cette différence d’incidence en fonction du sexe pourrait être expliquée par des différences biologiques et hormonales, avec notamment un possible effet des œstrogènes (
voir plus loin), mais également des différences socio-culturelles. L’espérance de vie, plus élevée chez les femmes que chez les hommes, pourrait également expliquer les résultats observés, en supposant que les hommes, dont la longévité est accrue, sont plus résistants aux maladies neurodégénératives. Il faut noter que dans certains pays comme les États-Unis où cet écart d’espérance de vie entre hommes et femmes est moindre, l’incidence de la maladie d’Alzheimer ne varie pas selon le sexe [
7].
Les facteurs génétiques
Ces facteurs sont également reconnus comme des déterminants de démence, en particulier de la maladie d’Alzheimer, mais un seul fait l’objet d’un consensus général, en dehors des formes héréditaires autosomiques dominantes : la présence de l’allèle ε4 du gène codant pour l’apolipoprotéine E, qui comporte trois allèles, ε2, ε3, ε4 (
voir l’article de Marie-Christine Chartier-Harlin
et al. p. 709 de ce numéro). Dans la méta-analyse publiée en 1997 [
8], le risque relatif de développer une maladie d’Alzheimer selon la combinaison allélique du gène codant pour l’apolipoprotéine E a été évalué, enprenant comme référence les sujets homozygotes ε3ε3. Ce risque chez les sujets de race caucasienne est de 3,2 pour les sujets ε3/ε4 et de 14,9 pour les homozygotes ε4ε4, alors qu’il est de 0,6 pour les sujets ε2ε2 ou ε2ε3, et de 2,6 pour les sujets ε2ε4. L’impact est moindre chez les sujets d’origine africaine ou amérindienne et plus important chez les asiatiques. L’effet de l’allèle ε4 est présent à tout âge, de 40 à 90 ans, mais bien moindre après 70 ans.
Les antécédents familiaux de démence
Plusieurs études, essentiellement transversales, ont mis en évidence un risque accru de maladie d’Alzheimer chez les sujets ayant un parent au premier degré atteint de cette pathologie [
9]. Le risque relatif a été estimé entre 2 et 4 par rapport aux sujets n’ayant pas d’antécédents familiaux de maladie d’Alzheimer. Cependant, dans le cadre d’Eurodem, une nouvelle analyse des données groupées de plusieurs grandes cohortes européennes prospectives en population n’a pas retrouvé cette association [
10]. Ce facteur de risque reste donc controversé dans les formes tardives de maladie d’Alzheimer.
Le niveau d’éducation
La plupart des études réalisées à partir de données d’incidence observe une association entre un niveau bas d’éducation et un risque accru de maladie d’Alzheimer [
4,
11], même si certains auteurs ne retrouvent pas d’association. Ce serait plus le niveau d’éducation atteint que le nombre d’années d’études qui interviendrait. Dans l’étude Paquid, nous avons montré que ce qui différenciait les sujets était l’obtention ou non du certificat d’études primaires, et les sujets n’ayant pas atteint ce niveau présentaient un risque accru de développer une démence (RR = 1,83) et
/ou une maladie d’Alzheimer (RR = 1,81). Il est intéressant de noter que cet effet du niveau d’éducation n’explique pas le risque accru de maladie d’Alzheimer chez les femmes âgées de plus de 80 ans, puisque, dans cette génération, le niveau d’études des femmes était beaucoup plus faible que celui des hommes. Les sujets ayant atteint le certificat d’études pourraient avoir une capacité de réserve cérébrale leur permettant de mieux résister à la maladie, et d’en différer ainsi de 4 à 5 ans l’expression clinique .
La taille de la tête
Plusieurs études récentes ont mis en évidence une association entre petite taille du périmètre crânien et risque accru de maladie d’Alzheimer, persistant après ajustement sur différents facteurs pouvant introduire un biais dans la relation [
12]. Par ailleurs, une petite taille cérébrale a également été associée à un début plus précoce de la maladie [
13]. La croissance de la boîte crânienne est complète à la fin de la première année de la vie et dépend de la taille du cerveau à ce moment. Peut-être une population neuronale plus importante dans des cerveaux de plus grande taille tissant plus de connextions cérébrales, protégerait contre - ou retarderait le début de - la maladie d’Alzheimer. Cependant, ces résultats sont encore préliminaires et devront être confirmés dans des études de cohortes prospectives en population
2.
Activités de loisirs
La pratique d’activités comme le jardinage, les voyages, le bricolage ou le tricot, est également associée à un risque moindre de démence et de maladie d’Alzheimer [
14]. Là encore, la pratique de ces activités, qui ont en commun la nécessité de planifier les tâches, pourrait constituer un entraînement et permettre au sujet de maintenir ses capacités et de retarder ainsi l’apparition de la démence. Cependant, l’absence d’activités de loisirs pourrait n’être aussi qu’un signe très précoce de la maladie.
Statut matrimonial et environnement social
Des associations ont été mises en évidence entre risque de démence et/ou de maladie d’Alzheimer, statut matrimonial [
15], et importance du réseau social [
16]. Les sujets célibataires ou vivant seuls ont un risque double de développer une démence, comparés à ceux qui vivent en couple, et un faible réseau social accroît également le risque de démence de 60 %. La stimulation cognitive, au sein du couple ou d’un réseau social plus développé, protègerait contre, ou retarderait la phase clinique de la démence. D’où l’importance du maintien d’une vie harmonieuse chez les sujets âgés.
Les antécédents de traumatismes crâniens
L’association entre démence et traumatisme crânien est largement controversée. Si des études ont mis en évidence un risque augmenté de maladie d’Alzheimer chez les sujets ayant des antécédents de traumatismes crâniens [
17], d’autres n’ont pas retrouvé cette association [
18]. En outre, certains auteurs ont mis en évidence une interaction avec le gène codant pour l’apolipoprotéine E, l’effet du traumatisme crânien étant majoré chez les sujets porteurs de l’allèle ε4 [
17]. Cependant, la plupart de ces études sont des études transversales sur des cas prévalents de démence et, ici encore, les résultats obtenus à partir des données d’incidence en population des études Eurodem et de Rotterdam [
19] n’ont retrouvé aucune association significative entre traumatisme crânien et risque de maladie d’Alzheimer ou de démence, ni d’interaction entre traumatisme crânien et apolipoprotéine E [
19].
La dépression
Tony Jorm [
20] vient de publier une remarquable revue de la littérature sur l’association entre dépression et démence. Si cette association est confirmée par cette revue avec un risque relatif de 1,16 à 3,50 pour les études cas-témoins et de 1,08 à 3,20 pour les études de cohorte, l’auteur pose le problème de l’interprétation de cette association. Selon lui, 6 hypothèses sont envisageables : (1) les traitements antidépresseurs sont des facteurs de risque de démence ; (2) la démence et la dépression ont des facteurs de risque communs ; (3) la dépression est un syndrome prodromique de la démence ; (4) la dépression est réactionnelle à des troubles cognitifs précoces ; (5) la dépression abaisse le niveau de détection de la démence (cognitif ou fonctionnel) ; (6) la dépression est un facteur causal de la démence. Les quatre dernières hypothèses paraissent les plus crédibles selon Tony Jorm. Cette discussion est exemplaire et pourrait s’appliquer à beaucoup de facteurs de risque.
Consommation de vin et autres facteurs diététiques
Une consommation modérée de vin pourrait avoir un effet protecteur sur la survenue d’une démence ou d’une maladie d’Alzheimer [
21]. Le risque relatif associé à une consommation de 2 à 4 verres de vin par jour a été estimé à 0,28 pour la maladie d’Alzheimer. La mise en évidence d’une telle association incite à la prudence en raison des risques pour la santé publique qu’elle pourrait provoquer, particulièrement par ses effets néfastes possibles sur la prévention de l’alcoolisme. Les données de l’étude Paquid ont été analysées une seconde fois par un épidémiologiste américain reconnu [
22] en tenant compte de tous les facteurs d’ajustement possibles inclus dans les données de la cohorte, en particulier les performances cognitives initiales, ainsi que de la technique d’échantillonnage : les résultats se sont révélés identiques. Plusieurs mécanismes protecteurs peuvent être évoqués : un rôle anti-oxydant de certains composants du vin, notamment les tannins, ou un effet pseudo-œstrogène de l’alcool ; d’autres facteurs pourraient également intervenir, notamment la convivialité associée à une consommation modérée de vin au cours de repas équilibrés. Ces résultats viennent d’être confirmés par la cohorte de Rotterdam, et il semble que ce soit non la consommation de vin mais plutôt à celle d’alcool qui intervienne [
23]. Quoiqu’il en soit, ces études d’observation ne permettent pas de conclure formellement à un lien de causalité. D’autres facteurs diététiques, comme la consommation de poisson [
24] ou d’anti-oxydants, seraient aussi associés à un risque moindre de maladie d’Alzheimer, des résultats qui nécessitent aussi une confirmation.
Composition de l’eau de boisson
L’hypothèse d’une relation entre taux élevé d’aluminium et risque de démence est ancienne, fondée sur la neurotoxicité de l’aluminium. Cependant, cette relation était jusqu’à présent très controversée [
25,
26]. Des résultats récents de l’étude Paquid montrent qu’il existe effectivement une association entre un taux élevé d’aluminium dans l’eau de boisson (> 100 µg/litre) et un risque accru de maladie d’Alzheimer, avec un risque relatif (RR) de 2 [
27]. Cependant, ces résultats sont encore préliminaires, obtenus à partir d’un petit nombre de cas, et doivent être confirmés. Si une telle association existe réellement, des mesures pourraient être prises (modification du traitement de l’eau notamment), permettant de réduire l’incidence de la maladie d’Alzheimer.
Les œstrogènes
Le traitement substitutif de la ménopause par œstrogénothérapie a été associé à un risque moindre de développer une maladie d’Alzheimer [
28,
29]. Cet effet protecteur des œstrogènes pourrait être expliqué par des effets à la fois neurotrophiques et neuroprotecteurs, ainsi que par une amélioration de la circulation cérébrale. Cependant, comme nous l’avons vu, ces études d’observations ne permettent pas de conclure formellement au rôle bénéfique des œstrogènes, et il nous faudra donc attendre le résultat des études de prévention randomisées qui sont actuellement conduites.
Anti-inflammatoires non stéroïdiens (AINS)
Plusieurs études ont montré une association entre consommation d’AINS et risque moindre de maladie d’Alzheimer [
30,
31]. Les AINS pourraient agir par le biais d’une diminution des phénomènes d’inflammation survenant dans la maladie d’Alzheimer, et offrent donc des pistes de prévention intéressantes. Mais, comme pour les œstrogènes, il faut attendre les études de prévention pour conclure.
Les facteurs vasculaires
Si l’association entre facteurs vasculaires et démences de type « vasculaires » - dont un des facteurs de risque majeur est l’hypertension artérielle - est prouvée, celle qui existerait entre facteurs vasculaires et maladie d’Alzheimer est en revanche moins claire. Alors que dans les années 1980, les critères permettant de porter un diagnostic de maladie d’Alzheimer probable excluaient toute pathologie vasculaire, la place des facteurs de risque vasculaires a été récemment à nouveau évoquée dans la survenue d’une maladie d’Alzheimer. L’hypertension artérielle et l’athérosclérose semblent en effet associées à un risque accru de survenue d’une maladie d’Alzheimer [
32], et le traitement de l’hypertension artérielle pourrait entraîner une réduction importante de l’incidence de la maladie [
33]. Le diabète majorerait également d’un facteur 1,9 le risque de survenue d’une maladie d’Alzheimer [
34]. En ce qui concerne la consommation tabagique, les premières études montraient qu’elle avait un effet protecteur sur la survenue d’une démence et/ou d’une maladie d’Alzheimer [
35]. L’explication proposée était alors que la nicotine contenue dans le tabac compensait le déficit cholinergique existant dans la maladie d’Alzheimer, en stimulant les récepteurs cholinergiques nicotiniques. Ces résultats, obtenus à partir d’études castémoins sujettes à de nombreux biais dans l’analyse des facteurs de risque de démence, n’ont pas été confirmés, bien au contraire, par des études de cohortes prospectives en population [
36]. Des résultats inverses ont été observés, avec un effet néfaste de la consommation tabagique sur la survenue d’une maladie d’Alzheimer (RR = 2,3). Enfin, les données sur une éventuelle corrélation entre les marqueurs biologiques du métabolisme lipidique et le risque de maladie d’Alzheimer sont encore très controversées. Nous avons par exemple observé, dans une étude cas-témoins incluse dans la cohorte Paquid, une relation inverse entre la concentration de cholestérol HDL (
high density lipoprotein) et le risque de démence, avec un risque relatif de 0,1 chez les sujets ayant une concentration d’HDL-C dans le quartile supérieur de la distribution [
37]. Ce résultat est impressionnant, mais doit absolument être confirmé pour être crédible.
En fait, trop peu d’études ont à l’heure actuelle mis clairement en évidence une relation entre facteurs vasculaires et démence ou maladie d’Alzheimer ; cette relation reste donc encore à démontrer avant de pouvoir évaluer l’impact réel des facteurs vasculaires sur la survenue d’une démence.