| |
| Med Sci (Paris). 2002 August; 18(8-9): 861–873. Published online 2002 August 15. doi: 10.1051/medsci/20021889861.Implications physiopathologiques des altérations des gènes impliqués dans la régulation de la mort cellulaire Éric Solary,* Ali Bettaieb, Laurence Dubrez-Daloz, and Carmen Garrido Inserm U.517, IFR 100, EPHE, UFR de Médecine/Pharmacie, 7, boulevard Jeanne d’Arc, 21000 Dijon, France |
Un dérèglement des voies apoptotiques est incriminé dans la physiopathologie de nombreuses maladies humaines. L’apparition de cellules tumorales ou la persistance de clones lymphocytaires auto-réactifs peuvent être la conséquence, au moins en partie, d’un défaut dans le processus conduisant à la mort cellulaire. Au contraire, une mort excessive des cellules neuronales est observée dans certaines maladies neurodégénératives comme l’amyotrophie spinale et la chorée de Huntington. Dans cet article de synthèse, nous nous intéresserons aux dérèglements de l’apoptose induits par l’altération d’un gène codant pour une protéine de la « machinerie apoptotique ». Les mutations identifiées jusqu’à maintenant sont en nombre relativement limité. Un certain nombre d’entre elles sont des mutations somatiques et clonales qui contribuent à la tumorigenèse ou à la progression tumorale. Il peut s’agir d’une altération soit de la séquence d’un gène (bax, p53), soit de l’expression d’un gène, conséquence d’une translocation chromosomique (bcl-2, B-cell leukemia/lymphoma-2) ou d’une hyperméthylation de son promoteur (CASP-8, Apaf-1, DAP- kinase). Parfois, les deux anomalies sont associées, par exemple lorsqu’une translocation provoque la surexpression d’une protéine tronquée (c-IAP2, Bcl-10). D’autres sont des mutations germinales, le plus souvent responsables d’affections lymphoprolifératives et neuro-dégénératives. Cette atteinte préférentielle des cellules du système lymphoïde et des cellules neuronales reflète l’importance de la mort cellulaire programmée au cours du développement normal des tissus lymphoïde et nerveux. On notera aussi que les mutations identifiées touchent plus fréquemment les voies de signalisation en aval des récepteurs à domaine de mort, que la voie mitochondriale de l’apoptose. Certaines des altérations génétiques de la voie mitochondriale sont probablement trop délétères pour être compatibles avec la survie (c’est le cas des souris dont les gènes caspase 3 ou caspase 9 ont été invalidés). D’autres pourraient être compensées par la redondance des voies de signalisation et, de ce fait, être masquées. L’amyotrophie spinale est un cas particulier : la mutation du gène naip (codant pour une protéine inhibitrice des caspases) n’est pas directement responsable de la maladie, mais aggrave son phénotype. |
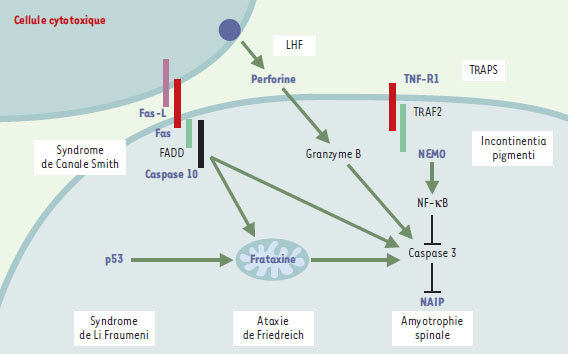
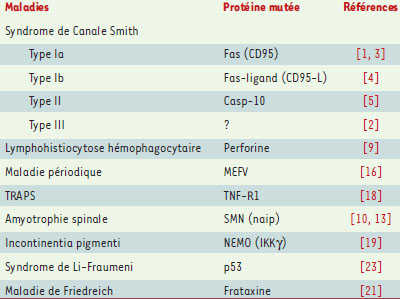
L’exemple des altérations génétiques de la voie Fas (CD95)/Fas-L, responsables du syndrome de Canale-Smith est, à l’heure actuelle, celui qui illustre le mieux les conséquences pathologiques qu’entraîne l’altération génique d’une des voies de signalisation conduisant à l’apoptose. Ce ne sont pas les seules mutations qui touchent les voies de signalisation impliquant les récepteurs de mort puisque des mutations du récepteur TNF-R1, et des altérations des voies d’activation du facteur de transcription NF-κB qui lui sont associées, expliquent certaines maladies héréditaires. Enfin, certaines altérations géniques touchent des protéines dont le rôle dans le contrôle de la mort cellulaire est encore mal défini et semble spécifique de certains tissus. Sans prétendre à l’exhaustivité, nous envisagerons les principales affections d’origine génétique dans lesquelles, en l’état actuel des connaissances, l’altération du processus conduisant à l’apoptose semble jouer un rôle physiopathologique essentiel (Tableau I, Figure 1). 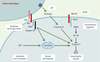 | Figure 1. Mutations germinales des gènes impliqués dans le contrôle de la mort cellulaire. Les protéines dont la mutation germinale a été identifiée sont représentées en bleu (gras). LHF : lymphohistiocytose hémophagocytaire familiale. TRAPS : TNF-receptor associated periodic syndrome, une variante de la maladie périodique. M : mitochondrie. Les protéines MEFV (maladie périodique) et SMN1 (amyotrophie spinale) ne sont pas représentées car leur place exacte dans le schéma des voies apoptotiques est encore mal définie. Les mutations de naip ne sont pas directement responsables de l’amyotrophie spinale mais aggravent le phénotype de la maladie due à des mutations de SMN1. |
 | Tableau I. Mutations germinales des gènes impliqués dans la régulation de la mort cellulaire et maladies associées. |
Le syndrome de Canale-Smith Le syndrome de Canale-Smith, encore appelé syndrome auto-immun lymphoprolifératif (ALPS, auto-immune lymphoproliferative syndrome), est une affection héréditaire rare se traduisant par l’apparition, chez l’enfant, d’adénopathies, d’une splénomégalie, d’une hypergammaglobulinémie et de manifestations auto-immunes. Les manifestations liées à la prolifération lymphoïde disparaissent le plus souvent avec l’âge, mais les manifestations auto-immunes persistent. Il existe une augmentation du nombre des lymphocytes T CD4 -CD8 -, notamment dans les ganglions et dans la rate. Dans la plupart des familles, cette maladie se transmet sur un mode dominant à pénétrance variable, évoquant l’existence de facteurs génétiques modulateurs [ 1]. Un syndrome similaire est observé dans certaines souches de souris [2] dont l’analyse a permis d’identifier une mutation homozygote soit de Fas (souche lpr), soit de son ligand (souche gld). Chez l’homme, une mutation, le plus souvent hétérozygote, du gène APT1 codant pour Fas et situé sur le chromosome 10q24.1 est présente chez un certain nombre de malades [3]. Lorsque le syndrome de Canale-Smith est la conséquence d’une mutation de Fas, on parle d’ALPS de type Ia. Chez ces malades, le syndrome lymphoprolifératif et la persistance de clones auto-immuns s’expliquent par la diminution de l’apoptose des lymphocytes dépendante de Fas. Des facteurs génétiques ou environnementaux contribuent au phénotype puisque les parents, hétérozygotes pour le gène Fas muté, sont souvent asymptomatiques [1]. Une mutation du gène codant pour le ligand de Fas (Fas-L) sur le chromosome 1q23 est responsable de l’ALPS de type Ib associant adénopathies et lupus érythémateux disséminé. En fait, une mutation germinale de Fas-L n’a été identifiée que chez un seul des 75 patients examinés atteints de lupus. Il s’agissait d’une délétion de 84 pb dans l’exon 4 du gène Fas-L qui induisait une diminution de l’activité cytotoxique des lymphocytes T, perturbant l’élimination des lymphocytes activés et stimulant leur prolifération. La mutation germinale de Fas-L ne semble donc impliquée que chez une minorité de patients atteints de lupus érythémateux disséminé. Cela n’exclut pas le rôle éventuel de mutations somatiques du gène Fas-L dans certains des clones auto-réactifs qui contribuent à l’expression de la maladie [4]. L’ALPS de type II est attribué à des mutations du gène CASP10 sur le chromosome 2q23. Le déficit de l’apoptose des lymphocytes dépendante du Fas est un peu moins important que dans l’ALPS de type Ia. Ces mutations altèrent la sous-unité p17 de la pro-caspase 10 [5]. La pro-caspase 10 intervient au début du processus apoptotique. Elle peut être recrutée via la molécule adaptatrice FADD (fas-associated death domain) par les récepteurs de mort au sein du complexe appelé DISC (death inducing signaling complex), ce qui induit son auto-activation par clivage. Les mutations de la pro-caspase 10 ne préviennent pas son recrutement au sein du DISC, mais inhibent son auto-activation. Elles ont un effet dominant négatif sur les étapes de la signalisation intracellulaire en aval des récepteurs à domaine de mort. Une particularité de l’ALPS de type II est l’accumulation de cellules dendritiques dans les ganglions. Ces cellules sont habituellement sensibles à TRAIL (tumor necrosis factor-related apoptosis-inducing ligand/Apo-2) mais résistantes au ligand de Fas et au TNFα. La mutation de la caspase 10 les rend résistantes à TRAIL et provoque leur accumulation. Ces cellules dendritiques pourraient exacerber les manifestations auto-immunes de la maladie par leur interaction avec les lymphocytes T et B. Ces résultats suggèrent aussi l’importance de la voie TRAIL/caspase 10 dans l’élimination des cellules dendritiques [5]. L’ALPS de type III rassemble tous les patients chez lesquels les manifestations cliniques et biologiques permettent de poser le diagnostic d’ALPS sans que l’on ait pu identifier de mutation des gènes codant pour Fas, pour son ligand ou pour la caspase 10. Un tableau clinique très voisin mais sans accumulation de cellules T CD4-CD8- a également été décrit. Les cellules T sont le plus souvent résistantes à l’apoptose, non seulement celle qu’induit Fas, alors qu’il n’existe pas de mutation de Fas, mais aussi celle qu’induit le céramide [6]. Alors que Fas est exprimé dans la plupart des tissus, il est intéressant d’observer que les patients atteints d’ALPS souffrent essentiellement de manifestations liées au dérèglement de l’homéostasie lymphocytaire. Les mécanismes qui conduisent à l’accumulation de cellules T CD4-CD8- et aux manifestations auto-immunes sont encore controversés. On a incriminé un défaut d’élimination des lymphocytes activés (AICD : activation induced cell death), qui repose en partie sur le système Fas-L/Fas. Cependant, si l’AICD est ralentie, elle n’est pas inhibée chez la souris lpr exposée à des superantigènes. Cela est dû au fait que d’autres molécules sont impliquées dans l’AICD, principalement le TNFα, le système perforine/granzyme et les radicaux libres oxygénés [7]. Il est possible aussi que l’altération de la voie de signalisation impliquant Fas, FADD et la caspase 10 perturbe la différenciation et la prolifération lymphocytaires. En effet, la molécule adaptatrice FADD et certaines caspases ont été impliquées dans ces processus et les thymocytes des souris FADD−/− s’accumulent à un stade immature CD4-CD8- [8]. La lymphohistiocytose hémophagocytaire familiale Cette affection autosomique récessive touche 1 enfant sur 50 000. Elle se traduit par l’apparition, chez de très jeunes enfants, d’une fièvre associée à une hépatosplénomégalie, une pancytopénie, une hypertriglycéridémie, une hypofibrinogènémie et des troubles neurologiques sévères. La concentration sérique de cytokines pro-inflamma-toires, IFNγ , IL-1, IL-6 et TNFα est augmentée. Une caractéristique histologique de l’affection est ’accumulation de macrophages et de lymphocytes activés, principalement des lymphocytes T, CD8 +, HLA-DR +, Fas +, avec images d’hémophagocytose dans la moelle osseuse, la rate, le foie, les ganglions et le système nerveux central. On observe, chez ces malades, un défaut d’activité cytotoxique des lymphocytes T et des cellules natural killer (NK) mais la cytotoxicité dépendante de Fas reste fonctionnelle. Sur le plan génétique, la maladie est hétérogène puisqu’au moins deux locus ont été impliqués, en 9q21.3-22 et 10q21-22 [ 9]. Le gène codant pour la perforine a été localisé en 10q21-22, et des mutations du gène de la perforine ont été identifiées chez 8 patients atteints de lymphohistiocytose hémophagocytaire familiale liée au chromosome 10q21-22. La perforine joue un rôle important dans l’activité cytotoxique des cellules T et NK. Elle est stockée dans les granules de ces cellules et, une fois libérée, elle induit la formation de pores dans la membrane des cellules cibles. Elle facilite ainsi la pénétration, dans les cellules cibles, de sérine protéases, les granzymes. Le granzyme B peut induire une apoptose rapide en activant directement les caspases, en particulier la caspase 3. Les lymphocytes T CD8+ des patients atteints de lymphohistiocytose hémophagocytaire familiale ont une activité cytotoxique réduite vis-à-vis de cellules murines dépourvues de Fas. La maladie se révèle en général à l’occasion d’une infection, probablement du fait de la capacité réduite des lymphocytes T et des cellules NK du patient d’induire l’apoptose des cellules infectées [9]. La maladie périodique et le gène MEFV La maladie périodique, appelée fièvre familiale méditerranéenne par les Anglo-Saxons, est une maladie inflammatoire héréditaire caractérisée par des épisodes de fièvre associés à des manifestations inflammatoires aiguës des séreuses et des synoviales (→). Comme son nom l’indique, elle touche principalement les sujets originaires du pourtour de la Méditerranée. Le gène responsable, appelé MEFV, a été cloné en 1997 et localisé sur le chromosome 11q13.3 [ 10]. (→) m/s 2001, n°10, p. 1008 Plusieurs mutations de ce gène ont été identifiées chez les patients atteints de fièvre familiale méditerranéenne. La protéine correspondante, appelée pyrine ou marénos-trine, est localisée notamment dans le cytoplasme des polynucléaires neutrophiles et des monocytes. Son expression augmente dans les cellules exposées à des cytokines pro-inflammatoires comme le TNFα et l’IFNγ. La fonction de la pyrine est mal connue. Elle contient un domaine amino-terminal appelé domaine pyrine (PyD). Ce domaine appartient à une famille de domaines d’interaction protéine-protéine (death-domain fold) impliqués dans plusieurs cascades apoptotiques et comportant les domaines de mort (DD : death domain), les domaines effecteurs de mort (DED : death effector domain) et les CARD (caspase recruitment domain). Le domaine PyD interagit avec un domaine équivalent de la protéine ASC (apoptosis associated speck-like protein containing a CARD). ASC est une protéine cytosolique qui contient, non seulement un domaine PyD, mais aussi un domaine CARD et peut former des agrégats dans le cytosol des cellules exposées à un agent cytotoxique, contribuant ainsi à la mise en jeu de la machinerie apoptotique [11]. L’implication de la pyrine dans la modulation de l’apoptose via ASC pourrait expliquer en partie la physiopathologie de la maladie périodique, la mutation de la pyrine altérant le contrôle de la réponse inflammatoire en interférant avec l’apoptose des polynucléaires neutrophiles. Il existe d’autres fièvres périodiques héréditaires. L’une d’elles, appelée TRAPS (TNF-receptor associated periodic syndrome), est associée à des mutations du gène codant l’un des deux récepteurs du TNFα, TNF-R1 [12]. Le TNFα est une cytokine produite principalement par les macrophages activés en réponse à une infection. Ses effets biologiques sont multiples : elle stimule la synthèse de cytokines par les cellules immunitaires, provoque de la fièvre, induit l’expression, par les cellules endothéliales, de molécules d’adhérence pour les leucocytes, et peut avoir un effet cytotoxique en activant la machinerie apoptotique. Deux récepteurs du TNFα ont été identifiés et sont exprimés par la plupart des cellules. TNF-R1 (CD120a ; p55) relaye l’effet cytotoxique du TNFα, TNF-R2 (CD120b ; p75) semble avoir un rôle complémentaire de celui de TNF-R1. L’effet pro-apoptotique du TNFα implique le plus souvent la trimérisation de TNF-R1 (voire la formation de multimères de plus grande taille), le recrutement des molécules adaptatrices TRADD (TNF-R-associated death domain) puis FADD (Fas-associated death domain) qui, à leur tour, recrutent la pro-caspase 8 ou la pro-caspase 10. D’autres interactions protéiques impliquent notamment les molécules TRAF-2 (TNF-R-associated factor-2) et RIP (receptor interacting protein) et conduisent à l’activation des facteurs de transcription NF-κB et AP-1. Une étude portant sur une quarantaine de familles dans lesquelles une maladie périodique de type TRAPS a été diagnostiquée a révélé six mutations différentes de TNF-R1. Elles affectent le premier ou le second domaine riche en cystéines de la partie extracellulaire du récepteur. Elles n’empêchent pas l’ancrage du récepteur dans la membrane plasmique des leucocytes, mais interfèrent avec la formation de la forme soluble du récepteur, issue du clivage de la forme transmembranaire par une métalloprotéase. Or, cette forme soluble module l’interaction du TNFα avec son récepteur membranaire. La diminution de la concentration plasmatique de la forme soluble de TNF-R1 chez les individus malades pourrait sensibiliser les leucocytes à l’effet pro-apoptotique du TNFα, perturbant ainsi le contrôle de la réponse inflammatoire [12]. Le syndrome de Bloch-Shulzberger (incontinentia pigmenti) Un autre dérèglement génétique des voies de signalisation induites par le TNFα a été récemment incriminé dans la physiopathologie de la maladie de Bloch-Shulzberger. Cette génodermatose de transmission dominante liée à l’X qui touche 1/50 000 enfants [ 13] se traduit par la présence de vésicules cutanées contenant des cellules apoptotiques. Elle évolue vers une pigmentation cutanée anormale : la mélanine infiltre le derme puis est éliminée par les macrophages, laissant la place à des zones hypo-pigmentées. Une alopécie et des lésions dystrophiques des ongles complètent le tableau. La gravité de la maladie est liée au risque de cécité (cataracte, décollement de la rétine), aux lésions du système nerveux central (retard mental et comitialité) et au déficit immunitaire. Cette maladie est due à une mutation du gène NEMO (NF-κB essential modulator) qui code pour la protéine IKKγ impliquée dans la régulation du complexe I-κB/NF-κB. Les mutations du gène NEMO induisent la synthèse d’une protéine tronquée qui provoque l’accumulation de I-κB, laquelle retient NF-κB dans le cytoplasme, prévenant ainsi toute activité transcriptionnelle. Or, le facteur de transcription NF-κB intervient le plus souvent en s’opposant à l’apoptose, par exemple en stimulant l’expression des protéines inhibitrices des caspases appelées IAP (inhibitor of apoptosis protein). En inhibant NF-κB, la protéine NEMO tronquée sensibilise certaines cellules à’apoptose induite par le TNFα et par d’autres cytokines. Le même phénotype est observé chez la souris IKKγ−/−. Alors que les mutations de NEMO sont le plus souvent létales dans le sexe masculin, chez la femme, l’inactivation de l’X module la sévérité de la maladie, à tel point que certaines femmes portant une mutation de NEMO ont un phénotype normal, suggérant qu’une sélection au profit des cellules exprimant l’X normal s’est opérée très tôt au cours du développement. L’intervention de gènes réguateurs modificateurs peut aussi expliquer les variations phénotypiques de la maladie [13]. D’autres maladies génétiques ont été rattachées à un défaut des voies de signalisation impliquant NF-㮫. Certaines formes de la dysplasie ectodermique sont attribuées à une mutation de l’ectodysplasine A (une molécule voisine du TNFα) ou de son récepteur, tandis que l’ostéolyse familiale (FEO, familial expansile osteolysis) est due à des mutations de RANK (receptor activator of NF-κB). Le rôle d’un dérèglement de l’apoptose dans la physiopathologie de ces maladies reste à démontrer [14]. L’amyotrophie spinale L’amyotrophie spinale est une maladie neurodégénérative de transmission récessive autosomique, qui touche 1/10 000 enfants, et se caractérise par la dégénerescence des cellules de la corne antérieure de la moelle épinière. Son expression clinique est hétérogène, et l’on décrit trois phénotypes principaux : le type I, ou maladie de Werdnig-Hoffmann, est la forme la plus sévère puisque les symptômes se manifestent dès la naissance et provoquent la mort avant 2 ans par détresse respiratoire. Le type II se manifeste chez l’enfant en bas âge, capable de s’asseoir mais incapable de se lever ou de marcher. Le type III, ou maladie de Kugelberg-Welander, se manifeste plus tard, à partir de l’âge de 18 mois [ 15]. La région génique impliquée dans la maladie, cartographiée en 5q13.1, contient deux gènes candidats : SMN (survival motor neuron) et naip (neuronal apoptosis inhibitory protein). Il existe deux copies du gène SMN. Les deux allèles de la copie télomérique, SMN1, ont subi une délétion ou sont mutés chez 95 % des malades. Les deux allèles de la copie centromérique, SMN2, qui codent pour une protéine tronquée, sont intacts chez tous les patients. Cependant, il semble que l’augmentation du nombre de copies du gène SMN2 atténue le phénotype de la maladie, à tel point qu’un criblage à haut débit de molécules susceptibles d’activer le gène SMN2 est en cours [16]. La protéine SMN ne présente aucune homologie avec des protéines connues. Très exprimée dans les motoneurones, elle fait partie de complexes multimoléculaires dans le cytoplasme et dans le noyau. Dans le cytoplasme, elle interagit avec Bcl-2 dont elle renforce l’activité anti-apoptotique, propriété qui est perdue chez les sujets malades. Dans le noyau, elle joue un rôle essentiel dans la transcription (interaction avec l’ARN polymérase II) et la maturation (épissage) des ARNm. Le rôle du gène naip, dont il n’existe qu’une seule copie complète en 5q13, est de modifier le phénotype de la maladie. Il existe également une copie tronquée du gène naip, proche de SMN2, mais elle n’est pas impliquée dans la maladie. Les deux allèles du gène sont complètement délétés chez environ 50 % des malades atteints d’amyo-trophie spinale de type I, et 10 à 20 % des malades ayant le type II ou III de la maladie. Dans les types I sans délé-tion du gène naip, l’expression de la protéine est néanmoins altérée du fait de délétions incomplètes ou de mutations. La protéine NAIP appartient à la famille des IAP, que caractérise la présence d’au moins un domaine BIR (baculovirus IAP repeat), une séquence peptidique très conservée d’environ 70 acides aminés. Ce domaine est nécessaire à certaines des IAP pour inhiber les cas-pases 3, 7 et 9 [17]. La protéine NAIP contient, outre ses trois domaines BIR, une séquence consensus P-loop, ce qui suggère une liaison au GTP ou à l’ATP [18]. Elle est exprimée dans certains tissus adultes, en particulier dans le système nerveux central. Si l’invalidation génique de naip n’altère pas le développement du système nerveux, elle rend les neurones de ces souris naip−/− moins résistants à l’apoptose induite par une ischémie que les neurones d’animaux sauvages ; la surexpression de NAIP, en revanche, les protège de l’apoptose post-ischémique in vivo [17, 19, 20]. La perte d’expression de SMN, comme celle de naip1, pourrait, par la disparition d’une activité anti-apopto-tique dans les cellules neuronales, être responsable de la mort par apoptose de certains neurones. L’obtention d’un modèle animal dans lequel SMN1 serait délété, avec ou sans délétion associée de naip, permettrait de clarifier la responsabilité de ces deux gènes et le rôle de l’apoptose dans la maladie. L’ataxie de Friedreich L’ataxie de Friedreich est une maladie neurodégénérative de transmission autosomique récessive qui touche 1/50 000 enfants. Elle est due à la dégénerescence des faisceaux spinocérébelleux, des cordons postérieurs de la moelle épinière et des faisceaux pyramidaux (→). Elle se manifeste entre 6 et 16 ans par une ataxie progressive, associée à une aréflexie, un syndrome pyramidal et une neuropathie axonale sensitive. Une atteinte cardiaque et des anomalies osseuses y sont très fréquemment associées. L’évolution, très lente, provoque le décès entre 40 et 50 ans. Le gène dont la mutation est responsable de la maladie, cloné en 1996 et très conservé à travers les espèces [ 21], code pour une protéine mitochondriale, la frataxine. L’invalidation du gène chez la souris entraîne la mort rapide des embryons in utero, attestant le rôle essentiel de la molécule au cours du développement. Sa fonction a été étudiée chez la levure, organisme dans lequel elle protège la mitochondrie de l’accumulation de fer non héminique. L’absence de frataxine fonctionnelle accroît la toxicité des radicaux libres oxygénés issus du fonctionnement de la chaîne respiratoire. Le rôle anti-apoptotique de cette protéine mitochondriale semble particulièrement important au cours de la différenciation neuronale [ 22]. (→) m/s 2001, n°11, p. 1314 Maladie de Huntington D’autres maladies neuro-dégénératives héréditaires ont été associées à un excès d’apoptose, mais ne sont pas la conséquence de la mutation germinale d’un gène directement impliqué dans le contrôle de la mort cellulaire. Nous ne prendrons qu’un seul exemple, celui de la maladie de Huntington (→). Cette affection est attribuée à la mort apoptotique des neurones du striatum puis du cortex cérébral. Celle-ci est due à l’expansion d’un motif répété (CAG)n situé dans la partie codante du gène de la hun-tingtine et traduit en une répétition polyglutamine. La gravité de la maladie est fonction du nombre de triplets, avec un seuil pathologique aux environs de 40 répétitions. (→) m/s 2001, n°1, p. 57 Plusieurs hypothèses physiopathologiques ont été proposées pour faire le lien entre la séquence polyglutamine et l’apoptose. La plus récente attribue à la protéine anormale une affinité réduite pour un partenaire appelé Hip-1. Ce partenaire interagit alors avec une autre protéine appelée Hippi. Des complexes Hip-1/Hippi se forment dans le cytoplasme. Ces deux protéines possèdent des domaines de type DED-like qui leur permettent de recruter la pro-caspase 8 dont elles entraînent la dimérisation, déclenchant ainsi son activation et celle de la cascade des caspases [23]. L’inhibition des caspases semble ralentir l’évolution de la maladie [24]. |
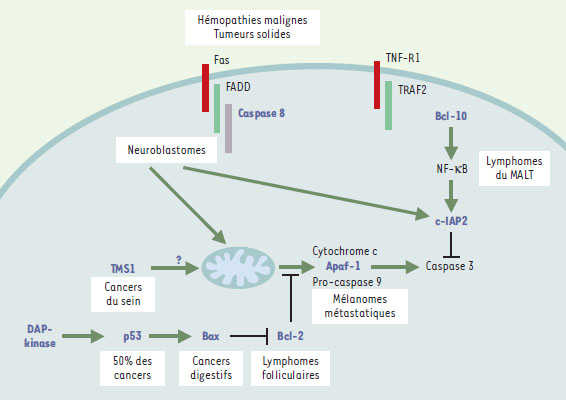
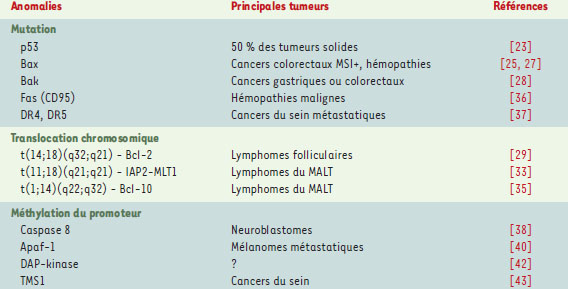
Mutations somatiques identifiées dans les cellules tumorales La résistance des cellules tumorales à l’apoptose contribue à leur accumulation, leur potentiel métastatique, et leur résistance aux agents cytotoxiques. Les protéines dont l’expression anormale induit cette résistance à l’apoptose ont des fonctions variées : détection de dommages cellulaires comme p53, contrôle de la phase mito-chondriale de l’apoptose comme Bcl-2, Bax ou Bak, ou post-mitochondriale comme la molécule adaptatrice Apaf-1, les caspases, les protéines IAP ou Bcl-10. Le dérèglement de leur expression peut être la conséquence d’altérations de leur expression génique (mutations, réarrangements chromosomiques), de modifications épi-génétiques (méthylation de certains promoteurs), ou post-traductionnelles. Dans le cadre de cet article, nous n’évoquerons que les deux premières éventualités (Tableau II, Figure 2). 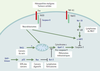 | Figure 2. Mutations somatiques des gènes impliqués dans le contrôle de la mort cellulaire dans les tumeurs humaines. Les protéines dont la mutation somatique a été identifiée dans des cellules tumorales sont représentées en bleu (gras). Les principales tumeurs dans lesquelles ces mutations ont été identifiées sont indiquées à proximité. |
 | Tableau II. Anomalies des gènes réglant la mort cellulaire dans les tumeurs humaines. |
Les altérations de p53 p53 est une protéine nucléaire essentielle au contrôle de la progression dans le cycle cellulaire, de la réparation de l’ADN et de l’apoptose induite par divers stress cellulaires, hypoxie, expression anormale d’un onco-gène et altérations de l’ADN. Le gène suppresseur de tumeur p53 est muté dans la moitié des tumeurs humaines, ce qui souligne son importance dans de nombreux tissus. Cela est confirmé par le fait que les sujets atteints du syndrome de Li-Fraumeni, une affection héréditaire dans laquelle l’un des allèles de p53 est muté, développent très jeunes divers types de tumeurs. Dans les cellules tumorales, l’allèle sauvage de p53 a généralement disparu [ 25]. C’est par sa capacité à activer la transcription du gène p21 que la protéine p53 arrête la progression dans le cycle cellulaire en G1. Cette inhibition de la progression dans le cycle favorise, lorsqu’elle est nécessaire, la réparation de l’ADN. L’activation de l’apoptose par p53 met en jeu des mécanismes indépendants de p21 et qui semblent varier en fonction du type cellulaire. L’activation transcriptionnelle de Bax, une protéine pro-apoptotique de la famille Bcl-2, est l’un des mécanismes les mieux connus, mais elle n’est pas toujours suffisante [26]. D’autres gènes cibles de p53 jouent un rôle dans l’apoptose : il s’agit notamment des gènes PIG (p53 inducible genes) et de celui qui code pour la ferrodoxine, impliqués dans le métabolisme oxydatif. Sont aussi impliqués les gènes codant pour Noxa (une protéine pro-apoptotique de la famille Bcl-2), Apaf-1, les récepteurs de mort Fas et DR5 (un des récepteurs de la cytokine TRAIL), la protéine membranaire PERP (p53 apoptosis effector related to PMP-22) et les protéines mitochondriales p53AIP et PUMA, cette dernière interagissant avec Bcl-2. Leur fonction respective dans l’apoptose induite par p53 est encore mal établie mais chacune de ces cibles transcriptionnelles de p53 contribue à la réponse apoptotique relayée par cette protéine dans un système cellulaire donné. Des mécanismes pro-apoptotiques indépendants de l’activité transcriptionnelle de p53 ont également été décrits [25]. On connaît mal en fonction de quel critère l’activité de p53 s’oriente vers l’arrêt du cycle ou l’induction de l’apoptose. L’apoptose semble prévaloir dans des conditions où les altérations de l’ADN sont sévères, les facteurs de survie limitants, ou lorsqu’un oncogène est activé. Les mutations de p53 observées dans les cellules tumorales sont regroupées dans une région essentielle à la fixation de la protéine à l’ADN. Ces mutations ont été associées à la progression tumorale et à la résistance des cellules tumorales à la chimiothérapie. Les mutations de Bax et de Bak Bax est une protéine proapoptotique, membre de la famille Bcl-2. Les protéines de cette famille contrôlent le relargage de protéines proapoptotiques de l’espace membranaire intermitochondrial vers le cytosol, une étapeclé de la voie mitochondriale de’apoptose. La surexpression de Bax dans des cellules entières ou l’ajout de protéine Bax recombinante à des mitochondries purifiées provoque le relargage du cytochrome c. Le troisième exon codant du gène bax contient une séquence de 8 désoxyguanines, et cette séquence est mutée (ajout ou délétion d’une désoxygua-nine) dans près de 50 % des cancers coliques humains, du moins ceux qui s’accompagnent d’une instabilité des microsatellites (MSI) [ 27]. Ce phénotype MSI est dû à une anomalie des gènes de réparation de l’ADN. L’ instabilité génétique qui en résulte provoque une série de délétions et de mutations dans les séquences répétées appelées microsatellites. Cette instabilité génétique est observée dans tous les cancers colorectaux associés à une polypose rectocolique familiale et dans certains cancers colorectaux sporadiques. Les mutations de la région (G)8 de Bax inhibent l’expression de la protéine. Ces mutations, parfois bi-alléliques, ne sont pas détectées dans les tumeurs qui n’ont pas ce phénotype MSI ; elles sont donc la conséquence des anomalies de réparation de l’ADN, caractéristiques de ce phénotype. Des mutations de séquences (G)8 sont observées dans d’autres gènes (par exemple le récepteur II du TGFβ) [ 28]. Le gène bax est transactivé par la protéine p53, et les cancers MSI+ dans lesquels la mutation de Bax a été détectée expriment généralement une forme sauvage de p53. Dans les cellules tumorales MSI+, caractérisées par des anomalies de réparation de l’ADN, les erreurs de réplication lors de chaque cycle cellulaire devraient conduire à l’activation de l’apoptose par p53. Si p53 transactive un gène bax muté, qui n’est pas traduit en une protéine fonctionnelle, la voie de signalisation aboutissant à la mort cellulaire est, au moins en partie, interrompue. Au cours de l’oncogenèse colorectale, les mutations de Bax pourraient ainsi prévenir l’émergence de clones dans lesquels p53 est muté, malgré la pression de sélection imposée par le phénotype MSI+ [29]. Des mutations similaires de Bax ont été détectées dans des lignées établies à partir de cellules leucémiques de patients atteints d’hémopathies malignes. La moitié d’entre elles était à nouveau localisée dans la séquence (G)8 et aucune protéine Bax n’était détectable en Western blot. Cependant, ces mutations, identifiées dans des lignées cellulaires, le sont rarement dans les cellules primaires de patients atteints de leucémie aiguë lymphoblastique [30]. D’autres mutations, provoquant seulement la substitution d’un acide aminé par un autre, ont été associées à une perte de la fonction pro-apoptotique de la protéine [29]. Des mutations de Bak, une autre protéine pro-apoptotique de la famille Bcl-2, ont été identifiées par SSCP dans des cancers gastriques ou colorectaux, tous à un stade avancé de la maladie. Ces mutations sont dispersées sur le gène : certaines altèrent la région hydrophobe C-terminale de Bak mais aucune ne touche le domaine BH3. Les conséquences fonctionnelles de ces mutations restent inconnues [31]. La dérèglement de l’expression de Bcl-2 La translocation t(14;18)(q32;q21) est la plus fréquente des translocations identifiées dans les hémopathies lymphoïdes malignes puisqu’on la trouve dans 85 % des lymphomes B folliculaires et 20 % des lymphomes B diffus à grandes cellules. Cette translocation place le gène bcl-2 sous le contrôle du promoteur du gène des chaînes lourdes des immunoglobulines sans interrompre la région codante. Le site de la cassure dans la région non codante de bcl-2 varie selon les tumeurs, mais, dans tous les cas, la conséquence est la surexpression, dans les lymphocytes B portant la translocation, d’une protéine Bcl-2 qui ne diffère pas de la protéine sauvage [ 32]. La présence d’un réarrangement bcl-2-immunoglobuline (bcl-2-Ig) n’est pas synonyme de transformation néoplasique. Ce réarrangement a été identifié dans des tissus lymphoïdes en apparence normaux. Cela pourrait être dû au fait que la surexpression de Bcl-2 n’est que l’un des événements associés à la prolifération lymphoïde, des altérations génétiques additionnelles étant nécessaires à la transformation maligne. C’est en tout cas ce que suggèrent les expériences de transgenèse chez la souris. La surexpression de Bcl-2 provoque une accumulation de cellules lymphoïdes B quiescentes, très résistantes à de nombreux stimulus apoptotiques. Elle augmente l’incidence des hémopathies lymphoïdes B mais ces tumeurs n’apparaissent que chez 10 à 15 % des animaux et après un temps de latence de plus d’un an. Le croisement de ces souris avec des animaux surexprimant l’oncogène myc a deux conséquences pour la descendance : l’accélération de l’apparition de tumeurs lymphoïdes B et leur caractère systématique. Bcl-2 et myc agissent donc en synergie pour induire la transformation maligne [33]. L’inhibition de la mort cellulaire par surexpression de Bcl-2 non seulement favorise l’accumulation de cellules résistant à la mort apoptotique, mais elle prévient aussi la réponse immunitaire anti-tumorale. L’injection à des rats syngé-niques de cellules d’une lignée de cancer colique surexprimant Bcl-2 prévient la réponse immunitaire anti-tumorale [34]. Le même résultat est obtenu en surexprimant dans ces cellules la protéine de choc thermique HSP27 [35]. Ces observations sont en accord avec l’hypothèse qui fait de la mort des cellules tumorales un stimulus nécessaire à l’induction d’une réponse immunitaire spécifique. Des mutations de la région amino-terminale de Bcl-2 sont souvent observées au cours de l’évolution des lymphomes folliculaires. Elles pourraient favoriser l’effet oncogénique de la molécule en supprimant sa capacité d’inhiber la progression dans le cycle. Les translocations associées aux lymphomes du MALT Les lymphomes du MALT ( mucosa-associated lymphoid tissue) sont des lymphomes non hodgkiniens de type lymphoïde B qui se développent dans les tissus lym-phoïdes associés aux muqueuses. Ils représentent entre 5 et 10 % de l’ensemble des lymphomes et la majorité des lymphomes extra-ganglionnaires. Ils surviennent dans le contexte d’un syndrome inflammatoire chronique ou d’auto-immunité. L’éradication d’une infection par Helicobacter pylori permet de guérir certains lymphomes du MALT localisés au niveau de l’estomac, à condition qu’ils soient encore confinés à la muqueuse gastrique. Certains de ces lymphomes se transforment en une tumeur de phénotype plus agressif, généralement un lymphome diffus à grandes cellules. Plusieurs anomalies génétiques ont été identifiées dans les cellules tumorales des lymphomes du MALT, en particulier lors de leur évolution vers un phénotype plus agressif. Deux sont caractéristiques, les translocations chromosomiques t(11;18)(q21;q21) et t(1;14)(q22;q32) : leur étude moléculaire suggère que la progression de ces tumeurs est liée à une inhibition de la mort apoptotique. La translocation, t(11;18)(q21;q21) fait intervenir deux gènes, MLT1 (MALT lymphoma-associated transloca-tion-1), et c-IAP2 (encore appelé API2 ou hiap-1 ou MIHC). La protéine MLT1 est encore appelée para-cas-pase humaine du fait de ses homologies structurales avec les caspases. Des para-caspases ont été identifiées chez les métazoaires et chez Dictyostélium. La para-caspase humaine MLT1 comporte notamment un domaine de mort amino-terminal et un domaine cas-pase-like mais sa fonction reste inconnue [36]. c-IAP2 est une protéine de la famille IAP, une famille de protéines que nous avons évoquée à propos de l’amyotro-phie spinale [17]. Elle contient trois domaines BIR à son extrémité amino-terminale, un domaine CARD (interactions protéine-protéine) et un domaine RING carboxy-terminal (suggérant une fonction d’ubiquitine ligase). L’une des fonctions de c-IAP2 serait d’inhiber les cas-pases 3, 7 et 9 en interagissant directement avec elles. La translocation (11;18)(q21;q21) entraîne une tronca-tion du gène c-IAP2. La protéine correspondante conserve les domaines BIR mais perd dans 95 % des cas le domaine CARD et dans tous les cas le domaine RING. Quelle est l’influence de la translocation (11;18)(q21;q21) sur la pathologie lymphoïde ? Une première hypothèse suggère que la protéine c-IAP2 tronquée a une activité anti-apoptotique plus importante que la protéine c-IAP2 sauvage mais cela reste à démontrer formellement. Une seconde confère au produit de fusion IAP2-MLT1 une fonction d’activation du facteur de transcription NF-κB. Dans les deux hypo-thèses, c’est par son effet anti-apoptotique que la translocation participe à la pathologie lymphoïde [36]. La translocation t(1;14)(p22;q32) entraîne la surexpression de la protéine Bcl-10 dont le gène est placé sous le contrôle du promoteur du gène des chaînes lourdes des immunoglobulines [37]. Bcl-10 possède un domaine CARD amino-terminal et peut activer NF-κB. Sa surexpression dans des lignées cancéreuses en culture, ou dans des lymphocytes dans un modèle de souris transgénique, provoque l’apoptose des cellules. Cet effet pro-apoptotique fait intervenir la formation de filaments intracytoplasmiques associés au cytosque-lette. Dans les lymphomes du MALT, le gène bcl-10 est surexprimé mais il est aussi muté, résultant en la synthèse d’une protéine tronquée du coté carboxy-termi-nal. Cette forme tronquée active encore NF-κB et stimule la prolifération cellulaire, mais sa surexpression n’induit plus la mort apoptotique. Ces deux effets pourraient contribuer à la pathologie lymphoïde. En outre, dans les cellules des lymphomes de type MALT, Bcl-10 est exprimée principalement dans le noyau, contrairement à ce qui est observé dans les lymphocytes B normaux. Or, cette expression nucléaire de Bcl-10 est aussi observée dans la moitié des lymphomes du MALT avec t(11;18)(q21 ;q21) [36], ce qui suggère son rôle dans l’activité oncogénique de Bcl-10 [38]. Quoiqu’il en soit, les deux principales translocations observées dans les lymphomes du MALT conduisent toutes deux à l’activation du facteur de transcription NF-κB qui, entre autres effets biologiques, protége ces cellules de l’apoptose. Les mutations des récepteurs de mort dans les tumeurs Des mutations somatiques de Fas, généralement situées dans le domaine de mort, ont été identifiées dans un certain nombre de tumeurs humaines, en particulier les hémopathies malignes. Leur incidence est limitée (2 à 15 % de ces tumeurs) et elles apparaissent généralement au cours de la progression tumorale. Elles sont plus fréquemment associées aux lymphomes extra-ganglionaires et à ceux qu’on observe au cours des maladies auto-immunes, anémie hémolytique ou syndrome de Sjögren. Des mutations de Fas ont également été identifiées dans les cellules de cancer de la vessie et du tube digestif. Elles semblent plus rares dans les autres tumeurs. Ces mutations de Fas pourraient contribuer au développement tumoral en favorisant l’échappement des cellules malignes aux cellules cytotoxiques du système immunitaire [ 39]. Très récemment, des mutations des récepteurs de TRAIL, DR4 et DR5, ont été identifiées dans des cancers du sein métastatiques [ 40]. La méthylation des gènes de l’apoptose dans les tumeurs Des modifications épigénétiques participent au développement des cancers humains, au même titre que les mutations géniques. La plus étudiée est la méthylation des ilôts CpG de la région promotrice de certains gènes. Cette méthylation permet le recrutement d’une histone désacétylase qui inhibe l’expression génique. Parmi les gènes sensibles à cette méthylation se trouvent plusieurs gènes dont le produit est impliqué dans le contrôle de la mort cellulaire par apoptose. C’est ainsi que la diminution de l’expression de la cas-pase 8 dans les neuroblastomes agressifs, des tumeurs du système nerveux périphérique observées chez l’enfant, est due le plus souvent à l’hyperméthylation du promoteur du gène correspondant [41]. Cette disparition de la caspase 8 confère aux cellules malignes une résistance à l’apoptose induite par l’engagement d’un récepteur à domaine de mort comme Fas ou TNF-R1. Une des conséquence en est la résistance accrue des cellules aux cellules T cytotoxiques et aux agents anticancéreux qui utilisent en partie la voie Fas pour induire la mort cellulaire [42]. La réintroduction de la caspase 8 dans ces cellules restaure la sensibilité à l’apoptose. La méthylation du gène CASP8 est associée à l’amplification de MYCN, un homologue fonctionnel de c-MYC. Les deux anomalies ont un effet opposé sur la mort apoptotique : la surexpression de MYCN sensibilise les cellules de neuroblastome à l’apoptose induite par divers stimulus, un effet que corrige la méthylation du gène CASP8 qui pourrait ainsi participer à la tumorige-nèse. L’expression du gène Apaf-1 est également déréglée par l’hyperméthylation de son promoteur. Cette modification a été identifiée dans les mélanomes malins méta-statiques [43]. La protéine APAF-1 joue un rôle central dans la phase post-mitochondriale de l’apoptose. Elle s’oligomérise sous l’effet du cytochrome c libéré de la mitochondrie et en présence d’ATP, et recrute et active des molécules de pro-caspase 9 au sein d’un complexe multimoléculaire appelé apoptosome. La perte d’APAF-1 induit donc une résistance des cellules tumorales aux agents cytotoxiques. Apaf-1 est une cible transcrip-tionnelle de E2F et de p53 [44]. La méthylation du gène Apaf-1 est donc un des moyens d’inactiver la voie de signalisation p53/apoptose dans les cellules tumorales, comme le fait la mutation de Bax [27]. La DAP-kinase (death-associated protein-kinase) est elle aussi impliquée dans la voie p53 mais en amont de celle-ci : cette sérine/thréonine kinase que contrôlent le calcium et la calmoduline, participe à la mort apop-totique induite par l’interféron γ, le TNFα, le récepteur Fas ou le détachement des cellules épithéliales de leur environnement (anoikis). Elle s’associe aux filaments d’actine et possède un domaine de mort nécessaire à son activité pro-apoptotique. L’expression du gène DAP-kinase est perdue dans de nombreux cancers et ce en raison de l’hyperméthylation de son promoteur. La réintroduction de la protéine dans des cellules de cancer du poumon diminue leur pouvoir métastatique chez la souris, ce qui indique que la perte d’expression de la DAP-kinase est impliquée dans la progression tumorale et l’apparition de métastases en supprimant une voie d’activation de l’apoptose [45]. Le gène TMS1 (target of methylation-induced silencing) a été isolé du fait de son hyperméthylation dans des cellules surexprimant la cytosine-5-méthyltransférase. Ce gène est hyperméthylé dans de nombreux cancers du sein. La protéine correspondante comporte un domaine CARD et sa surexpression induit l’apoptose en activant la caspase 9. Il est vraisemblable que l’inhibition de l’expression de TMS1 en réponse à l’hyperméthylation de son promoteur favorise aussi la survie des cellules tumorales [46]. L’intérêt de ces observations réside dans les applications thérapeutiques qu’elles suggèrent. L’hyperméthy-lation d’un promoteur est, a priori, réversible. La 5-azacytidine est un agent déméthylant actuellement testé en clinique humaine. Il pourrait agir en synergie avec des inhibiteurs des histones désacétylases comme le phénylbutyrate. Cette association devrait restaurer la sensibilité d’un certain nombre de cellules tumorales à l’apoptose, notamment celle qu’induisent les agents cytotoxiques [47]. |
L’identification d’altérations des gènes de l’apoptose a de multiples applications. Elle offre de nouveaux outils moléculaires pour le diagnostic des affections héréditaires et la classification de certaines affections malignes, en particulier des lymphomes malins non hodgkiniens. Elle permet de suivre l’évolution de la maladie sous traitement, d’évaluer la maladie résiduelle, de détecter précocement l’apparition de récidives. Les anomalies cytogénétiques ou moléculaires sont des marqueurs de progression tumorale dans les lymphomes du MALT. Dans les lymphomes du MALT gastriques, par exemple, l’identification d’un réarrangement MLT1-cIAP2 ou la surexpression de Bcl-10 indiquent que l’éradication d’Helicobacter pylori ne suffira pas à guérir la maladie. Les altérations des gènes impliqués dans l’apoptose apporte également des informations pronostiques. La mutation de naip est un facteur aggravant dans l’amyotrophie spinale [15]. Dans les tumeurs malignes, l’identification de mutations de p53 suggère la progression tumorale et la résistance des cellules tumorales à l’apoptose induite par les agents génotoxiques. La valeur pronostique des mutations de p53, comme celle de la surexpression de Bcl-2 dans les tumeurs humaines, est cependant controversée. Cela peut s’expliquer par le fait que des altérations de DAP-kinase, Bax, E2F ou Apaf-1, qui ont les mêmes conséquences fonctionnelles que les mutations de p53, ne sont pas prises en compte dans l’analyse de la valeur pronostique des altérations de p53 [29]. Enfin, l’implication des gènes contrôlant la mort apop-totique dans la physiopathologie de maladies héréditaires ou acquises suggère de nouvelles approches thérapeutiques. Lorsqu’une mutation génique conduit à l’activation inappropriée de la machinerie apoptotique dépendant des caspases, des inhibiteurs de ces enzymes pourraient avoir un effet protecteur. Ces inhibiteurs ont démontré une certaine efficacité dans des modèles animaux d’apoptose aiguë post-ischémique, d’hépatite fulminante ou de méningite infectieuse [49]. D’autres approches sont envisagées, par exemple l’activation ou l’inhibition de produits de gènes modifiant le phénotype pathologique [29]. Dans les tumeurs malignes, l’objectif est de restaurer dans les cellules tumorales un processus efficace de mort par apoptose. Nous avons déjà évoqué l’intérêt potentiel de médicaments inhibant les ADN méthyl-transférases et les histones désacétylases, qu’ils soient administrés seuls ou en association avec des médicaments génotoxiques : ces inhibiteurs devraient rétablir une expression normale de la caspase 8, de la DAP-kinase ou d’Apaf-1 en levant la méthylation du promoteur de leurs gènes, et donc sensibiliser les cellules tumorales dans lesquelles ces gènes étaient inactivés [29]. D’autres stratégies sont envisagées : lorsque p53 est muté, une stratégie de thérapie génique consistant à réintroduire une protéine p53 sauvage dans les cellules tumorales est en cours d’évaluation. Les médicaments ciblant directement la mitochondrie (ionida-mine, arsenic, acide bétulinique par exemple) contournent certaines résistances au déclenchement de la machinerie apoptotique par des agents cytotoxiques [50]. Lorsque Bcl-2 est surexprimée dans les cellules de lymphome folliculaire, la diminution de son expression par des oligonucléotides antisens devrait soit induire l’apoptose, soit sensibiliser les cellules tumorales aux agents cytotoxiques. Les premiers résultats obtenus avec un oligomère antisens appelé G-3139 dans des modèles murins, puis en phase I chez l’homme, vont dans ce sens [49]. D’autres médicaments ciblant Bcl-2 ou ses partenaires sont actuellement à l’étude [51]. Si le dérèglement des mécanismes de l’apoptose joue indiscutablement un rôle dans la physiopathologie d’un certain nombre d’affections, l’efficacité d’approches thérapeutiques fondées sur la modulation de l’apoptose reste à établir formellement. Une des clés de la réussite est probablement l’identification des spécificités tissu-aires ou cellulaires des mécanismes de contrôle de la mort cellulaire et de leurs dérèglements. Ces spécificités permettront de cibler plus précisément la modulation de l’apoptose, dans les maladies génétiques rares comme dans les tumeurs malignes. |
Nous remercions François Martin de ses conseils et la Ligue Nationale Contre le Cancer (équipe labélisée) et ses Comités Départementaux (Côte d’Or, Saône et Loire, Nièvre, Haute-Marne, Yonne) ainsi que l’ARERS de leur soutien. |
Footnotes |
1. Rieux-Laucat F, Blachere S, Danielan S, et al. Lymphoproliferative syndrome with autoimmunity: a possible genetic basis for dominant expression of the clinical manifestations. Blood 1999; 94 : 2575–82. 2. Nagata S. Human autoimmune lymphoproliferative syndrome, a defect in the apoptosis-inducing Fas receptor: a lesson from the mouse model. J Hum Genet 1998; 43 : 2–8. 3. Rieux-Laucat F, Le Deist F, Hivroz C, et al. Mutations in Fas associated with human lymphoproliferative syndrome and autoim-munity. Science 1995;268 : 1347–9. 4. Wu J, Wilson J, He J, Xiang L, Schur PH, Mountz JD. Fas ligand mutation in a patient with systemic lupus erythematous and lymphoproliferative disease. J Clin Invest 1996; 98 : 1107–13. 5. Wang J, Zheng L, Lobito A, et al. Inherited human caspase 10 mutations underlie defective lymphocyte and dendritic cell apoptosis in autoimmune lymphoproliferative syndrome type II. Cell 1999; 98 : 47–58. 6. Ramenghi U, Bonissoni S, Migliaretti G, et al. Deficiency of the Fas apoptosis pathway without Fas gene mutations is a familial trait predisposing to development of autoimmune diseases and cancer. Blood 2000; 95 : 3176–82. 7. Budd RC. Activation-induced cell death. Curr Opin Immunol 2001; 13 : 356–62. 8. Zhang J, Cado D, Chen A, Kabra NH, Winoto A. Fas-mediated apoptosis and activation-induced T-cell proliferation are defective in mice lacking FADD/MORT1. Nature 1998; 392 : 296–300. 9. Stepp SE, Dufourcq-Lagelouse R, Le Deist F, et al. Perforin gene defects in familial hemophagocytic lymphohistiocytosis. Science 1999; 286 : 1957–9. 10. The French FMF Consortium. A candidate gene for familial Mediterranean fever. Nat Genet 1997; 17 : 25–31. 11. Martinon F, Hofmanndouble-Dagger K, Tschopp J. The pyrin domain: a possible member of the death domain-fold family implicated in apoptosis and inflammation. Curr Biol 2001; 11 : R118–20. 12. McDermott MF, Aksentijevich I, Galon J, et al. Germline mutations in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell 1999; 97 : 133–44. 13. Aradhya S, Woffendin H, Jakins T, et al. A recurrent deletion in the ubiquitously expressed NEMO (IKK-gamma) gene accounts for the vast majority of incontinentia pigmenti mutations. Hum Mol Genet 2001; 10 : 2171–9. 14. Aradhya S, Nelson DL. NF-kappaB signaling and human disease. Curr Opin Genet Dev 2001; 11 : 300–6. 15. Gendron NH, MacKenzie AE. Spinal muscular atrophy: molecular pathophysiology. Curr Opin Neurol 1999; 12 : 137–42. 16. Burghes AH, Vaessin HE, de la Chapelle A. The land between Mendelian and multifactorial inheritance. Science 2001; 293 : 2213–4. 17. Verhagen AM, Coulson EJ, Vaux DL. Inhibitor of apoptosis proteins and their relatives: IAPs and other BIRPs. Genome Biol 2001; 2 : 3009. 18. Roy N, Mahadevan MS, McLean M, et al. The gene for neuronal apoptosis inhibitory protein ispartially deleted in individuals with spinal muscular atrophy. Cell 1995; 80 : 167–78. 19. Holcik M, Thompson CS, Yaraghi Z, Lefebvre CA, MacKenzie AE, Korneluk RG. The hippocampal neurons of neuronal apoptosis inhibitory protein 1 (NAIP1)-deleted mice display increased vulnerability to kainic acid-induced injury. Proc Natl Acad Sci USA2000; 97 : 2286–90. 20. Xu DG, Crocker SJ, Doucet JP, et al. Elevation of neuronal expression of NAIP reduces ischemic damage in the rat hippocampus. Nat Med 1997; 3 : 997–1004. 21. Campuzano V, Montermini L, Molto MD, et al. Friedreich’s ataxia: autosomal recessive disease caused by an intronic GAA triplet repeat expansion. Science 1996; 271 : 1423–7. 22. Santos MM, Ohshima K, Pandolfo M. Frataxin deficiency enhances apoptosis in cells differentiating into neuroectoderm. Hum Mol Genet 2001; 10 : 1935–44. 23. Gervais FG, Singaraja R, Xanthoudakis S, et al. Recruitment and activation of caspase-8 by the Huntingtin-interacting protein Hip-1 and a novel partner Hippi. Nat Cell Biol 2002; 4 : 95–105. 24. Chen M, Ona VO, Li M, et al. Minocycline inhibits caspase-1 and caspase-3 expression and delays mortality in a transgenic mouse model of Huntington disease. Nat Med 2000; 6 : 797–801. 25. Vousden KH. p53: death star. Cell 2000; 103 : 691–4. 26. Dubrez L, Coll JL, Hurbin A, Solary E, Favrot MC. Caffeine sensitizes human H358 cell line to p53-mediated apoptosis by inducing mitochondrial translocation and conformational change of BAX Protein. J Biol Chem2001; 276 : 38980–7. 27. Rampino N, Yamamoto H, Ionov Y, et al. Somatic frameshift mutations in the BAX gene in colon cancers of the microsatellite mutator phenotype. Science 1997; 275 : 967–9. 28. Molenaar JJ, Gerard B, Chambon-Pautas C, et al. Microsatellite instability and frameshift mutations in BAX and transforming growth factor-beta RII genes are very uncommon in acute lymphoblastic leukemia in vivo but not in cell lines. Blood 1998; 92 : 230–3. 29. Jones PA. Death and methylation. Nature 2001; 409 : 141–4 30. Meijerink JP, Mensink EJ, Wang K, et al.Hematopoietic malignancies demonstrate loss-of-function mutations of BAX. Blood 1998; 91 : 2991–7. 31. Kondo S, Shinomura Y, Miyazaki Y, et al. Mutations of the bak gene in human gastric and colorectal cancers. Cancer Res 2000; 60 : 4328–30. 32. Chao DT, Korsmeyer SJ. Bcl-2 family: regulators of cell death. Annu Rev Immunol1998; 16 : 395–419. 33. Cory S, Vaux DL, Strasser A, Harris AW, Adams JM. Insights from Bcl-2 and Myc: malignancy involves abrogation of apoptosis as well as sustained proliferation. Cancer Res1999; 59 : 1685s–92. 34. Bonnotte B, Favre N, Moutet M, et al. Bcl-2-mediated inhibition of apoptosis prevents immunogenicity and restores tumorigenicity of spontaneously regressive tumors. J Immunol 1998; 161 : 1433–8. 35. Garrido C, Fromentin A, Bonnotte B, et al. Heat shock protein 27 enhances the tumorigenicity of immunogenic rat colon carcinoma cell clones. Cancer Res 1998; 58 : 5495–9. 36. Uren AG, O’ Rourke K, Aravind LA, et al. Identification ofparacaspases and metacaspases: two ancient families of caspase-like proteins, one of which plays a key role in MALT lymphoma. Mol Cell 2000; 6 : 961–7. 37. Zhang Q, Siebert R, Yan M, et al. Inactivating mutations and overexpression of Bcl10, a caspase recruitment domain-containing gene, in MALT lymphoma with t(1;14)(p22;q32). Nat Genet 1999; 22 : 63–8. 38. Liu H, Ye H, Dogan A, et al. T(11;18)(q21;q21) is associated with advanced mucosa-associated lymphoid tissue lymphoma that expresses nuclear Bcl10. Blood 2001; 98 : 1182–7. 39. Rozenfeld-Granot G, Toren A, Amariglio N, Brok-Simoni F, Rechavi G. Mutation analysis of the FAS and TNFR apoptotic cascade genes inhematological malignancies. Exp Hematol 2001; 29 : 228–33 40. Shin MS, Kim HS, Lee SH, et al. Mutations of tumor necrosis factor-related apoptosis-inducing ligand receptor 1 (TRAIL-R1) and receptor 2 (TRAIL-R2) genes in metastatic breast cancers. Cancer Res 2001; 61 : 4942–6. 41. Teitz T, Wei T, Valentine MB, et al. Caspase 8 is deleted or silenced preferentially in childhood neuroblastomas with amplification of MYCN. Nat Med 2000; 6 : 529–35. 42. Micheau O, Solary E, Hammann A, Dimanche-Boitrel MT. Fas ligand-independent, FADD-mediated activation of the Fas death pathway by anticancer drugs. J Biol Chem 1999; 274 : 7987–92. 43. Soengas MS, Capodieci P, Polsky D, et al. Inactivation of the apoptosis effector Apaf-1 in malignant melanoma. Nature 2001; 409 : 207–11. 44. Moroni MC, Hickman ES, Denchi EL, et al. Apaf-1 is a transcriptional target for E2F and p53. Nat Cell Biol 2001; 3 : 552–8. 45. Cohen O, Kimchi A. DAP-kinase: from functional gene cloning to establishment of its role in apoptosis and cancer. Cell Death Differ 2001; 8 : 6–15. 46. McConnell BB, Vertino PM. Activation of a caspase-9-mediated apoptotic pathway by subcellular redistribution of the novel caspase recruitment domain protein TMS1. Cancer Res 2000; 60 : 6243–7. 47. Zhu WG, Lakshmanan RR, Beal MD, Otterson GA. DNA methyltransferase inhibition enhances apoptosis induced by histone deacetylase inhibitors. Cancer Res 2001; 61 : 1327–33. 48. Komarov PG, Komarova EA, Kondratov RV, et al. A chemical inhibitor of p53 that protects mice from the side effects of cancer therapy. Science 1999; 285 : 1733–7. 49. Nicholson DW. From bench to clinic with apoptosis-based therapeutic agents. Nature 2000; 407 : 810–6. 50. Sordet O, Rebe C, Leroy I, et al. Mitochondria-targeting drugs arsenic trioxide and ionidamine bypass the resistance of TPA-differentiated leukemic cells to apoptosis. Blood 2001; 97 : 3931–40. 51. Tzung SP, Kim KM, Basanez G, et al. Antimycin A mimics a cell-death-inducing Bcl-2 homology domain 3. Nat Cell Biol 2001; 3 : 183–91 |