L’activation d’un récepteur par la liaison de son ligand soluble à la surface de la cellule peut déclencher son auto-phosphorylation. Survient ensuite le recrutement de diverses molécules accessoires sur la partie cytoplasmique du récepteur, et leur activation, déclenchant celle de multiples voies de signalisation intracellulaires, dont la plupart se caractérisent par des cascades de phosphorylation-activation des protéines impliquées. Les réponses engendrées sont variées, et affectent de nombreuses fonctions physiologiques de la cellule comme la prolifération, la migration, ou la différenciation cellulaire.
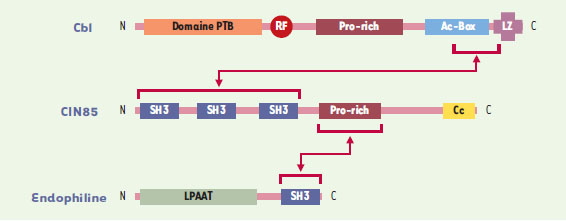
La plupart des voies de signalisation sont dotées d’un mécanisme de rétrocontrôle négatif qui limite la durée du signal et prévient une stimulation excessive de la cellule. La perturbation de cet équilibre peut engendrer des situations pathologiques dont le développement tumoral. L’une des façons d’arrêter le signal consiste à retirer physiquement le récepteur activé de la surface cellulaire, par internalisation. En effet, à la suite de leur activation, les récepteurs sont rapidement ubiquitinylés, internalisés par un mécanisme d’endocytose contrôlé par les protéines « clathrine » qui s’organisent en forme de cage autour de la vésicule en formation, facilitant ainsi son invagination, et dégradés par un processus impliquant à la fois le protéasome et le lysosome [1]. Notre équipe [2], et celle de S. Giordano [3], ont éclairci le mécanisme d’internalisation de deux types de récepteurs, celui de l’EGF (epidermal growth factor) et celui de l’HGF (hepatocyte growth factor), en identifiant un partenaire essentiel, ClN85. C’est un couple, fait de Cbl et CIN85, qui fait le lien entre les récepteurs activés et les protéines endophiline qui contrôlent l’endocytose dépendante de la clathrine. Cbl est une protéine adaptatrice se liant à de nombreuses molécules de signalisation (Figure 1), membre d’une famille plus large qui contient d’autres protéines, Cbl-b et Cbl-3 [4]. Cbl est dotée, à son extrémité N-terminale, d’un domaine de liaison aux kinases activées PTB (phosphotyrosine tyrosine binding), et d’un domaine ring finger, qui catalyse le transfert de molécules d’ubiquitine de l’enzyme de conjugaison de l’ubiquitine vers la molécule cible (la kinase). L’extrémité C-terminale de Cbl comprend plusieurs domaines d’interaction moléculaire avec de nombreuses protéines de signalisation : (1) un domaine riche en résidus proline, qui contient plusieurs « motifs PxxP », sites de liaison à des domaines SH3 (Src homology 3) présents dans les protéines associées ; (2) un domaine acide, avec plusieurs résidus tyrosine phosphorylables, permet l’interaction avec des protéines contenant un domaine SH2 (Src homology 2) ; (3) enfin, un domaine leucine zipper intervient dans la dimérisation de Cbl.
| Figure 1. Représentation schématique du rôle de Cbl, CIN85, et des endophilines dans l’internalisation des récepteurs. Le mode d’interaction des trois protéines conduisant à la formation du complexe trimérique responsable de l’internalisation des récepteurs activés est illustré. Le domaine PTB (phosphotyrosine binding domain) se lie aux récepteurs activés. Le domaine ring finger (RF) confère l’activité de ligase de l’ubiquitine ; Pro-Rich : région riche en résidus proline ; Ac-Box (acidic box) contient plusieurs résidus tyrosine phosphorylables ; LZ (leucine zipper) : domaine impliqué dans la dimérisation de Cbl ; SH3 (Src homology 3) : domaine qui se lie à des motifs proline PxxP ; Cc (coiled-coil) : domaine impliqué dans l’oligomérisation de CIN85 ; LPAAT : activité acide lysophosphatidique acyltransférase des endophilines. |
La fonction de Cbl en aval des récepteurs est double, puisqu’elle agit aussi bien comme effecteur des voies de signalisation que comme régulateur négatif [4]. Pour remplir son premier rôle, elle est rapidement recrutée et phosphorylée par les récepteurs activés et transmet le signal à d’autres effecteurs ; quant au second, qui limite l’activation du récepteur, elle l’exécute grâce à son activité de ligase de l’ubiquitine, et catalyse l’ajout de molécules ubiquitine sur ce dernier, entraînant sa destruction.
La recherche de nouveaux partenaires de Cbl nous a conduits à identifier la protéine CIN85 [2] (Figure 1). CIN85 est, elle aussi, une protéine multi-adaptatrice qui contient dans sa moitié N-terminale trois domaines SH3, et en C-terminal une région riche en résidus proline et un domaine coiled-coil permettant son oligomérisation [5]. Nous avons démontré que CIN85 est capable de se lier indistinctement à tous les membres de la famille des protéines endophilines (Figure 1). Les endophilines sont dotées d’une activité enzymatique LPAAT (lysophosphatidic acid acyl transferase) permettant de modifier des phospholipides membranaires, et elles contiennent un domaine SH3 C-terminal (Figure 1) [6]. Elles interagissent directement avec des facteurs contrôlant l’endocytose dépendante de la clathrine (dynamine, synaptojanine) et avec la membrane plasmique. L’importance de leur fonction dans la régulation du processus d’endocytose fut révélée par leur capacité d’induire une courbure de la membrane plasmique et, plus récemment, par l’observation chez la drosophile d’un blocage de l’endocytose en l’absence d’endophiline [7]. Nous avons démontré que, dans la cellule, le domaine riche en proline de CIN85 se lie de manière constitutive au domaine SH3 des endophilines. En revanche, les trois domaines SH3 de CIN85 n’interagissent avec la partie C-terminale de Cbl que si celle-ci est phosphorylée (Figure 1). Parallèlement, l’équipe de S. Giordano qui, elle, recherchait des partenaires des endophilines, a aussi identifié la protéine CIN85 [3].
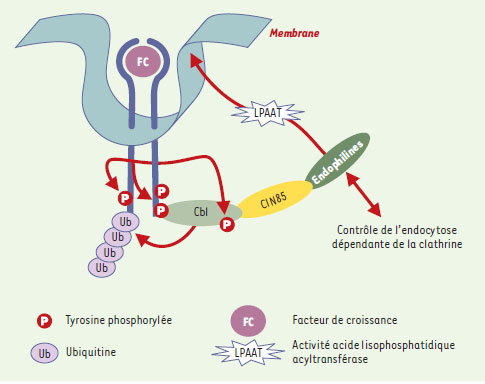
Ainsi, la fixation du ligand sur son récepteur induit la formation d’un complexe, comprenant quatre partenaires : le récepteur phosphorylé, Cbl phosphorylée par le récepteur, CIN85 et l’endophiline, qui favorisent l’internalisation du récepteur (Figure 2). La preuve de l’importance de ce complexe est apportée par l’effet délétère observé avec des protéines ClN85 mutantes, que ce soit une forme dépourvue de sa partie C-terminale et donc incapable de se lier aux endophilines, ou une forme ne contenant pas la région N-terminale et donc incapable d’interagir avec Cbl. L’expression de ces formes mutantes a eu pour effet d’inhiber l’internalisation des récepteurs de l’EGF, de retarder leur dégradation, et ainsi de favoriser la transcription des gènes cibles codant pour l’EGF [2]. Des effets similaires ont été observés dans les expériences où la cible était le récepteur du HGF [3]. Cependant, quel que soit le mutant ClN85 utilisé, l’ubiquitinylation des récepteurs par Cbl n’a pas été affectée.
| Figure 2. Modèle d’internalisation. La reconnaissance du facteur de croissance par le récepteur entraîne sa dimérisation suivie d’une auto-phosphorylation de sa partie cytoplasmique. Cbl se lie au récepteur activé au niveau de résidus tyrosine phosphorylés et est en retour phosphorylée par le récepteur. Cette dernière modification permet le recrutement de CIN85 constitutivement associée aux endophilines. Les endophilines, qui modifient le contenu phospholipidique de la membrane et qui interagissent avec de nombreux facteurs réglant la formation du manteau de clathrine, induisent une invagination de la membrane puis la formation d’une vésicule d’endocytose. Ainsi, la formation du complexe Cbl/CIN85/endophiline avec le récepteur facilite l’internalisation du récepteur. |
Ces travaux identifient la place essentielle du couple Cbl/CIN85 comme lien direct entre les récepteurs activés et le processus d’endocytose dépendante de la clathrine. La rupture de ce lien retarde l’internalisation et la dégradation des récepteurs et conduit à une amplification du signal émis. Ces résultats ont aussi mis en évidence une nouvelle fonction de régulation négative pour la protéine Cbl, qui est indépendante de son activité ligase de l’ubiquitine. Cette fonction repose sur son interaction avec CIN85 qui est un intermédiaire primordial entre les récepteurs activés et la machinerie d’endocytose. On sait que CIN85 interagit aussi avec de nombreuses autres protéines impliquées dans le cheminement intracellulaire des vésicules d’endocytose [8]. Il est donc probable que CIN85 intervient sur le trafic des vésicules d’endocytose en contrôlant, par exemple, l’adressage des récepteurs au lysosome. Cette hypothèse est actuellement en cours d’investigation. Il ne fait aucun doute que CIN85 n’a pas encore révélé tous ses secrets.