| |
| Med Sci (Paris). 2002 October; 18(10): 955–963. Published online 2002 October 15. doi: 10.1051/medsci/20021810955.Régulations et perturbations des fonctions testiculaires par la vitamine A Gabriel Livera, Virginie Rouiller-Fabre, and René Habert* Équipe de différenciation fonctionnelle des gonades, Université Denis-Diderot, Paris 7, 2 place Jussieu, 75251 Paris Cedex 05, France |
Les déficits et les excès de l’apport en vitamine A, ou rétinol, sont fréquents dans la population. Les carences sévères en vitamine A sont observées dans la plupart des pays en voie de développement, les principales victimes étant les enfants et les femmes enceintes dont les besoins en rétinol sont plus importants [1]. Dans les pays industrialisés, les hypovitaminoses A sévères ont quasiment disparu, mais une insuffisance de l’apport nutritionnel en vitamine A a été rapportée chez 20 à 25 % des femmes adultes en région parisienne. Inversement, des surcharges en rétinoïdes sont fréquemment créées à des fins thérapeutiques, les rétinoïdes étant utilisés à fortes doses dans le traitement de certaines maladies de peau (acné, psoriasis…) et de nombreux cancers (poumon, rein, peau, système hématopoïétique…). Si aucune étude n’a encore été conduite pour évaluer l’importance d’une altération de l’apport en vitamine A et en rétinoïdes dans le développement et le maintien des fonctions testiculaires dans l’espèce humaine, on sait depuis longtemps que la concentration plasmatique en rétinol influence de façon importante les fonctions testiculaires chez le rat et chez la souris, alors qu’elle est sans effet sur les fonctions ovariennes. Un excès de vitamine A provoque des lésions testiculaires et des troubles de la spermatogenèse. Inversement, une carence en vitamine A induit un arrêt précoce de la spermatogenèse au stade de spermatogonie et de spermatocyte préleptotène (spermatocyte I, dernier stade avant l’entrée en prophase de la première division de méiose) [2] ainsi qu’une altération de la sécrétion de testostérone [3]. Ces troubles disparaissent lors d’une supplémentation alimentaire en vitamine A ou d’injections de fortes doses d’acide rétinoïque, qui est le métabolite actif de la vitamine A [3, 4]. Au cours des dix dernières années, de nombreuses données ont fait progresser nos connaissances sur la localisation des récepteurs de l’acide rétinoïque, l’identification de leurs gènes cibles et l’implication des rétinoïdes dans le développement du testicule. |
Le testicule, un ensemble cellulaire intégré Le testicule adulte assure une double fonction, d’une part la synthèse des hormones stéroïdes mâles, en particulier la testostérone, et, d’autre part, la production des spermatozoïdes. Cette double fonction correspond à une organisation anatomique du testicule en deux compartiments fonctionnels, le tissu interstitiel, conjonctif et vascularisé, contenant les cellules de Leydig responsables de la production de testostérone, et les tubes séminifères, de nature épithéliale et avasculaires, contenant les cellules germinales et les cellules de Sertoli qui servent de support à la spermatogenèse. Le rôle des cellules de Sertoli est de fournir un environnement particulier, nécessaire à l’évolution des cellules germinales vers la formation des spermatozoïdes. Elles exercent cette fonction en sécrétant des substances nutritives ou en exposant à leur surface membranaire des facteurs influençant la multiplication et la différenciation des cellules germinales. La mise en place de ces deux fonctions testiculaires s’effectue pendant la vie fœtale. Ce processus est fondamental pour la fertilité de l’individu adulte, conditionnée, d’une part, par le nombre de cellules germinales souches apparaissant pendant la vie fœtale et néonatale et, d’autre part, par la production de testostérone par les cellules de Leydig fœtales, hormone qui impose la masculinisation des organes génitaux internes et externes. On sait depuis longtemps que, chez l’adulte, les fonctions testiculaires sont contrôlées principalement par les hormones hypophysaires gonadotropes selon un schéma relativement simple. L’hormone lutéotrope (LH, luteinizing hormone) stimule spécifiquement les fonctions des cellules de Leydig et l’hormone folliculo-stimulante (FSH, follicle stimulating hormone) celles des cellules de Sertoli. De multiples travaux ont montré, au cours de ces dix dernières années, que l’activité des cellules testiculaires est également contrôlée par de nombreux facteurs locaux intratesticulaires. Ces facteurs assurent un dialogue local permanent entre les différentes cellules testiculaires, dialogue essentiel pour la coordination de leur activité [5, 6]. De même, l’implication de la vitamine A et de ses métabolites dans la fonction testiculaire est connue depuis de nombreuses années. En revanche, l’action de ces facteurs dans le développement de ces fonctions est peu documentée, même si leur importance pourrait être cruciale car les sécrétions endocrines des hormones gonadotropes n’apparaissent qu’en fin de vie fœtale. |
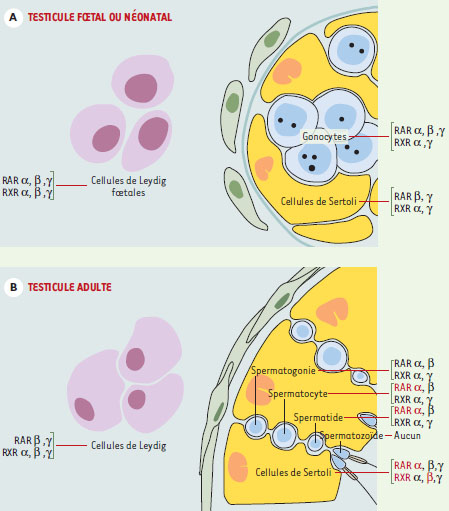
Des récepteurs tant et plus Les récepteurs de l’acide rétinoïque appartiennent à la superfamille des récepteurs nucléaires des hormones stéroïdes et thyroïdiennes. Il en existe deux grandes familles, les RAR (retinoic acid receptor) qui se lient aux isomères tout- trans et 9- cis de l’acide rétinoïque, et les RXR ( retinoid X receptor) qui se lient préférentiellement à la forme 9-cis (voir revue dans [ 7]). Chacune de ces familles comporte trois classes de protéines α, β et γ codées par des gènes différents. Les RAR doivent former des hétérodimères avec les RXR, ou avec d’autres récepteurs nucléaires, pour agir spécifiquement sur des éléments de réponse (RARE- retinoic acid response element) et activer la transcription de gènes cibles (→). Les RXR peuvent former soit des homodimères qui agissent sur des séquences régulatrices spécifiques (RXRE), soit des hétérodimères avec d’autres récepteurs nucléaires [ 7]. (→) m/s 1998, n°11, p. 1211 Ces dernières années, les six classes de récepteurs de l’acide rétinoïque ont été localisées par immunohistochimie ou par hybridation in situ dans les différents types cellulaires du testicule fœtal, immature et adulte de rat et de souris [8–10] (Figure 1). Leur expression dans le testicule est très complexe et souvent redondante et dépend non seulement du type cellulaire mais aussi du stade de différenciation du testicule et du stade de la spermatogenèse. Ainsi, les cellules germinales du testicule fœtal et néonatal, appelées gonocytes, expriment tous les récepteurs, excepté RXR β, mais cette expression, souvent cytoplasmique, n’est pas uniforme au cours du développement. Les cellules germinales du testicule adulte n’en expriment plus que quatre, RXR α et γ qui sont exprimés à tous les stades de la spermatogenèse, RAR β du stade spermatogonie au stade spermatide ronde, et RAR α essentiellement du stade spermatocyte jusqu’au stade spermatide en cours d’élongation (Figure 1). Enfin, aucun récepteur n’est plus exprimé à partir du stade spermatide allongé. De plus, ces récepteurs sont parfois localisés dans le cytoplasme et sont donc probablement inactifs. Ils peuvent être transloqués vers le noyau en présence d’acide rétinoïque ou sous l’effet d’autres signaux. Ainsi, dans les cellules de Sertoli, la localisation nucléaire de RAR α peut être induite par l’acide rétinoïque et bloquée par la FSH [11]. De même, le niveau d’expression de ces récepteurs n’est pas constant et peut être soumis à de nombreuses régulations. En particulier, le rétinol augmente le niveau d’expression de RAR α et l’acide rétinoïque celui de RARβ dans le testicule d’animaux déficients en vitamine A [12, 13]. Il apparaît donc que l’expression des récepteurs de l’acide rétinoïque est contrôlée par des mécanismes très complexes. Toutefois, il faut souligner que seules les souris qui n’expriment plus RAR α ou RXR β sont stériles du fait d’un défaut de fonctionnement testiculaire [14, 15]. Enfin, l’activité transcriptionnelle des récepteurs nucléaires des rétinoïdes peut être modulée par leur interaction avec d’autres protéines agissant comme des co-activateurs ou des co-répresseurs (→). En l’absence de ligand, l’hétérodimère RAR/RXR serait associé à un co-répresseur comme SMRT (silencing mediator for retinoic acid and thyroid hormone receptors) ou NCoR (nuclear corepressor receptor) [16]. L’activation des récepteurs par l’acide rétinoïque provoquerait la dissociation du complexe co-répresseur et induirait le recrutement de co-activateurs comme SRC-1 (steroid receptor co-activator), CBP (CREB binding protein), RAC-3 (receptor associated-coactivator) ou TRIP-1 (thyroid hormone receptor-interacting protein) [16]. Il existerait en outre une troisième catégorie de protéines agissant en tant que répresseurs sur des récepteurs liés à leur ligand : c’est le cas de la protéine RIP140 (receptor interacting protein) [17]. Ces co-activateurs et ces co-répresseurs agiraient en modifiant l’acétylation des histones et donc la structure de la chromatine, autorisant ou interdisant de ce fait la transcription. Malheureusement, leur expression ainsi que leur interaction avec les récepteurs des rétinoïdes dans le testicule sont peu documentées. (→) m/s 1997, n°8-9, p. 961
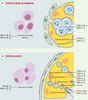 | Figure 1. Localisation des récepteurs de l’acide rétinoïque dans le testicule fœtal et néonatal et chez l’adulte. A. Dans le testicule fœtal ou néonatal, les cellules germinales sont appelées gonocytes. Elles expriment les trois classes de RAR - α, β et γ - ainsi que les RXR α et γ, mais cette expression n’est pas uniforme au cours du temps et la localisation des récepteurs est souvent cytoplasmique. Les cellules de Sertoli immatures, qui sont des cellules mitotiquement actives, à l’inverse des cellules de Sertoli adultes, expriment seulement RAR β et γ et RXR α et γ Enfin, les cellules de Leydig fœtales, qui forment une population distincte des cellules de Leydig adultes, expriment les six classes de récepteurs. B. Dans le testicule adulte, les cellules germinales se divisent par mitoses au stade spermatogonie puis entrent en méiose ; on les appelle alors des spermatocytes puis des spermatides. D’abord rondes, ces dernières vont ensuite s’allonger et se différencier en spermatozoïdes. Sur les quatre classes de récepteurs dentifiées dans les cellules germinales, RAR α est essentiellement exprimé du stade sperma-tocyte au stade spermatide en cours d’élongation, RAR β est exprimé plus précocement du stade spermatogonie au stade spermatide ronde, et RXR α et γ sont exprimés à tous ces stades. Les cellules germinales haploïdes n’expriment plus aucun récepteur de l’acide rétinoïque à partir du stade spermatide allongée. Les cellules de Sertoli adultes expriment les six classes de récepteurs, et les cellules de Leydig expriment toutes les classes de récepteurs excepté RAR α. |
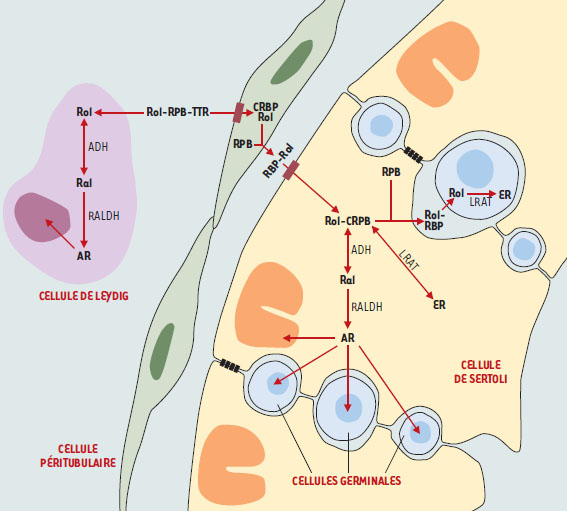
Métabolisme du rétinol dans le testicule Pendant longtemps, on a cru que seul le rétinol était capable d’agir dans le testicule alors que l’acide rétinoïque était inefficace [ 2]. En effet, l’injection de doses physiologiques de rétinol, et non d’acide rétinoïque, restaure une spermatogenèse normale chez des rats carencés en vitamine A. L’équipe de D. de Rooij avait toutefois montré qu’il est possible de déclencher la spermatogenèse avec l’acide rétinoïque à condition d’en injecter de très fortes doses [ 4]. Cela suggérait que la barrière hématotesticulaire empêche le passage de l’acide rétinoïque de la circulation sanguine vers les cellules germinales, et que les cellules de Sertoli synthétisent de l’acide rétinoïque à partir du rétinol circulant. On sait maintenant que les étapes du métabolisme testiculaire des rétinoïdes sont complexes et font intervenir différents types cellulaires (Figure 2). La première étape a lieu dans les cellules péritubulaires, qui puisent dans la circulation sanguine le rétinol lié à des protéines de transport, telles que la retinol binding protein (RBP) et la transthyrétine (TTR). Le rétinol se lie alors avec une forte affinité à une protéine cellulaire, la CRBP (cellular retinol binding protein), présente en grandes quantités dans les cellules péritubulaires. Il est ensuite libéré, complexé avec une nouvelle RBP, en direction des cellules de Sertoli [18].
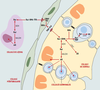 | Figure 2. Métabolisme supposé du rétinol dans le testicule adulte. Le rétinol (Rol) est apporté par la circulation, lié à la rétinol binding protein (RBP), elle-même complexée avec la transthyrétine (TTR). Le rétinol est internalisé dans les cellules péritubulaires puis redistribué aux cellules de Sertoli. Les cellules de Sertoli oxydent le rétinol en acide rétinoïque pour leurs propres besoins et pour ceux des cellules germinales. Elles stockent aussi le rétinol sous forme d’esters de rétinyl (ER). ADH : alcool déshydrogénase ; RALDH : rétinal déshydrogénase ; CRBP : cellular rétinol binding protein ; LRAT : lécithine-rétinol acyltransférase ; Ral : rétinaldéhyde. |
Les cellules de Sertoli constituent le principal site de stockage du rétinol et de synthèse de l’acide rétinoïque [19]. Dans la cellule, le rétinol est également lié à la CRBP dont l’expression varie en fonction du cycle de l’épithélium séminifère, ce qui suggère que les besoins en rétinol dépendent du type de cellules germinales présentes [20]. Il peut alors être oxydé en acide rétinoïque grâce à deux enzymes, l’alcooldéshydrogénase (ADH) et la rétinal déshydrogénase (RALDH) [21]. L’acide rétinoïque serait alors « distribué » aux cellules voisines, en particulier aux cellules germinales. Le rétinol peut aussi être stocké sous forme d’esters de rétinyl sous l’action de la lécithine-rétinol acyltransférase. Ces deux fonctions, de métabolisme et de stockage, sont soumises à régulation. En effet, la production d’acide rétinoïque augmente au cours du développement testiculaire ou sous l’action de la FSH, mais est inhibée par l’acide rétinoïque lui-même. En revanche, le stockage sous forme d’esters de rétinyl est augmenté à la fois par la FSH et par l’acide rétinoïque [21]. Les cellules germinales, en particulier au stade spermatide, expriment aussi l’enzyme d’estérification du rétinol et peuvent donc aussi stocker le rétinol. Quant aux cellules de Leydig, elles expriment les enzymes nécessaires au métabolisme du rétinol en acide rétinoïque [22]. Enfin, les différents types cellulaires du testicule, à l’exception des cellules péritubulaires, expriment des protéines cytoplasmiques nommées cellular retinoic acid binding protein (CRABP) (→), qui se lient à l’acide rétinoïque et facilitent son catabolisme ou son transport vers le noyau [19]. L’importance fonctionnelle de ces protéines n’est pas clairement établie puisque les souris mutantes pour les deux types de CRABP sont normales et fertiles [23]. (→) m/s 1999, n°12, p. 1423 |
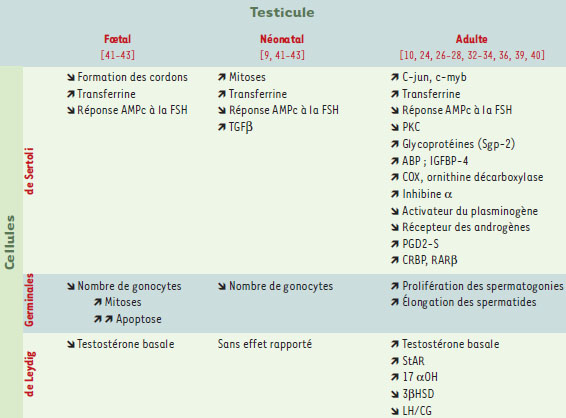
Rétinoïdes et fonctions du testicule adulte Rétinoïdes et spermatogenèse Dans les testicules de rats carencés en vitamine A, la spermatogenèse est bloquée au stade spermatogonie A, et l’apport en rétinoïdes permet une reprise synchronisée de la spermatogenèse dans tous les tubules séminifères. L’injection d’une forte dose d’acide rétinoïque stimule fortement la prolifération des spermatogonies A et permet leur différenciation en spermatogonies B puis en spermatocytes, mais pas en spermatides [ 4, 24]. Seules des injections répétées d’acide rétinoïque permettent d’atteindre le stade spermatide. Enfin, il faut remarquer qu’une carence en vitamine A peut retarder la spermiation (c’est-à-dire la libération des spermatozoïdes dans la lumière des tubules) [ 25]. Il semble donc que les rétinoïdes sont indispensables à la prolifération et à la différenciation des spermatogonies A, au passage vers les stades spermatides rondes puis allongées et à la spermiation. Les effets de l’acide rétinoïque dans les cellules germinales s’exerce très probablement via RAR α. Ce récepteur est en effet exprimé dans ces cellules [8] et les souris mutantes pour RAR α présentent une dégénérescence de l’épithélium germinal semblable à celle des animaux carencés en vitamine A [14]. Mais l’acide rétinoïque agit également sur les cellules de Sertoli et ceci très vraisemblablement par l’intermédiaire de RXR β qui n’est n’exprimé que dans ces cellules [8]. De plus, les souris mutantes pour ce récepteur sont certes stériles, mais présentent une accumulation progressive de lipides dans les cellules de Sertoli bien avant que n’apparaisse, chez les vieux mâles, la dégénérescence de l’épithélium germinal [15]. Le rôle des rétinoïdes sur la spermatogenèse peut donc être soit direct sur les cellules germinales ellesmêmes, soit indirect en modulant la fonction des cellules de Sertoli qui servent de support à la spermatogenèse. Les rétinoïdes sont en effet impliqués dans le contrôle et le maintien de nombreuses fonctions des cellules de Sertoli adultes (Tableau I). Leur rôle sur la production de divers facteurs par ces cellules est le mieux documenté : ils augmentent la production de transferrine, d’androgen binding protein (ABP), d’IGFBP-4 (insulin growth factor binding protein 4), d’inhibine α et de certaines glycoprotéines, notamment la sulfated glycoprotein (Sgp-2), et inhibent la sécrétion de l’activateur du plasminogène et des œstrogènes en réponse à la FSH [26–30]. Les rétinoïdes agissent également sur certaines voies de signalisation dans la cellule de Sertoli. Ainsi, ils diminuent l’expression de la protéine kinase C et du récepteur des androgènes, et réduisent la production d’AMPc en réponse à la FSH [31]. Ils stimulent, par ailleurs, l’expression de certains facteurs de transcription tels que c-jun et c-myb [32]. Les rétinoïdes interfèrent avec le métabolisme cellulaire en augmentant l’expression de l’ornithine décarboxylase et de la cytochrome c oxydase (COX), ce qui traduit un besoin accru en énergie [27]. Ils agissent aussi sur le métabolisme lipidique comme en témoigne l’accumulation de lipides observée dans les tubules des souris mutantes pour RXR β [15], un effet également retrouvé dans les cellules de Sertoli d’animaux en hypervitaminose A.
 | Tableau I. Principaux effets des rétinoïdes sur les cellules testiculaires. Les références correspondantes sont données entre crochets. FSH : follicle stimulating hormone ; TGFβ : transforming growth factor β; PKC : protéine kinase dépendante du calcium ; ABP : androgen binding protein ; IGFBP : insulin-like growth factor binding protein ; COX : cytochrome c oxydase ; PGD2-S : prostaglandine D2 synthétase ; StAR : steroidogenic acute regulatory protein ; 17α OH : cytochrome P450 17 α hydroxylase/C17-20 lyase ; 3βHSD : 3 β-hydroxystéroïde déshydrogénase ; LH/CGR : récepteur de la LH et de la choriogonadotrophine. |
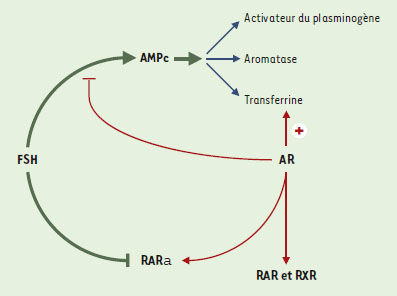
Les rétinoïdes jouent aussi un rôle dans la composition de la membrane basale, ce qui peut modifier l’activité des cellules de Sertoli en modulant la disponibilité des facteurs de croissance. Ils peuvent en effet affecter la synthèse et le dépôt, par les cellules péritubulaires, de certains composants de la matrice extracellulaire comme la laminine et la fibronectine [35]. Enfin, les rétinoïdes peuvent moduler leur propre métabolisme et leur voie de signalisation dans le testicule. En ce qui concerne le métabolisme, ils augmentent l’expression de la protéine cellulaire de liaison CRBP et, dans les cellules de Sertoli, l’acide rétinoïque réduit sa production à partir de rétinol mais favorise le stockage du rétinol. Les rétinoïdes augmentent aussi l’expression de leurs récepteurs RAR α et RAR β ainsi que celle de la prostaglandine D2 synthétase [13, 33, 34]. Cette enzyme, qui a une forte affinité pour l’acide rétinoïque et le rétinol, peut aussi servir de transporteur des rétinoïdes et est très fortement exprimée au niveau de la barrière hémato-testiculaire. Il existe en outre des interactions entre les rétinoïdes et la FSH, principale hormone qui contrôle le fonctionnement de la cellule de Sertoli. Ces interactions sont complexes (Figure 3), la FSH comme l’acide rétinoïque stimulent la sécrétion de transferrine, d’ABP, d’inhibine α [36] et la synthèse d’esters de rétinyl [22]. Pourtant, l’acide rétinoïque inhibe la voie de transduction de la FSH en bloquant la production d’AMPc ainsi que toutes les activités dépendantes de celle-ci telles que l’activité aromatase et la sécrétion d’activateur du plasminogène. Rappelons qu’en retour, la FSH diminue l’expression de RAR α [11]. Par ailleurs, les rétinoïdes, à trop fortes doses, peuvent également être toxiques. Ainsi, une hypervitaminose A chez le rat diminue la masse testiculaire, crée des lésions dans l’épithélium séminifère et perturbe le rythme de la spermatogenèse [37]. Concrètement, la production de spermatozoïdes mûrs est réduite et des cellules germinales immatures sont libérées dans la lumière des tubes séminifères. Des injections de fortes doses d’acide rétinoïque 13-cis, un rétinoïde très stable, bloquent même complètement la spermatogenèse [38].
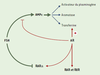 | Figure 3. Représentation schématique des interrelations entre les voies de signalisation de la FSH et celles de l’acide rétinoïque dans la cellule de Sertoli. La FSH inhibe l’expression des récepteurs de l’acide rétinoïque alors que l’acide rétinoïque (AR) inhibe la production d’AMPc, le principal second messager de la FSH. Il existe une inhibition réciproque entre ces deux facteurs qui stimulent pourtant des cibles communes (par exemple, la transferrine). On peut émettre l’hypothèse selon laquelle cette répression mutuelle éviterait une stimulation excessive des cibles communes tout en conservant une redondance en aval des gènes importants. |
Rétinoïdes et stéroïdogenèse Le rôle des rétinoïdes dans la stéroïdogenèse avait été suspecté très tôt devant, d’une part, l’atrophie des organes génitaux internes (prostate et vésicules séminales) et, d’autre part, la fourrure fine de type femelle des rats mâles carencés en vitamine A [ 2]. Cela a été confirmé chez le rat adulte où une carence en vitamine A diminue la production basale de testostérone sans altérer la sécrétion stimulée par la LH [ 39]. L’hypervitaminose A, ou l’injection d’acide rétinoïque 13- cis, diminue le poids des vésicules séminales et de la prostate. De même, elle réduit le volume du tissu interstitiel ainsi que le volume nucléaire des cellules de Leydig [ 37, 38]. Ces données montrent que, comme pour la spermatogenèse, c’est à la fois l’excès et la carence en rétinoïdes qui sont délétères pour la stéroïdogenèse. Le mécanisme d’action des rétinoïdes sur la stéroïdogenèse est partiellement connu. Ils augmentent la sécrétion basale de testostérone des cellules de Leydig adultes en culture primaire mais diminuent la sécrétion de testostérone stimulée par la LH. Ces résultats apparemment contradictoires ont été expliqués grâce aux études réalisées sur des lignées issues de cellules de Leydig [40] : le rétinol et l’acide rétinoïque diminuent en effet l’expression du récepteur de la LH, mais augmentent fortement celle de certaines enzymes de la stéroïdogenèse telles que la P450 C17 α-hydroxylase/C17-20 lyase et la steroidogenic acute regulatory protein. |
Rétinoïdes et développement testiculaire L’acide rétinoïque est capable de perturber la formation des cordons séminifères dans le testicule fœtal de rat, probablement en perturbant la formation de la membrane basale [41, 42] (Figure 4). Il a également de nombreux autres effets sur le développement du testicule (Tableau I). Ainsi, Cupp et al. ont montré que les rétinoïdes augmentaient la transcription des trois isoformes du TGFβ (transforming growth factor β) des cellules testiculaires néonatales en culture. Cela pourrait expliquer la diminution de la croissance et de la prolifération cellulaire, observée sous l’action de l’acide rétinoïque, dans un modèle de cellules testiculaires dispersées.
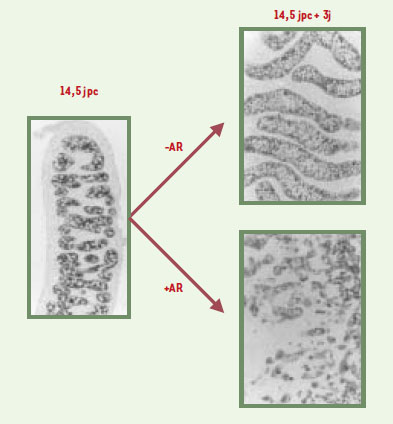
 | Figure 4. Effet de l’acide rétinoïque sur la mise en place des cordons dans le testicule fœtal. Un testicule fœtal de rat a été explanté à 14,5 jours postconception (jpc) et cultivé pendant 3 jours en l’absence ou en présence de 10-6 M d’acide rétinoïque. Au moment de l’explantation (14,5 jpc) et après culture (14,5 jpc + 3 j), les cellules de Sertoli ont été visualisées en réalisant une immunolocalisation de l’hormone anti-müllérienne (AMH). À l’explantation, les cordons séminifères sont bien différenciés ; après 3 jours de culture en milieu témoin, les cordons se sont bien développés. En revanche, en présence d’acide rétinoïque, leur organisation est totalement perturbée. |
En utilisant un système de culture organotypique, notre équipe a montré récemment que l’acide rétinoïque inhibe l’effet stimulant de la FSH sur la production d’AMPc par les cellules de Sertoli fœtales et néonatales de rat, un effet comparable à celui observé dans le testicule adulte. L’utilisation d’analogues synthétiques, spécifiques des différents RAR et des RXR, a montré que cet effet impliquait RAR α [43]. En outre, après la naissance, l’acide rétinoïque augmente la prolifération des cellules de Sertoli via RXR β [43]. Nous avons également montré que l’acide rétinoïque diminue le nombre des gonocytes fœtaux et néonatals par augmentation de l’apoptose via l’activation de RAR α [9, 42, 43]. Inversement, l’invalidation de RAR α se traduit par une augmentation du nombre de cellules germinales chez les fœtus et les nouveau-nés, ce qui démontre l’implication de ce récepteur dans le contrôle de la gamétogenèse fœtale et suggère que les concentrations circulantes de rétinoïdes exercent physiologiquement un effet négatif sur la mise en place de la lignée germinale chez la souris. Contrairement à ce que l’on observe dans les testicules adultes, les rétinoïdes sont capables de diminuer la sécrétion basale de testostérone des cellules de Leydig fœtales de rat au moment où celles-ci se différencient [42]. Ainsi, la réceptivité à l’acide rétinoïque des cellules de Leydig diffère chez l’adulte et chez le fœtus à l’instar d’autres fonctions spécifiques telles que la dépendance de leur différenciation vis-à-vis des hormones gonadotropes [5]. La carence fœtale modérée en vitamine A, chez le rat, provoque une augmentation de la stéroïdogenèse testiculaire pendant la vie fœtale et néonatale, ce qui montre que les concentrations circulantes de rétinol exercent physiologiquement un effet inhibiteur sur le développement de la fonction endocrine du testicule dans cette espèce. |
Les rétinoïdes sont clairement impliqués dans la régulation des fonctions testiculaires et la connaissance de leurs mécanismes d’action a beaucoup progressé même si ceux-ci sont encore loin d’être totalement élucidés. Jusqu’à présent, les recherches sur les effets, l’implication physiologique et le mode d’action des rétinoïdes dans les fonctions testiculaires ont été exclusivement conduites chez les rongeurs et, de façon surprenante, aucune étude n’a encore été effectuée chez les primates ou dans l’espèce humaine. Il serait pourtant important de déterminer, en particulier, si l’emploi thérapeutique des rétinoïdes a des conséquences sur les fonctions testiculaires chez l’homme. |
1. Gerster H. Vitamin A-functions, dietary requirements and safety in humans. Int J Vitam Nutr Res 1997; 67 : 71–90. 2. Thompson JN, Howell JMC, Pitt GAJ. Vitamin A and reproduction in rats. Proc R Soc Med 1964; 159 : 510–35. 3. Appling DR, Chytil F. Evidence of a role for retinoic acid (vitamin A-acid) in the maintenance of testosterone production in male rats. Endocrinology 1981; 108 : 2120–3. 4. Van Pelt A, de Rooij D. Retinoic acid is able to reinitiate spermatogenesis in vitamin A deficient rats and high replicate doses support the full development of spermatogenic cells. Endocrinology 1991; 128 : 697–704. 5. Habert R, Lejeune H, Saez JM. Origin, differentiation and regulation of fetal and adult Leydig cells. Mol Cell Endocrinol 2001; 179 : 47–74. 6. Olaso R, Habert R. Genetic and cellular analysis of male germ cell development. J Androl 2000; 21 : 497–511. 7. Giguère V. Retinoic acid receptor and cellular retinoid binding proteins: complex interplay in retinoid signaling. Endocrinol Rev 1994; 15 : 61–79. 8. Dufour JM, Kim KH. Cellular and subcellular localization of six retinoid receptors in rat testis during postnatal development : identification of potential heterodimeric receptors. Biol Reprod 1999; 61 : 1300–8. 9. Boulogne B, Levacher C, Durand P, Habert R. Retinoic acid receptors and retinoid X receptors in the rat testis during fetal and posnatal development: immunolocalization and implication in the control of the number of gonocytes. Biol Reprod 1999; 61 : 1548–57. 10. Gaemers I C, van Pelt AMM, van der Saag PT, Hoogerbrugge JW, Themmen A, de Rooij DG. Differential expression pattern of retinoid X receptors in adult murine testicular cells implies varying roles for these receptors in spermatogenesis. Biol Reprod 1998; 59 : 1351–6. 11. Braun KW, Tribley WA, Griswold MD, Kim KH. Follicle-stimulating hormone inhibits all-trans-retinoic acid-induced retinoic acid receptor alpha nuclear localization and transcriptional activation in mouse Sertoli cell lines. J Biol Chem 2000; 275 : 4145–51. 12. Akmal KM, Dufour JM, Vo M, Higginson S, Hee Kim K. Ligand-dependent regulation of retinoic acid receptor α in rat testis: in vivo response to depletion and repletion of vitamin A. Endocrinology 1998; 139 : 1239–48. 13. Gaemers I C, van Pelt AMM, van Der Saag PT, Hoogerbrugge JW, Themmen APN, de Rooij DG. Effect of retinoid status on the messenger ribonucleic acid expression of nuclear retinoid receptors α, β and γ and retinoid X receptors α, β and γ in the mouse testis. Endocrinology 1997; 138 : 1544–51. 14. Lufkin T, Lohnes D, Mark M, et al. High postnatal lethality and testis degeneration in retinoic acid receptor α mutant mice. Dev Biol 1993; 90 : 7225–9. 15. Kastner P, Mark M, Mark L, Dierich A, Chambon P. Abnormal spermatogenesis in RXR β mutant mice. Genes Dev 1996; 10 : 80–92. 16. Leo C, yang X, Liu J, Li H, Chen JD. Role of retinoid receptor coactivator pockets in cofactor recruitment and transcriptional regulation. J Biol Chem 2001; 276 : 23127–34. 17. Wei LN, Farooqui M, Hu X. Ligand-dependent formation of retinoid receptors, receptorinteracting protein 140 (RIP140), and histone deacetylase complex is mediated by a novel receptor-interacting motif of RIP140. J Biol Chem 2001; 276 : 16107–12. 18. Davis JT, Ong DE. Retinol processing by the peritubular cell from rat testis. Biol Reprod 1995; 52 : 356–64. 19. Cavazzini D, Galdieri M, Ottonello S. Retinoic acid synthesis in the somatic cells of rat seminiferous tubules. Biochim Biophys Acta 1996; 1313 : 139–45. 20. Blaner WS, Galdieri M, Goodman DS. Distribution and levels of cellular retinol- and cellular retinoic acid-binding protein in various types of rat testis cells. Biol Reprod 1987; 36 : 130–7. 21. Guo X, Morris P, Gudas L. Follicle-stimulating hormone and leukemia inhibitory factor regulate Sertoli cell retinol metabolism. Endocrinology 2001; 142 : 1024–32. 22. Deltour L, Haselbeck RJ, Ang HL, Duester G. Localization of class I and class IV alcohol dehydrogenases in mouse testis and epididymis: potential retinol dehydrogenases for endogenous retinoic acid synthesis. Biol Reprod 1997; 56 : 102–9. 23. Lampron C, Rochette-Egly C, Gorry P, et al. Mice deficient in cellular retinoic acid binding protein II (CRABPII) or in both CRABPI and CRABPII are essentially normal. Development 1995; 121 : 539–48. 24. Gaemers IC, Sonneveld E, van Pelt AM, et al. The effect of 9-cis-retinoic acid on proliferation and differentiation of a spermatogonia and retinoid receptor gene expression in the vitamin A-deficient mouse testis. Endocrinology 1998; 139 : 4269–76. 25. Huang HF, Marshall GR. Failure of spermatid release under various vitamin A states : an indication of delayed spermiation. Biol Reprod 1983; 28 : 1163–72. 26. Sigillo F, Guillou F, Fontaine I, Benahmed M, Le Magueresse-Battistoni B. In vitro regulation of rat Sertoli cell transferrin expression by tumor necrosis factor alpha and retinoic acid. Mol Cell Endocrinol 1999; 148 : 163–70. 27. Gaemers IC, Van Pelt AM, Themmen AP, De Rooij DG. Isolation and characterization of all-transretinoic acidresponsive genes in the rat testis. Mol Reprod Dev 1998; 50 : 1–6. 28. Galdieri M, Nistico L. Retinoids regulate gonadotropin action in cultured rat Sertoli cells. Biol Reprod 1994; 50 : 171–7. 29. Rosselli M, Skinner MK. Developmental regulation of Sertoli cell aromatase activity and plasminogen activator production by hormones, retinoids and the testicular paracrine factor, PModS. Biol Reprod 1992; 46 : 586–94. 30. Canipari R, Galdieri M. Retinoid modulation of plasminogen activator production in rat Sertoli cells. Biol Reprod 2000; 63 : 544–50. 31. Galdieri M, Nistico L. Retinoids regulate gonadotropin action in cultured rat Sertoli cells. Biol Reprod 1994; 50 : 171–7. 32. Page KC, Heitzman DA, Chernin MI. Stimulation of c-jun and c-myb in rat Sertoli cells following exposure to retinoids. Biochem Biophys Res Commun 1996; 222 : 595–600. 33. Eskild W, Oyen O, Beebe S, Jahnsen T, Hansson V. Regulation of mRNA levels for cellular retinol binding protein in rat Sertoli cells by cyclic AMP and retinol. Biochem Biophys Res Commun 1988; 152 : 1504–10. 34. Samy ET, Li JC, Grima J, Lee WM, Silvestrini B, Cheng CY. Sertoli cell prostaglandin D2 synthetase is a multifunctional molecule: its expression and regulation. Endocrinology 2000; 141 : 710–21. 35. Ricci G, Catizone A, Scarcella MF, Galdieri M. Vitamin A modulation of basement membrane production by purified testicular myoid cells. Exp Cell Res 1999; 249 : 102–8. 36. Skinner M, Schlitz S, Anthony C. Regulation of Sertoli cell differentiated function: testicular transferrin and androgenbinding protein expression. Endocrinology 1989; 124 : 3015–24. 37. Lamano Carvalho TL, Lopes RA, Azoubel R, Ferreira AL. Morphometric study of the reversibility of testicle alterations in rats submitted to hypervitaminosis A. Int J Vitam Nutr Res 1978; 48 : 316–24. 38. Sadek IA, Abdul-Mohsen MH. Long-term administration of vitamin A and the process of spermatogenesis. East Mediterr Health J 1999; 5 : 123–9. 39. Appling DR, Chytil F. Evidence of a role for retinoic acid (vitamin A-acid) in the maintenance of testosterone production in male rats. Endocrinology 1981; 108 : 2120–3. 40. Lefèvre A, Rogier E, Astraudo C, Duquenne C, Finaz C. Regulation by retinoids of luteinizing hormone/chorionic gonadotropin receptor, cholesterol side-chain cleavage cytochrome P-450, 3 β-hydroxysteroid dehydrogenase/Δ5-4-isomerase and 17α-hydroxylase/C17-20 lyase cytochrome P-450 messenger ribonucleic acid levels in the K9 mouse Leydig cell line. Mol Cell Endocrinol 1994; 106 : 31–9. 41. Cupp A, Dufour J, Kim G, Skinner M, Kim K. Action of retinoids on embryonic and early postnatal testis development. Endocrinology 1999; 140 : 2343–52. 42. Livera G, Rouiller-Fabre V, Durand P, Habert R. Multiple effects of retinoids on the development of Sertoli, germ and Leydig cells of fetal and neonatal rat testis in culture. Biol Reprod 2000; 62 : 1303–14. 43. Livera G, Rouiller-Fabre V, Habert R. Retinoid receptors involved in the effects of retinoic acid on rat testis development. Biol Reprod 2001; 64 : 1307–14. |