La restriction calorique prolonge la durée de vie de nombreux animaux [1]. Ainsi, la longévité d’une souris dont l’alimentation est limitée peut être jusqu’à 30 % supérieure à celle d’une souris qui se nourrit à volonté. Des expériences sont en cours sur de grands singes pour déterminer si ce phénomène existe également chez les primates. Les résultats préliminaires obtenus sont prometteurs et suggèrent que la restriction calorique pourrait augmenter la longévité humaine [2, 3]. Il s’agirait alors du seul traitement connu pour accroître notre espérance de vie.
Les mécanismes par lesquels la restriction calorique agit sur la longévité sont inconnus. L’explication la plus couramment invoquée implique les radicaux libres. Ces molécules, produites par la respiration cellulaire, sont fortement réactives et peuvent oxyder lipides, protéines et acides nucléiques dans la cellule. L’accumulation de dommages dus aux radicaux libres serait l’une des causes du vieillissement cellulaire [4,5]. De nombreux résultats expérimentaux confortent cette théorie: par exemple, la durée de vie de la drosophile est accrue par l’augmentation de l’expression des enzymes qui neutralisent les radicaux libres dans cet organisme. Chez les mammifères, la restriction calorique semble s’accompagner d’une diminution des dommages oxydatifs [5]. Ainsi, la restriction calorique pourrait diminuer la formation des radicaux libres en ralentissant le métabolisme et/ou en renforçant les mécanismes de défense cellulaire contre l’oxydation.
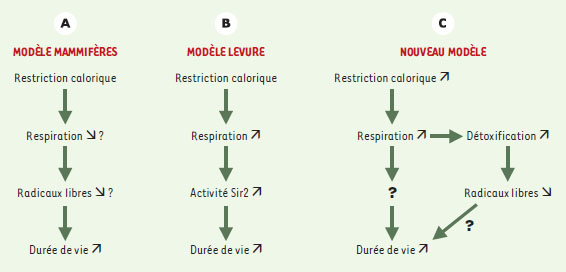
La levure de boulanger Saccharomyces cerevisiae est, elle aussi, soumise au vieillissement, et on appelle durée de vie des cellules le nombre de divisions qu’elles peuvent effectuer avant d’atteindre la sénescence (→). Leonard Guarente et son équipe ont montré que les effets bénéfiques de la restriction calorique s’appliquent également à S. cerevisiae [6]. Ces cellules sont habituellement cultivées en présence de glucose. Or, la diminution de la concentration de glucose dans le milieu de culture augmente la durée de vie des cellules de 20 à 30 % [6] (→→). Partant de cette observation, Lin et al. ont utilisé des techniques de génétique et de biologie moléculaire pour disséquer les mécanismes par lesquels la restriction calorique augmente la longévité des cellules de levure [7]. Leurs résultats sont surprenants à plus d’un titre. En effet, contrairement aux résultats attendus, les cellules carencées ne sont pas plus résistantes aux dommages oxydatifs que des cellules témoins. Au contraire, la restriction calorique s’accompagne d’un accroissement de la respiration et, de façon surprenante, c’est cet accroissement de la respiration qui est lui-même responsable de l’allongement de la longévité. Le groupe de Guarente, en mesurant l’oxygène consommé par les cellules, a tout d’abord observé que la restriction calorique provoquait une augmentation de la respiration cellulaire. On peut proposer une explication simple à ce phénomène. La levure dispose de deux voies métaboliques principales pour produire de l’ATP à partir de nutriments: la respiration et la fermentation. La fermentation est une cascade de réactions enzymatiques qui a lieu dans le cytoplasme. En revanche, la respiration met en œuvre le cycle de l’acide tricarboxylique et les réactions de phosphorylation oxydative qui ont lieu dans les mitochondries. Quand les ressources nutritives sont abondantes, la fermentation est prédominante. Quand ces ressources se raréfient, les cellules privilégient la respiration, qui produit plus d’ATP. L’augmentation de l’activité respiratoire des cellules soumises à une restriction calorique peut donc se comprendre, mais a-t-elle un rôle dans l’accroissement de la longévité?
(→) m/s 1999, n° 12, p. 1454
(→→) m/s 2001, n° 6-7, p. 764
Pour le savoir, les auteurs ont d’abord produit des cellules incapables de respirer. Pour ce faire, ils ont délété des cellules le gène CYT1, qui code pour le cytochrome c1. Ce transporteur des électrons de la membrane mitochondriale est indispensable à la respiration. Dans un milieu riche en glucose, des cellules dépourvues de CYT1 ont une durée de vie normale, ce qui confirme le caractère facultatif de la respiration sur milieu riche. Mais l’observation clé de Lin et de ses collègues, c’est que ces cellules dépourvues de CYT1 ne vivent pas plus longtemps en milieu carencé en glucose qu’en milieu riche, contrairement aux cellules de type sauvage. La respiration est donc nécessaire à l’accroissement de longévité des cellules de levure induit par la restriction calorique.
Les auteurs ont ensuite cherché à déterminer si l’augmentation de la respiration pouvait suffire à augmenter la longévité des cellules. Ils ont à cet effet utilisé un intéressant stratagème génétique. Le facteur de transcription Hap4 est le principal activateur des gènes nécessaires à la respiration. Quand la concentration de glucose dans le milieu est élevée, l’expression de Hap4 est réprimée et la respiration est faible. Mais en surexprimant artificiellement Hap4, on peut induire la respiration même en milieu riche [8]. Lin et al. observent que la surexpression de Hap4 augmente effectivement la consommation d’oxygène des cellules, et que cette respiration accrue s’accompagne d’un accroissement de la longévité cellulaire. L’effet de Hap4 est bien dû à la respiration, car sa surexpression reste sans effet sur un mutant privé de CYT1, qui ne peut donc pas respirer. Ces résultats démontrent que l’augmentation de la respiration suffit, à elle seule, à prolonger la durée de vie des cellules.
Cette situation est pour le moins inattendue, car l’accroissement de la respiration devrait s’accompagner d’une production accrue de radicaux libres, dont on sait qu’ils accélèrent le vieillissement. L’accroissement de la respiration augmenterait-il la résistance des cellules aux radicaux libres? Deux observations des auteurs réfutent cette possibilité. Tout d’abord, l’analyse du transcriptome des cellules par micropuces à ADN montre que la restriction calorique n’induit pas les enzymes de détoxification des radicaux libres. De plus, les auteurs observent que la restriction calorique ne rend pas les cellules plus résistantes à différents agents producteurs de radicaux libres. Pour disséquer ce phénomène au niveau moléculaire, les auteurs se sont intéressés à la protéine Sir2, une désacétylase impliquée dans le contrôle de la durée de vie de la levure, et probablement aussi d’autres organismes [9] (→). En effet, des expériences antérieures ont montré que Sir2 est nécessaire à l’effet de la restriction calorique sur la longévité de la levure [6]. Cet effet de Sir2 passe-t-il par la respiration? Sir2 peut-il stimuler la respiration ou au contraire l’augmentation de la respiration active-t-elle Sir2? Pour répondre à ces questions, deux séries d’expériences ont été réalisées. D’une part, l’activité de Sir2 a été estimée en mesurant l’expression d’un gène rapporteur inséré dans l’ADN ribosomique de levure, dont Sir2 est un répresseur transcriptionnel [9]. Les auteurs montrent par cette mesure indirecte que la restriction calorique augmente l’activité de Sir2. La surexpression de Hap4, qui induit la respiration même en milieu riche, a le même effet. De plus, les auteurs rapportent qu’en l’absence de Sir2, la surexpression de Hap4 augmente la respiration mais n’augmente pas la longévité. Ces observations montrent sans ambiguïté que Sir2 se trouve en aval de la respiration dans la cascade de facteurs contrôlant la durée de vie de la levure (Figure 1). En revanche, le mécanisme par lequel la respiration active Sir2 reste spéculatif. Sachant qu’in vitro, l’activité de Sir2 dépend directement de la concentration de son co-facteur, le nicotinamide adénine dinucléotide (NAD), les auteurs proposent que le NAD produit par la respiration dans la mitochondrie soit exporté vers le cytoplasme où il activerait Sir2.
(→) m/s2001, n° 6-7, p. 764
| Figure 1. Restriction calorique, radicaux libres et longévité: anciens et nouveaux modèles. A. La restriction calorique prolonge la durée de vie des mammifères. Cet effet est généralement attribué à une diminution de la production de radicaux libres, que l’on pense due à une diminution de la respiration. B. La restriction calorique augmente le potentiel de division des cellules de levure. Lin et al. montrent que la respiration des levures soumises à la restriction calorique augmente. Cette augmentation accroît l’activité de la protéine Sir2, mais n’a pas d’effet sur la résistance aux radicaux libres. C. Si le mécanisme découvert chez S. cerevisiae est également à l’œuvre chez les mammifères, la diminution des radicaux libres pourrait être une conséquence de l’augmentation de la respiration. |
L’article de Lin et al. montre de façon convaincante que les radicaux libres ne sont pas impliqués dans le vieillissement de la levure S. cerevisiae. Contrairement aux apparences, ce résultat n’est pas incompatible avec la théorie impliquant les radicaux libres dans la sénescence. En effet, et comme le rappellent Lin et al., il est presque certain que les radicaux libres sont en partie responsables du vieillissement des cellules post-mitotiques, c’est-à-dire les cellules ayant perdu la capacité de se diviser [4, 5].
Ces résultats mettent peut-être en lumière une différence fondamentale entre les mécanismes de vieillissement des cellules mitotiques et post-mitotiques qu’il sera intéressant d’explorer dans les cellules des organismes supérieurs.