| |
| Med Sci (Paris). 2002 December; 18(12): 1219–1226. Published online 2010 October 20. doi: 10.1051/medsci/200218121219.Assemblage du fuseau de division : le secret des chromosomes Rafael E. Carazo-Salas1* and Stéphane Brunet2** 1Cell Cycle Laboratory, Cancer Research UK, London Research Institute, 44 Lincoln’s Inn Fields, Londres WC2A 3PX, Royaume-Uni 2EMBL, Meyerhofstrasse 1, 69117 Heidelberg, Allemagne |
À chaque division cellulaire, la distribution du matériel génétique en deux lots identiques aux cellules filles est réalisée par une structure fascinante constituée essentiellement de microtubules: le fuseau de division. Les microtubules, longs et relativement stables durant l’interphase, irradient le cytoplasme de façon isotropique à partir d’un unique centre organisateur de microtubules: le centrosome. L’entrée en mitose, après la duplication du matériel génétique et du centrosome, s’accompagne de la réorganisation complète de ce réseau microtubulaire. Le nombre de microtubules organisés par les centrosomes est décuplé, les microtubules deviennent dynamiques et leur taille réduite. Après condensation de la chromatine, rupture de l’enveloppe nucléaire et migration des centrosomes de part et d’autre du noyau, les microtubules croissent préférentiellement vers la masse des chromosomes. Un fuseau bipolaire est mis en place. Les microtubules interagissent avec les bras des chromosomes et les kinétochores. Ces derniers sont des structures multiprotéiques individualisées accolées à une région particulière de chaque chromatide: le centromère. Ces microtubules kinétochoriens forment un faisceau ou « fibre kinétochorienne » qui permet de connecter chaque chromosome aux pôles opposés du fuseau. Le chromosome est alors bi-orienté. Enfin, ces chromosomes bi-orientés sont soumis à des forces antagonistes exercées par les microtubules sur leurs bras et leurs kinétochores qui conduisent à l’alignement des chromosomes sur la plaque métaphasique, étape qui précède leur ségrégation en anaphase. Les chromosomes ont longtemps été considérés comme des éléments passifs au cours de la division cellulaire, comme le résume la formule de D. Mazia les assimilant à « des cadavres à des funérailles » (cité dans [1]). De récentes et nombreuses études indiquent qu’ils jouent en fait un rôle essentiel dans le processus de formation du fuseau de division. Cet article est consacré aux mécanismes et aux facteurs moléculaires qui permettent aux chromosomes de promouvoir la polymérisation et la stabilisation des microtubules et donc la formation du fuseau de division [2]. |
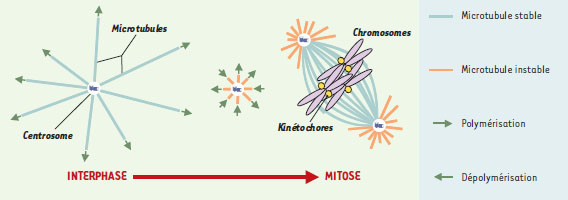
Déstabilisation globale puis restabilisation locale : le secret des chromosomes La plasticité des cellules, nécessaire à leur croissance et à leur division, dépend, entre autres, de leur cytosquelette de microtubules. Les microtubules possèdent un comportement unique de polymérisation appelé instabilité dynamique. Ce comportement permet à chaque polymère d’être labile, en alternant entre des phases de croissance (polymérisation) et de décroissance (dépolymérisation) [3]. À l’intérieur d’une cellule, la cinétique de polymérisation des microtubules dépend des effets combinés des protéines associées aux microtubules, ou MAP (facteurs stabilisants et déstabilisants), dont l’activité est contrôlée par leur localisation intracellulaire et par des modifications post-traductionnelles dépendantes des régulateurs du cycle cellulaire [3, 4]. Ainsi, lorsqu’une cellule entre en phase M de mitose ou de méiose, les microtubules qui sont longs et stables en interphase (chaque polymère possède une demi-vie de l’ordre d’une dizaine de minutes), se racourcissent et acquièrent un comportement très dynamique avec une demi-vie de l’ordre d’une dizaine de secondes, entraînant un recyclage plus rapide [3] (Figure 1). Dans des extraits d’œufs de xénope, lors de cette transition, le raccourcissement des microtubules et l’accroissement de la fréquence à laquelle surviennent des « catastrophes », ce terme désignant le passage d’un état de polymérisation à un état de dépolymérisation (→), sont corrélés à l’activation de la kinase mitotique majeure Cdk11
(cyclin dependent kinase) [5]. Cdk1 induirait également la phosphorylation et l’inactivation de la MAP stabilisatrice XMAP215. La protéine antagoniste de XMAP215, le facteur de catastrophes XKCM1 (Xenopus kinesin with central motor domain) deviendrait alors pleinement active [6]. Ce même type de régulation pourrait contrôler l’activité d’autres facteurs, telles que la Stathmine/ Op18 (voir paragraphe suivant) et XMAP230 (→→). Dans de nombreux systèmes cellulaires, les microtubules subissent en phase M, outre cette déstabilisation globale, une dépolymérisation persistante à leur extrémité (-) qui s’accompagne d’un flux de microtubules vers leur pôle d’origine (« flux polaire ») [2]. (→) m/s 1999, n°5, P.739
(→→) m/s 2002, n° 12, p. 1225
 | Figure 1.
Restabilisation locale des microtubules autour de la chromatine en phase M. De gauche à droite : à la suite d’une déstabilisation du réseau global de microtubules en phase M, la chromatine (violet) induit une restabilisation des polymères dans son voisinage. Microtubules stables : bleu clair ; microtubules instables : orange ; centrosome : bleu foncé ; kinétochores : jaune. |
Le fuseau est donc, en dépit de son apparence « figée », une structure composée de microtubules hyper-labiles et cette caractéristique est indispensable à sa formation [7]. Cependant, il ne pourrait pas y avoir de constitution du fuseau dans cet environnement cytoplasmique déstabilisant sans l’existence de mécanismes de restabilisation locale des microtubules. Les chromosomes sont les principaux acteurs de cette restabilisation. Ils s’opposent localement à la dépolymérisation grâce à la chromatine qui permet une polymérisation persistante de microtubules autour des chromosomes, et ils stabilisent des microtubules provenant des pôles opposés du fuseau en permettant leur attachement aux kinétochores et la formation des fibres kinétochoriennes. Nous allons décrire chacun de ces mécanismes. |
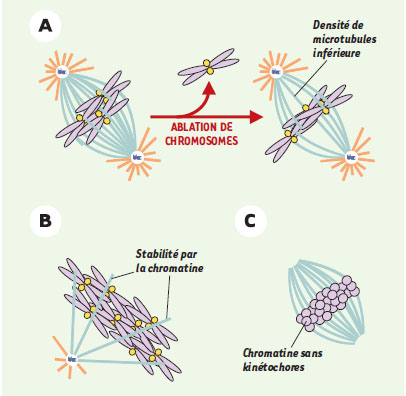
L’« effet chromatine » mitotique La chromatine favorise l’assemblage des microtubules du fuseau Des données provenant de systèmes divers démontrent que la chromatine stimule la polymérisation des microtubules lors de la formation du fuseau (Figure 2). 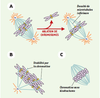 | Figure 2.
« Effet chromatine » durant l’assemblage du fuseau. A. L’ablation de chromosomes dans des cellules provoque une réduction de la quantité totale des microtubules du fuseau. B. La chromatine induit une stabilisation des microtubules engendrés à partir d’un centrosome. C. En l’absence de centro-some, les billes de chromatine sans kinétochores sont à même d’engendrer des microtubules (orange: microtubules instables; bleu clair: microtubules plus stables; violet: chromatine; jaune: kinétochores; bleu foncé: centrosome). |
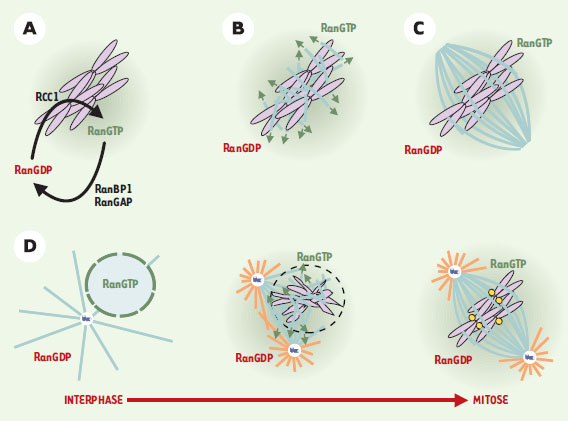
Dans des spermatocytes de sauterelle Melanoplus differentialis, une série d’expériences a suggéré que les chromosomes sont indispensables à l’assemblage des microtubules du fuseau: l’ablation partielle des chromosomes provoque une réduction de la quantité totale des microtubules du fuseau. Cette réduction n’est pas proportionnelle au nombre de kinétochores absents mais à la masse de chromatine éliminée [8]. Dans ces mêmes cellules en interphase, la libération dans le cytoplasme du contenu du noyau, par micro-perforation de l’enveloppe nucléaire, induit la formation prématurée d’un fuseau bipolaire. Les facteurs nécessaires à cette « activation nucléaire » sont associés à la chromatine [9]. Ces observations ont été corroborées par des résultats d’expériences réalisées avec des extraits d’œufs de xénope [10]. En particulier, l’étude de la cinétique de polymérisation de microtubules provenant de centrosomes a révélé que lorsque ces microtubules sont en contact avec de la chromatine, leur fréquence de « catastrophes » diminue alors que celle des « sauvetages » (transition d’un état de dépolymérisation à un état de polymérisation) augmente [11]. L’ensemble de ces résultats suggère que la chromatine inverse localement la déstabilisation globale des microtubules en phase M. Cet « effet chromatine » a été également mis en évidence dans des systèmes dépourvus de centrosome. La microinjection de noyaux issus de karyoplastes, ou l’injection d’ADN de phage, dans des œufs de grenouille non fertilisés bloqués en métaphase (et dépourvus de centrosome), provoque la formation de réseaux bipolaires de microtubules autour de la chromatine [12]. De même, l’introduction dans des extraits d’œufs de xénope de billes magnétiques recouvertes d’ADN non spécifique, ou « billes de chromatine », induit la formation d’un fuseau bipolaire autour d’elles [13]. Il faut noter que l’orientation des microtubules est identique (extrémités [-] aux pôles du fuseau et extrémités [+] vers la plaque métaphasique) dans tous les types de fuseaux répertoriés, ce qui suggère pour tous un même mécanisme d’assemblage du fuseau [14]. Enfin, un fuseau bipolaire peut s’assembler dans des cellules somatiques de mammifère après ablation de leurs centrosomes [15]. Dans tous ces systèmes, la chromatine seule est donc capable d’induire l’assemblage de microtubules dans un cytoplasme déstabilisant, indépendamment de sources prédéfinies de microtubules. Nature moléculaire de l’« effet chromatine » Les premières protéines potentiellement impliquées dans cet « effet chromatine » ont été caractérisées dans les extraits d’œufs de xénope. Parmi celles-ci, la Stathmine/Op18 est un facteur déstabilisant les microtubules, actif lorsqu’il est déphosphorylé et inactivé par la phos-phorylation [ 16] . Dans des extraits d’œufs en phase M, Op18 est maintenue sous sa forme active, probablement par la phosphatase PP2A. L’ajout de billes de chromatine à l’extrait induit la phosphorylation d’Op18 [ 17], suggérant l’existence d’une kinase associée à la chromatine [ 17, 18] capable d’inactiver localement Op18, rendant ainsi les microtubules mitotiques plus stables près de la chromatine. Une avancée considérable dans la compréhension de l’« effet chromatine » provient de la mise en évidence d’un rôle régulateur « mitotique » de la protéine Ran, une petite GTPase de la famille des Ras2 [20, 21] (Figure 3). Dans des extraits d’œufs de xénope, Ran, associée au GTP, déclenche l’assemblage de microtubules et leur organisation en fuseau en l’absence de centrosomes, voire même de chromosomes [19]. De plus, RCC1, le facteur d’échange qui active Ran, est associé aux chromosomes [20, 21] et se trouve fortement concentré sur les billes de chromatine dans ces extraits. L’assemblage d’un fuseau autour des billes de chromatine dépend de la production de Ran-GTP par la chromatine même [22]. Ran-GTP pourrait être ainsi le principal activateur de l’« effet chromatine » dans ce type de fuseau [19]. Ran-GTP règle aussi l’assemblage de microtubules du centrosome. Dans ces extraits, Ran-GTP est nécessaire à l’assemblage d’un fuseau qui contient des centrosomes et des kinétochores, et provient de spermatozoïdes [23]. Les microtubules reliant centrosomes et kinétochores ne suffisent donc pas à la formation d’un fuseau bipolaire robuste. En conclusion, l’« effet chromatine » relayé par Ran est commun et nécessaire à la formation de fuseaux en présence ou en l’absence de sources prédéfinies de microtubules (centrosomes). En accord avec les résultats obtenus in vitro, la régulation de l’assemblage de microtubules par Ran a récemment été mise en évidence in vivo, dans des cellules de mammifères et chez la levure [24, 25]. Quant aux effecteurs de Ran, ils commencent seulement à être caractérisés [19].  | Figure 3.
« Effet chromatine » relayé par la GTPase Ran. A. Cycle GTPasique de Ran. L’activité GAP (RanBP1/RanGAP) est cytoplasmique tandis que l’activité d’échange GEF (RCC1) est associée aux chromosomes. B. Rôle de Ran dans l’assemblage du fuseau sans centrosomes. La concentration en RCC1 des chromosomes permet de produire la forme Ran-GTP (vert) en concentration suffisante pour induire l’assemblage de microtubules dans le voisinage des chromosomes. C. Organisation d’un fuseau bipolaire autour de la chromatine. D. Rôle de Ran dans l’assemblage du fuseau avec centrosomes. Lors de la rupture de l’enveloppe nucléaire (pointillé), Ran-GTP (vert) serait libérée dans le voisinage des centrosomes et induirait une augmentation de la quantité et de la longueur des microtubules centrosomiques. GAP: GTPase activating protein; GEF: guanosine exchange factor; violet: chromatine; jaune: kinétochores; bleu foncé: centrosome; bleu clair: microtubules stables; orange: microtubules instables. |
L’ensemble de ces résultats démontre que la chromatine stimule l’assemblage des microtubules durant la formation du fuseau. Cet « effet chromatine » semble être le principal mécanisme responsable de l’assemblage et du maintien des microtubules du fuseau au sein d’un cytoplasme déstabilisant en phase M. Des moteurs moléculaires impliqués dans l’« effet chromatine » ? L’« effet chromatine » peut dépendre également de moteurs moléculaires, appelés chromo-moteurs, qui interagissent à la fois avec les microtubules et la chromatine. Ces moteurs contribuent à la formation du fuseau bipolaire et aux mouvements des chromosomes [ 2]. Ils pourraient aussi favoriser la stabilisation des microtubules autour de la chromatine. En premier lieu, ces chromomoteurs pourraient réduire la dépolymérisation des microtubules déjà stabilisés par l’« effet chromatine ». In vitro, la kinésine est capable de ralentir la dépolymérisation de microtubules individuels [26]. Certaines chromo-kinésines, telles que Xkid (xenopus kinesin with DNA binding domain) et Xklp1 (xenopus kinesin-like protein) [27, 28], stabiliseraient ainsi les microtubules avec lesquels elles interagissent au niveau des bras des chromosomes. Cette hypothèse reste à vérifier. Par ailleurs, certains chromo-moteurs, en assurant l’ancrage de microtubules aux bras des chromosomes, maintiennent l’ensemble des chromosomes en un volume réduit du cytoplasme et peuvent, par ce moyen, contribuer à la création de « l’effet chromatine ». Cet effet requiert une concentration-seuil de chromatine. Par exemple, dans un extrait d’œufs de xénope, un nombre minimal de billes de chromatine est nécessaire à l’assemblage d’un fuseau [22]. Certains types de chromo-moteurs, comme Nod (NO distributive disjunction), kinésine nécessaire au maintien de certains chromosomes dans le fuseau de l’ovocyte de drosophile [29], participeraient à cet effet en évitant la dispersion des chromosomes dans le cytoplasme. Enfin, des chromo-moteurs favorisent la stabilisation des microtubules en maintenant leurs extrémités dans la zone d’action de l’effet de la chromatine. Dans l’extrait d’œufs ou dans des cellules de xénope, l’inhibition fonctionnelle de la chromo-kinésine Xklp1 conduit au détachement des hémifuseaux de la chromatine [2, 28]. Dans ces cellules, la densité de microtubules du fuseau est réduite, suggérant leur déstabilisation importante [28]. L’ancrage aux chromosomes par des chromo-moteurs tels que Xklp1 serait donc nécessaire pour maintenir ces microtubules dans le rayon d’action stabilisatrice de la chromatine. En conclusion, si le rôle direct des chromo-moteurs dans la stabilisation locale des microtubules reste à démontrer, il est clair qu’en favorisant leur ancrage aux bras des chromosomes, ils contribuent indirectement au maintien, voire à l’amplification, de l’effet de la chromatine. Inversement, les régulateurs de l’effet de la chromatine pourraient aussi contrôler des activités motrices nécessaires à la formation du fuseau. Dans les extraits d’œufs de xénope, Ran, par exemple, semble activer le moteur Eg5 [2] impliqué dans l’assemblage du fuseau [19]. |
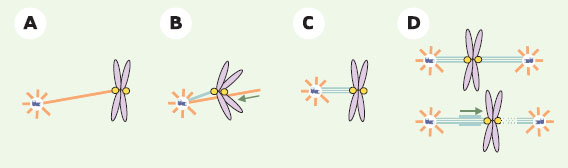
L’interface microtubule-kinétochore Un « effet kinétochore »: stabilisation globale et déstabilisation ponctuelle La fonction des kinétochores lors de la division cellulaire est d’assurer la ségrégation rigoureuse des chromosomes entre les deux cellules filles. Les kinétochores définissent une sous-population très particulière de microtubules du fuseau. Chez tous les eucaryotes supérieurs, les microtubules kinétochoriens sont ancrés par leur extrémité (+) dans la face externe du kinétochore et sont organisés en un faisceau dense appelé « fibre kinétochorienne ». Le nombre de microtubules qui composent la fibre kinétochorienne est variable selon les espèces [ 30]. Les microtubules kinétochoriens représentent une sous-population de microtubules du fuseau variable selon les systèmes cellulaires (25 % dans les cellules de mammifères, 100 % chez C. elegans dont les kinétochores, appelés holocentriques, recouvrent la totalité du chromosome). Ces microtubules sont caractérisés par une stabilité accrue: leur demi-vie est quatre fois supérieure à la demi-vie moyenne des microtubules du fuseau . La fibre kinétochorienne est une structure robuste, résistante en particulier à des manipulations mécaniques [ 31]. Ces fibres contribuent de façon significative à la stabilisation du fuseau de division. La perturbation de la fonction de la kinésine CENP-E, essentielle comme nous le verrons ultérieurement à la formation de ces fibres, peut induire la perte de cohésion générale du fuseau dont les pôles se désagrègent [ 32, 33]. Cette stabilité de la fibre kinétochorienne assure en outre l’association stable de chaque chromosome aux deux pôles du fuseau (bi-orientation), nécessaire pour leur ségrégation rigoureuse dans les cellules filles. Les kinétochores contribuent également aux mouvements des chromosomes qui conduisent à leur alignement sur la plaque métaphasique, puis à leur migration vers les pôles en anaphase. Ces mouvements dépendent en partie des forces que produit la dépolymérisation des microtubules de la fibre kinétochorienne [34]. Jusqu’en métaphase, des phases de dépolymérisation/polymérisation se succèdent sur chaque kinétochore. Le « raccourcissement » d’une fibre kinétochorienne est associé, pour les chromosomes bi-orientés, à la polymérisation de la fibre kinétochorienne opposée. Ce processus suppose la coordination rigoureuse du contrôle de la dynamique des microtubules par la paire de kinétochores [35]. En anaphase, la dépolymérisation des fibres kinétochoriennes devient continue et assure la migration des chromosomes jusqu’aux pôles du fuseau. Une exception notable est le cas des fuseaux assemblés dans les extraits d’œufs de xénope: en anaphase, la migration des chromosomes est en effet assurée uniquement par le flux des microtubules vers les pôles [36]. Ainsi, pendant toute la durée de la mitose, chaque kinétochore a un effet globalement stabilisant sur les microtubules kinétochoriens mais permet, parallèlement, la dépolymérisation ponctuelle de l’ensemble des microtubules qui constituent la fibre kinétochorienne. Moteurs et MAP impliqués dans la formation et la stabilisation de la fibre kinétochorienne La formation et le fonctionnement de la fibre kinétochorienne impliquent les activités de différents moteurs moléculaires et de MAP, associés durant la mitose aux kinétochores (Figure 4).  | Figure 4.
Moteurs et MAP impliqués dans la fonction du kinétochore. A. CLIP-170 (protéine du kinétochore, jaune) permet l’ancrage d’un premier microtubule au kinétochore. B. Le kinétochore est transporté par la dynéine près du pôle, dans une zone riche en extrémités (+) de microtubules. C. CENP-E (également dans le kinétochore) permet l’ancrage stable des extrémités (+) des microtubules dans le kinétochore. Une fibre kinétochorienne se forme. D. Chromosome bi-orienté en mouvement. XKCM1 (autre protéine du kinétochore) favorise la dépolymérisation d’une fibre kinétochorienne (pointillés bleu clair). CENP-E maintient la connexion entre le kinétochore et les microtubules en cours de dépolymérisation. Sur le kinétochore opposé, les microtubules entrent parallèlement en phase de polymérisation (surtraits bleu clair). Violet: chromatine; jaune: kinétochores; bleu foncé: centrosome; bleu clair: microtubules stables; orange: microtubules instables. |
Dès la rupture de l’enveloppe nucléaire, les microtubules des centrosomes interagissent de façon aléatoire avec les kinétochores grâce à un mécanisme dit de « recherche et capture » [37]. Ce mécanisme pourrait impliquer la MAP CLIP-170 (cytoplasmic linker protein). Initialement décrite comme nécessaire à l’ancrage de structures complexes aux microtubules; cette protéine est associée au kinétochore jusqu’à la mise en place de la fibre kinétochorienne [38]. Cette capture entraîne ensuite le transport du kinétochore vers le pôle du fuseau grâce à la dynéine [39]. En début de mitose, ce mouvement favorise l’ancrage de microtubules au kinétochore mais ne semble pas nécessaire à la formation de la fibre kinétochorienne [40]. Des expériences récentes démontrent que l’ancrage et le maintien des extrémités (+) des microtubules dans le kinétochore nécessitent l’action de la kinésine kinétochorienne CENP-E [32]. L’inhibition de CENP-E dans des cellules empêche la bi-orientation d’une partie des chromosomes. Ceux-ci sont immobilisés près des pôles du fuseau sans fibre kinétochorienne. Les chromosomes bi-orientés observés sont, quant à eux, pourvus de fibres dont la densité en microtubules est réduite en moyenne de 23 % [33]. Ces résultats confirment le rôle crucial de CENP-E, mais suggèrent également l’implication d’autres facteurs non encore identifiés dans la formation de la fibre kinétochorienne. Les mécanismes de stabilisation proprement dits de la fibre restent largement hypothétiques. La densité de microtubules dans la fibre pourrait permettre la concentration locale de MAP stabilisatrices. Par ailleurs, cette densité pourrait favoriser des interactions directes entre les dimères de tubuline appartenant à des microtubules adjacents, contribuant à la stabilité de la fibre. Ces hypothèses restent à confirmer. Moteurs impliqués dans la déstabilisation ponctuelle de la fibre kinétochorienne Les facteurs contrôlant la dépolymérisation ponctuelle de la fibre kinétochorienne sont peu connus. CENP-E, initialement décrite comme une kinésine nécessaire à l’alignement des chromosomes en métaphase [ 41], ne semble pas impliquée directement dans de tels mouvements. En effet, si in vitro, ce moteur est requis pour maintenir l’attachement des kinétochores aux extrémités (+) de microtubules en phase de dépolymérisation [ 42], l’inhibition de CENP-E ne perturbe pas la mobilité des chromosomes bi-orientés in vivo [ 41]. En revanche, la kinésine XKCM1 et son homologue chez les mammifères MCAK (mitotic centromere-associated kinesin) qui favorisent les événements de « catastrophes » et sont associées aux kinétochores en mitose, pourraient être impliqués dans la dépolymérisation ponctuelle de la fibre kinétochorienne [ 43, 44]. L’inhibition de MCAK dans des cellules inhibe complètement les mouvements des chromosomes en anaphase [ 45]. Le rôle de XKCM1/MCAK avant la métaphase reste à élucider. Cette protéine pourrait contrôler la dépolymérisation des microtubules kinétochoriens en synergie avec d’autres facteurs encore inconnus. Ainsi, à l’échelle du kinétochore, se déroule un jeu subtil de stabilisation globale et de déstabilisation locale et ponctuelle des microtubules du fuseau. Si la fibre kinétochorienne n’est pas strictement nécessaire à la formation d’un fuseau bipolaire, elle contribue néanmoins à sa stabilisation. Ce jeu de stabilisation globale et de déstabilisation ponctuelle est essentiel au contrôle de la ségrégation rigoureuse des chromosomes par les kinétochores. |
Durant la division cellulaire, la formation d’un fuseau bipolaire requiert l’assemblage de microtubules autour des chromosomes en dépit de l’effet globalement déstabilisant du cytoplasme. Un nombre croissant d’observations suggère que cette re-stabilisation locale des microtubules est contrôlée par les chromosomes eux-mêmes. D’une part, la chromatine favorise la stabilité des microtubules par l’envoi de signaux de stabilisation et la présence de sites d’ancrage des microtubules aux bras des chromosomes. D’autre part, les kinétochores, par le biais des fibres kinétochoriennes, participent à la stabilisation du fuseau bipolaire. Les contributions respectives de ces modes de stabilisation varient selon les systèmes cellulaires mais les principes impliqués semblent conservés. Ainsi, les chromosomes détiennent le secret de l’assemblage du fuseau de division. Le cytosquelette, en particulier les microtubules, sont une cible privilégiée dans le traitement des maladies associées à une prolifération cellulaire aberrante (→). Cependant, la plupart des facteurs régulateurs des microtubules sont nécessaires au fonctionnement normal de la cellule. Il conviendrait donc de caractériser les régulateurs du cytosquelette spécifiques de la division cellulaire, cibles plus adéquates pour un tel traitement. La connaissance moléculaire des effets stabilisateurs des chromosomes au sein du fuseau pourrait permettre d’identifier de telles cibles. (→) m/s 2002, n° 12, p. 1225
|
Note ajoutée aux épreuves Depuis l’écriture de cet article, un gradient de RanGTP a été visualisé autour de la chromatine (voir [46]). |
Nous remercions Eugenia Piddini, Isabelle Arnal, Régis Tournebize et Virginie Hachet pour leur relecture de ce manuscrit. R.E.C-S. tient à exprimer sa reconnaissance à Eric Karsenti, père de l’effet de la chromatine, pour son initiation à ce sujet. S.B. remercie la Ligue Nationale contre le Cancer et l’EMBO pour les financements dont il a bénéficié. R.E.C.-S. remercie également l’EMBO.
|
Footnotes |
1. Earnshaw WC, Bernat RL. Chromosomal passengers: toward an integrated view of mitosis. Chromosoma 1991; 100: 139–46. 2. Wittmann T, Hyman A, Desai A. The spindle: a dynamic assembly of microtubules and motors. Nat Cell Biol 2001. 3: E28–34. 3. Desai A, Mitchison TJ. Microtubule polymerization dynamics. Annu Rev Cell Dev Biol 1997; 13: 83–117. 4. Le Peuch C, Dorée M. Le temps du cycle cellulaire. Med Sci 2000; 16: 461–8. 5. Verde F, Labbé JC, Dorée M, Karsenti E. Regulation of microtubule dynamics by cdc2 protein kinase in cellfree extracts of Xenopus eggs. Nature 1990; 343: 233–8. 6. Vasquez RJ, Gard DL, Cassimeris L. Phosphorylation by CDK1 regulates XMAP215 function in vitro. Cell Motil Cytoskeleton 1999; 43: 310–21. 7. Karsenti E. Vers une description du mécanisme d’assemblage du fuseau mitotique à l’échelle moléculaire. Med Sci 1993; 9: 131–9. 8. Nicklas RB, Gordon GW. The total length of spindle microtubules depends on the number of chromosomes present. J Cell Biol 1985; 100: 1–7. 9. Zhang D, Nicklas RB. Chromosomes initiate spindle assembly upon experimental dissolution of the nuclear envelope in grasshopper spermatocytes. J Cell Biol 1995; 131: 1125–31. 10. Sawin KE, Mitchison TJ. Mitotic spindle assembly by two different pathways in vitro. J Cell Biol 1991; 112: 925–40. 11. Dogterom M, Felix MA, Guet CC, Leibler S. Influence of M-phase chromatin on the anisotropy of microtubule asters. J Cell Biol 1996; 133: 125–40. 12. Karsenti E, Newport J, Kirschner M. Respective roles of centrosomes and chromatin in the conversion of microtubule arrays from interphase to metaphase. J Cell Biol 1984; 99: 47s–54. 13. Heald R, Tournebize R, Blank T, et al. Self-organization of microtubules into bipolar spindles around artificial chromosomes in Xenopus egg extracts. Nature 1996; 382: 420–5. 14. Karsenti E. Mitotic spindle morphogenesis in animal cells. Semin Cell Biol 1991; 2: 251–60. 15. Khodjakov A, Cole RW, Oakley BR, Rieder CL. Centrosome-independent mitotic spindle formation in vertebrates. Curr Biol 2000; 10: 59–67. 16. Lawler S. Microtubule dynamics: if you need a shrink try stathmin/Op18. Curr Biol 1998; 8: R212–4. 17. Andersen SS, Ashford AJ, Tournebize R, et al. Mitotic chromatin regulates phosphorylation of Stathmin/Op18. Nature 1997; 389: 640–3. 18. Budde PP, Kumagi A, Dunphy WG, Heald R. Regulation of Op18 during spindle assembly in Xenopus egg extracts. J Cell Biol 2001; 153: 149–58. 19. Carazo-Salas RE. Ran ou le parfum de la chromatine. Med Sci 2001; 17: 1056–60. 20. Mattaj IW, Englmeier L. Nucleocytoplasmic transport: the soluble phase. Annu Rev Biochem 1998; 67: 265–306. 21. Dorseuil O. Petite protéine G Ran et contrôle de l’import-export nucléaire. Med Sci 1998; 14: 85–9. 22. Carazo-Salas RE, et al. Generation of GTP-bound Ran by RCC1 is required for chromatin-induced mitotic spindle formation. Nature 1999. 400: 178–81. 23. Carazo-Salas RE, Guarguaglini G, Gruss OJ, et al. Ran-GTP coordinates regulation of microtubule nucleation and dynamics during mitotic-spindle assembly. Nat Cell Biol 2001; 3: 228–34. 24. Guarguaglini G, Renzi L, D’Ottavio F, et al. Regulated Ran-binding protein 1 activity is required for organization and function of the mitotic spindle in mammalian cells in vivo. Cell Growth Differ 2000; 11: 455–65. 25. Fleig, U, Salus SS, Karig I, Sazer S. The fission yeast ran GTPase is required for microtubule integrity. J Cell Biol 2000; 151: 1101–11. 26. Endow SA. Microtubule motors in spindle and chromosome motility. Eur J Biochem 1999; 262: 12–8. 27. Antonio C, Ferby I, Wilhelm H, et al. Xkid, a chromokinesin required for chromosome alignment on the metaphase plate. Cell 2000; 102: 425–35. 28. Vernos I, Raats J, Hirano T, et al. Xklp1, a chromosomal Xenopus kinesin-like protein essential for spindle organization and chromosome positioning. Cell 1995; 81: 117–27. 29. Theurkauf WE, Hawley RS. Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. J Cell Biol 1992; 116: 1167–80. 30. Bloom K. The centromere frontier: kinetochore components, microtubulebased motility, and the CENvalue paradox. Cell 1993; 73: 621–4. 31. Nicklas RB, Kubai DF, Hays TS. Spindle microtubules and their mechanical associations after micromanipulation in anaphase. J Cell Biol 1982; 95: 91–104. 32. Yao X., Abrieu A, Zheng Y, et al. CENP-E forms a link between attachment of spindle microtubules to kinetochores and the mitotic checkpoint. Nat Cell Biol 2000; 2: 484–91. 33. McEwen BF, Chan GK, Zubrowski B, et al. CENP-E is essential for reliable bioriented spindle attachment, but chromosome alignment can be achieved via redundant mechanisms in mammalian cells. Mol Biol Cell 2001; 12: 2776–89. 34. Cassimeris L, Salmon ED. Kinetochore microtubules shorten by loss of subunits at the kinetochores of prometaphase chromosomes. J Cell Sci 1991; 98: 151–8. 35. Khodjakov A., Gabashvili IS, Rieder CL. « Dumb » versus « smart » kinetochore models for chromosome congression during mitosis in vertebrate somatic cells. Cell Motil Cytoskeleton 1999; 43: 179–85. 36. Desai A, Maddox PS, Mitchison TJ, et al. Anaphase A chromosome movement and poleward spindle microtubule flux occur At similar rates in Xenopus extract spindles. J Cell Biol 1998; 141: 703–13. 37. Kirschner M, Mitchison T. Beyond self-assembly: from microtubules to morphogenesis. Cell 1986; 45: 329–42. 38. Dujardin D, Wacker UI, Moreau A, et al. Evidence for a role of CLIP-170 in the establishment of metaphase chromosome alignment. J Cell Biol 1998; 141: 849–62. 39. Rieder CL, Alexander SP. Kinetochores are transported poleward along a single astral microtubule during chromosome attachment to the spindle in newt lung cells. J Cell Biol 1990; 110: 81–95. 40. Wojcik E, Basto R, Serr M, et al. Kinetochore dynein: its dynamics and role in the transport of the Rough deal checkpoint protein. Nat Cell Biol 2001; 3: 1001–7. 41. Schaar BT, Chan GK, Maddox R, et al. CENP-E function at kinetochores is essential for chromosome alignment. J Cell Biol 1997; 139: 1373–82. 42. Lombillo VA, Stewart RJ, Mc Intosh JR, et al. Antibodies to the kinesin motor domain and CENP-E inhibit microtubule depolymerization-dependent motion of chromosomes in vitro. J Cell Biol 1995; 128: 107–15. 43. Wordeman L, Mitchison TJ. Identification and partial characterization of mitotic centromere- associated kinesin, a kinesin-related protein that associates with centromeres during mitosis. J Cell Biol 1995; 128: 95–104. 44. Walczak CE, Mitchison TJ, Desai A. XKCM1: a Xenopus kinesin-related protein that regulates microtubule dynamics during mitotic spindle assembly. Cell 1996; 84: 37–47. 45. Maney T, Hunter AW, Wagenbach M, Wordeman L. Mitotic centromere associated kinesin is important for anaphase chromosome segregation. J Cell Biol 1998; 142: 787–801. 46. Kalab P, Weis K, Heald R. Vizualisation of a Ran-GTP gradient in interphase and mitotic Xenopus egg extracts. Science 2002; 295: 2452–6. |