| |
| Med Sci (Paris). 2002 December; 18(12): 1227–1235. Published online 2002 December 15. doi: 10.1051/medsci/200218121227.Dynamique du fuseau : vers une cible anti-cancéreuse Isabelle Arnal,1* Ingrid Sassoon,2** and Régis Tournebize3*** 1Équipe Structure et Dynamique du Cytosquelette, UMR 6026, Université de Rennes 1, Campus de Beaulieu, Bâtiment 13, 35042 Rennes Cedex, France 2Oncology Disease Group, Aventis Pharma, 13, quai Jules Guesde, 94403 Vitry-sur-Seine, France 3Pathogénie Microbienne Moléculaire, Institut Pasteur, 28, rue du Docteur Roux, 75015 Paris, France |
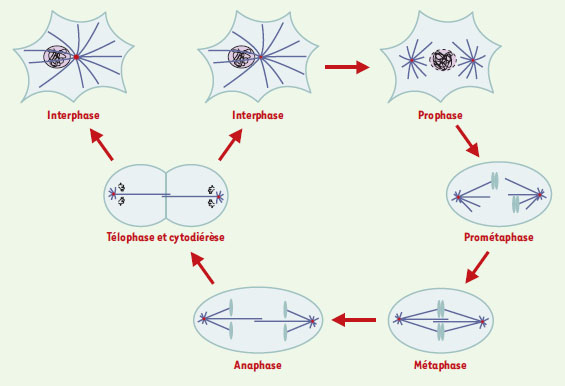
Les microtubules sont un élément majeur du cytosquelette des cellules eucaryotes, responsables du maintien de la forme de la cellule. Ils sont impliqués dans le trafic intracellulaire en formant de véritables « rails » le long desquels des protéines motrices se déplacent et transportent divers organites. Ils sont également essentiels à la division cellulaire au cours de laquelle ils forment une structure bipolaire, complexe et dynamique, nécessaire à la ségrégation correcte des chromosomes pendant la mitose: le fuseau mitotique. Ce dernier est constitué de deux réseaux symétriques et antiparallèles de microtubules dont l’une des extrémités interagit avec les chromosomes et l’autre est ancrée aux deux pôles. Après rupture de l’enveloppe nucléaire, les chromosomes sont « capturés » par les microtubules et oscillent entre les deux pôles, avant de se positionner sur la plaque équatoriale en métaphase. En anaphase, chaque copie des chromosomes dupliqués migre vers chacun des pôles, avant que l’enveloppe nucléaire ne se forme à nouveau et que débute la cytodiérèse (Figure 1). Dans cet article, nous nous sommes intéressés aux processus moléculaires régissant la réorganisation des microtubules interphasiques en fuseau mitotique. Cette réorganisation nécessite : (1) les propriétés dynamiques des microtubules et des protéines qui les contrôlent ; et (2) l’organisation spatiale des microtubules par des protéines motrices. Nous aborderons dans une dernière partie les thérapies anticancéreuses ayant pour cible le fuseau mitotique via les microtubules ou leurs protéines associées. 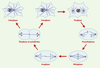 | Figure 1. Représentation schématique des différentes étapes du cycle cellulaire dans une cellule somatique. En interphase, les microtubules (représentés en bleu) rayonnent dans toute la cellule à partir du centrosome (en rouge). La chromatine décondensée est dans le noyau. En prophase, les microtubules sont réorganisés et nucléés à partir des deux centrosomes dupliqués au cours de la phase S de l’interphase. La chromatine commence à se condenser à l’intérieur du noyau. Au cours de la prométaphase, l’enveloppe nucléaire est rompue et les chromosomes sont dispersés dans le cytoplasme. Ils interagissent avec l’extrémité « plus » des microtubules et, en métaphase, le fuseau bipolaire résultant est stable, avec les chromosomes alignés sur la plaque équatoriale. En anaphase, chaque copie des chromosomes dupliqués migre vers l’un des pôles de la cellule avant la décondensation des chromosomes et la reformation de l’enveloppe nucléaire en télophase, suivi de la cytodiérèse. |
L’assemblage du fuseau implique de nombreuses molécules dont la nomenclature varie d’une espèce à l’autre. En règle générale, nous avons utilisé les noms de facteurs présents chez le xénope. En effet, les extraits d’œufs de ces batraciens représentent un modèle de choix pour l’étude de la dynamique des microtubules et l’assemblage du fuseau mitotique au cours du cycle cellulaire et ont apporté un grand nombre d’informations à la compréhension de ces mécanismes. Pour simplifier, nous avons donc choisi de décrire essentiellement les résultats obtenus dans ce système. |
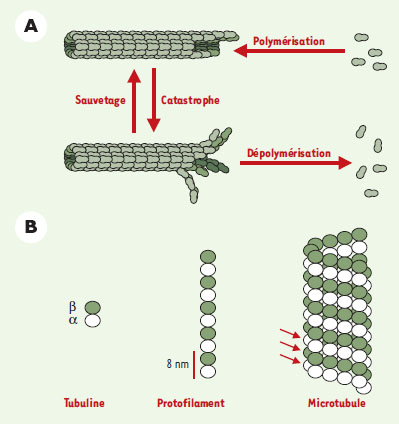
Dynamique des microtubules et formation du fuseau mitotique L’instabilité dynamique Les microtubules sont, avec les chromosomes, les constituants de base du fuseau mitotique. Ce sont des polymères dynamiques de tubuline qui oscillent constamment entre des cycles de polymérisation et de dépolymérisation (Figure 2A) [ 1]. La transition entre polymérisation et dépolymérisation est appelée « catastrophe », la transition inverse est le « sauvetage ». Cette propriété de polymérisation hors équilibre, baptisée instabilité dynamique (Figure 2A) [ 2, 3], est décrite par quatre paramètres: les vitesses de croissance et de décroissance et les fréquences de catastrophe et de sauvetage. Ce processus permet de moduler l’organisation spatiale des microtubules dans la cellule, par exemple lors de la croissance cellulaire, de la polarisation de la cellule ou encore de la formation du fuseau mitotique.  | Figure 2. Dynamique des microtubules. Les microtubules sont des polymères dynamiques qui oscillent entre des cycles de polymérisation et de dépolymérisation, par ajout et perte de tubuline à leurs extrémités. A. La transition de polymérisation à dépolymérisation est appelée une « catastrophe », la transition inverse est un « sauvetage ». Ce processus, connu sous le nom d’instabilité dynamique, est une propriété intrinsèque des microtubules et est caractérisé par quatre paramètres: la vitesse de polymérisation, la vitesse de dépolymérisation, la fréquence de catastrophe et la fréquence de sauvetage. L’énergie nécessaire à l’instabilité dynamique provient de l’hydrolyse du GTP sur la tubuline au cours de l’assemblage en microtubule. Cette hydrolyse n’est pas essentielle pour la polymérisation; elle est en revanche nécessaire pour déstabiliser la paroi du microtubule et permettre par la suite sa dépolymérisation qui libère alors des dimères de tubuline-GDP. B. Les différents niveaux d’organisation d’un microtubule. Les microtubules sont formés de tubuline, un dimère de deux sous-unités α et β. Ces dimères de tubuline sont organisés, dans la paroi d’un microtubule, en protofilaments. Le modèle classique d’un microtubule comporte 13 protofilaments parallèles à l’axe du tube. Chaque protofilament est décalé par rapport à son voisin de telle sorte que l’enchaînement latéral des sous-unités de tubuline décrit des hélices autour de la paroi du microtubule (indiquées par les flèches rouges). |
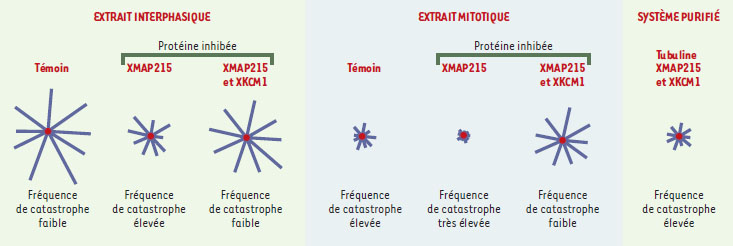
D’un point de vue structural, les microtubules sont des cylindres creux d’environ 25 nm de diamètre et plusieurs micromètres de long, résultant de l’assemblage d’hétérodimères de tubuline, constitués de deux sous-unités α et β (Figure 2B). Ces hétérodimères sont arrangés en protofilaments parallèles, tous orientés dans la même direction, conférant au microtubule sa polarité. Ainsi, dans les cellules animales, les extrémités « moins », peu dynamiques, sont ancrées au niveau d’un centre nucléateur et organisateur des microtubules, le centrosome, tandis que les extrémités « plus » participent très activement à la dynamique spatiale de polymérisation/ dépolymérisation. De nombreuses études ont essayé de comprendre le mécanisme de l’instabilité dynamique. Au cours de la polymérisation de la tubuline en microtubule, l’une des deux molécules de GTP associée au dimère de tubuline est hydrolysée [4]. L’énergie provenant de cette hydrolyse n’est pas nécessaire à la polymérisation de la tubuline mais à la capacité des microtubules de se dépolymériser [5]. L’un des modèles actuels pour expliquer l’instabilité dynamique est celui de la coiffe de GTP, fondé sur deux états conformationels de la tubuline: (1) un état GDP instable constituant l’essentiel de la paroi du microtubule ; (2) un état GTP stable coiffant l’extrémité du microtubule et permettant la polymérisation par ajout de nouvelles sous-unités de tubuline [1]. C’est la perte aléatoire de cette coiffe GTP qui entraînerait les catastrophes. Plus récemment, des résultats obtenus par microscopie électronique ont montré que la régulation de la dynamique des microtubules implique des changements structuraux à leurs extrémités [5]. Ces résultats ont conduit à un modèle expliquant l’instabilité dynamique grâce aux propriétés élastiques des microtubules. MAP et facteurs de catastrophe L’étude de la dynamique des microtubules dans les cellules a montré que celle-ci était différente de celle qui est observée in vitro, pour une concentration de tubuline équivalente [ 1]. In vitro, des microtubules assemblés à partir de tubuline purifiée ont des vitesses de polymérisation peu élevées et de faibles fréquences de catastrophe qui dépendent de la concentration en tubuline. In vivo, le taux de croissance des microtubules est 5 à 10 fois supérieur, cette forte vitesse de polymérisation s’accompagnant d’une fréquence de catastrophe élevée. Par ailleurs, la stabilité des microtubules diffère selon que la cellule est en interphase ou en mitose. En interphase, les microtubules ont une demi-vie d’environ 15 minutes, alors qu’en mitose, cette demi-vie diminue pour atteindre 30-90 secondes [ 1]. Cette instabilité des microtubules en mitose provient essentiellement d’une augmentation de 5 à 10 fois de la fréquence de catastrophe, ce qui est suffisant pour passer d’un réseau de microtubules longs et stables à un réseau de microtubules courts et dynamiques [ 6, 7]. Ces observations suggèrent l’existence de facteurs qui contrôlent, dans l’espace et le temps, la dynamique des microtubules in vivo. Ces effecteurs permettant des variations de stabilité très rapides sont les MAP ( microtubules associated proteins) et les facteurs de catastrophes. Les MAP sont des protéines qui se lient aux microtubules et modulent leurs propriétés dynamiques en les stabilisant et/ou en stimulant leur vitesse de polymérisation [ 1]. Nous nous focaliserons ici sur celles qui sont impliquées dans la division cellulaire. XMAP215, identifiée chez le xénope, et son homologue humain TOGp augmentent jusqu’à 10 fois la vitesse de polymérisation de microtubules assemblés à partir de tubuline pure [ 8]. Ces deux protéines, qui appartiennent à la famille Dis1, sont essentielles pour la division cellulaire chez tous les eucaryotes où elles ont été identifiées (levures, plantes et animaux [ 8]). XMAP230 et XMAP310, deux autres MAP du xénope impliquées dans l’assemblage du fuseau mitotique, agissent différemment: elles stabilisent en effet les microtubules, la première en diminuant la fréquence de catastrophe et la seconde en augmentant la fréquence de sauvetage de la tubuline pure [ 9]. Récemment, une nouvelle classe de protéines se liant spécifiquement à l’extrémité « plus » des microtubules a été découverte [ 10]: ainsi, CLIP170 et EB1, identifiées chez l’homme, sont impliquées dans l’ancrage des kinétochores (complexe protéique assemblé autour du centromère de chaque chromatide des chromosomes et assurant leur fidélité de transmission) aux extrémités « plus » des microtubules. S’opposant à l’activité stabilisatrice des MAP, les facteurs de catastrophe déstabilisent les microtubules et permettent ainsi les modulations rapides de dynamique au cours du cycle cellulaire. La recherche de tels facteurs a permis d’identifier la stathmine, également appelée Op18, une petite protéine initialement découverte dans certaines lignées de cellules tumorales [11, 12]. Le mécanisme par lequel la stathmine dépolymérise les microtubules est aujourd’hui controversé [13]: séquestration des dimères de tubuline libres (et donc diminution de la quantité de tubuline compétente pour la polymérisation) et/ou déstabilisation directe par interaction à l’extrémité des microtubules. L’activité de la stathmine sur les microtubules est contrôlée négativement par de nombreuses kinases [13]. En mitose, son hyperphosphorylation est nécessaire à la progression normale du cycle cellulaire. Signalons cependant que des souris ne possédant pas le gène de la stathmine se développent normalement, suggérant que cette protéine n’est pas essentielle au cours de la division cellulaire de certains organismes modèles [14]. Une deuxième classe de protéines déstabilisant les microtubules fait partie de la famille des kinésines. XKCM1, une kinésine identifiée chez le xénope, est capable de se fixer directement aux extrémités des microtubules et de les dépolymériser [15]. Cette protéine et son homologue mammifère MCAK [16] sont localisés sur les kinétochores en mitose et pourraient jouer un rôle dans le mouvement des chromosomes. Plus récemment, des protéines qui déstabilisent les microtubules en les coupant ont été mises en évidence mais leur rôle dans la cellule n’est pas encore clair [17]. Régulation de la dynamique des microtubules La transition interphase/mitose se caractérise par une augmentation importante de la fréquence de catastrophe. Des expériences réalisées dans les extraits d’œufs de xénope ont montré que XKCM1 est responsable d’environ 80 % de cette augmentation alors que la stathmine assure 20 % de ces changements [ 18, 19]. Observation intéressante, XMAP215 s’oppose à l’activité déstabilisatrice de XKCM1 et module ainsi la fréquence de catastrophe. Les résultats obtenus ont permis de proposer le modèle de régulation suivant. En interphase, XMAP215 et XKCM1 sont tous deux actifs, mais l’effet stabilisateur de XMAP215 dominant l’effet déstabilisateur de XKCM1, les microtubules sont longs. En mitose, la phosphorylation de XMAP215 provoque une diminution de son activité stabilisatrice tandis que l’activité déstabilisatrice de XKCM1 reste stable : les microtubules deviennent plus instables et très dynamiques, donc plus courts. Cette activité antagoniste de XMAP215 et XKCM1 vient d’être mise en évidence in vitro avec des composants purifiés et a permis de reconstituer des microtubules dynamiques comme dans les extraits (Figure 3), [ 20]. De plus, une activité antagoniste similaire a été observée chez la levure Saccharomyces cerevisiae entre Stu2, homologue de XMAP215, et Kip3 qui appartient à la famille de XKCM1 [ 21]. La conservation de ces facteurs au cours de l’évolution suggère qu’ils jouent un rôle majeur dans la régulation de la dynamique des microtubules.  | Figure 3. L’activité antagoniste de XMAP215 et XKCM1 module la dynamique des microtubules au cours du cycle cellulaire. Les microtubules sont nucléés à partir de centrosomes dans des extraits d’œufs de xénope mitotiques ou interphasiques en présence ou non de XMAP215 et/ou XKCM1. En interphase et en mitose, l’inhibition de XMAP215 provoque une augmentation de la fréquence des catastrophes. Cet effet est contrebalancé par une inhibition simultanée de XMAP215 et XKCM1. Cela montre que : (1) XKCM1 est active en interphase et en mitose ; et (2) XMAP215 s’oppose à l’activité déstabilisatrice de XKCM1. Cette activité antagoniste de XMAP215 et XKCM1 a été confirmée in vitro avec de la tubuline pure et il est possible de reconstituer à partir de composants purifiés, des microtubules ayant les mêmes propriétés dynamiques que celles observées dans un extrait. |
Ce contrôle est essentiel à l’assemblage correct du fuseau mitotique mais également au maintien de sa taille [9]. L’immunodéplétion de XMAP215 dans des extraits d’œufs de xénope, ou l’inactivation de son homologue chez la drosophile et le nématode, empêche la formation du fuseau et/ou provoque la formation de très petits fuseaux. L’inhibition de XMAP230 dans des ovocytes de xénope réduit la largeur des fuseaux et la densité des microtubules. De petits fuseaux sont également observés en présence de quantités croissantes de stathmine dans les extraits d’œufs de xénope, effet probablement dû à une augmentation de la dynamique des microtubules. Outre ces variations rapides de la dynamique des microtubules, le couplage d’une dépolymérisation nette à l’extrémité « moins » et d’une polymérisation nette à l’extrémité « plus » des microtubules du fuseau mitotique crée un flux de tubuline, appelé « tapis roulant » ou treadmilling [22]. Ce phénomène semble être impliqué dans la séparation des chromosomes en anaphase. |
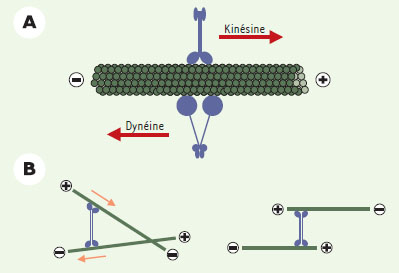
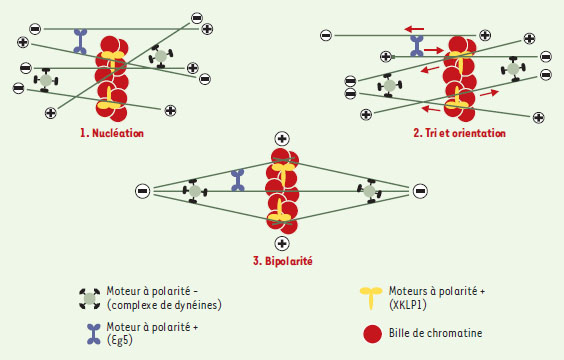
Organisation spatiale des microtubules et formation du fuseau mitotique Si MAP et facteurs de catastrophe jouent un rôle clé dans les propriétés dynamiques des microtubules, l’assemblage tridimensionnel du fuseau ne pourrait avoir lieu sans l’existence de moteurs moléculaires ou protéines motrices (Figures 4 et 5). Ces protéines sont à l’origine de la formation d’une structure bipolaire focalisée aux pôles et sont responsables du maintien de cette bipolarité. Elles facilitent en outre le déplacement et le positionnement des chromosomes sur cette structure stable. 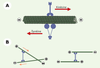 | Figure 4. Protéines motrices et dynamique des microtubules. A. Représentation schématique des protéines motrices. La plupart des kinésines et les dynéines se déplacent respectivement vers les extrémités « plus » + et « moins » - des microtubules. Elles interagissent avec différents types d’organites et participent ainsi au trafic intracellulaire et à la division cellulaire. B. La protéine motrice Eg5 est un homotétramère avec deux paires de domaines moteurs à chacune de ses extrémités. Ainsi, elle peut interagir avec deux microtubules à la fois. En se déplaçant vers les extrémités + , elle trie les microtubules en fonction de leur polarité et les oriente en faisceau antiparallèle (les flèches oranges indiquent la direction du mouvement des microtubules). Eg5 joue un rôle important lors de la formation du fuseau mitotique (voir texte). |
 | Figure 5.Rôle des protéines motrices dans la formation du fuseau mitotique. Des complexes multiprotéiques de dynéine pontent plusieurs microtubules nucléés par les billes de chromatine et, en se déplaçant vers les extrémités - , forment les deux pôles du fuseau qui seront ensuite stabilisés par d’autres protéines. XKLP1 (moteur à polarité +) est localisé sur les chromosomes et permet ainsi d’orienter les extrémités + des microtubules vers l’ADN. Le tétramère Eg5 ponte deux microtubules et, en se déplaçant vers les extrémités + , les oriente de façon anti-parallèle. Les flèches indiquent la direction du mouvement des microtubules (adapté de [ 28]). |
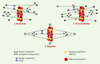
Kinésines et dynéines Les protéines motrices associées aux microtubules utilisent l’énergie de l’hydrolyse de l’ATP pour se déplacer le long de ces polymères [ 23]. Deux types de protéines motrices interviennent dans la formation du fuseau mitotique (Figure 4A) [ 24]: (1) les kinésines, qui se déplacent en grande majorité vers l’extrémité « plus » des microtubules (moteur à polarité « plus »), bien qu’un petit nombre se déplacent vers l’extrémité « moins » (moteur à polarité « moins ») ; et (2) les dynéines qui se déplacent vers l’extrémité « moins ». Des expériences génétiques réalisées chez la levure S. cerevisiae ont montré l’importance de différentes protéines motrices dans l’assemblage du fuseau, notamment les kinésines de la famille BimC (moteurs à polarité « plus ») et la dynéine cytoplasmique [ 25, 26]. Puis, des études utilisant les extraits d’œufs de xénope ont permis de mettre en évidence et d’étudier le rôle de différents moteurs dans la formation du fuseau, comme les kinésines à polarité « plus » XKLP1, XKLP2 et Eg5 (de la famille BimC), la kinésine à polarité « moins » XTCK2 et la dynéine [ 27]. Les kinésines ont en commun un domaine moteur conservé responsable de leur liaison au microtubule et de l’hydrolyse de l’ATP [23]. Cependant, elles sont très variables par la position de ce domaine moteur et par leur structure quaternaire qui peut aller du monomère au tétramère [24]. Parmi les kinésines intervenant dans l’assemblage du fuseau mitotique, certaines interagissent avec le centrosome (XKLP2) ou les chromosomes (XKLP1). D’autres, comme les protéines de la famille BimC dont Eg5, sont des tétramères avec deux paires de domaines moteurs à chaque extrémité. Ces protéines possèdent la propriété fondamentale de ponter deux microtubules et de les orienter l’un par rapport à l’autre en rapprochant les extrémités « plus » des microtubules (Figure 4B) [27]. La dynéine cytoplasmique est formée de deux chaînes lourdes qui contiennent chacune un domaine moteur et qui sont liées à un nombre variable de polypeptides. Au cours de la mitose, la dynéine intervient notamment dans la formation des deux pôles du fuseau, une fonction qui nécessite son interaction avec d’autres protéines comme le complexe de dynactines [26]. Rôle des protéines motrices dans la formation du fuseau De nombreuses informations sur les mécanismes de base de l’assemblage d’un fuseau mitotique bipolaire ont été obtenues en reconstituant ces processus autour de chromosomes artificiels (billes recouvertes de chromatine) dans des extraits d’œufs de xénope [ 28]. L’utilisation de ce système a montré que des déterminants de polarité comme les centrosomes et les kinétochores ne sont pas nécessaires à la formation d’un fuseau bipolaire. En revanche, des moteurs à polarité « plus » localisés sur les chromosomes et des complexes multimériques solubles de moteurs à polarité « moins » se sont, eux, révélés indispensables [ 27, 28]. Les billes de chromatine agissant comme des chromosomes artificiels et vont dans un premier temps nucléer des microtubules d’orientation aléatoire (Figure 5) ( voir l’article de R. Carazo-Salas et S. Brunet, p. 1217 de ce numéro, pour une compréhension moléculaire de ces mécanismes). Ces microtubules sont ensuite triés en fonction de leur polarité. La kinésine XKLP1 à polarité « plus », localisée sur les chromosomes, trie les microtubules en ramenant leur extrémité « plus » vers l’ADN [ 27], repoussant au loin les extrémités « moins ». De façon concomitante, les pôles du fuseau vont se former. Un complexe protéique constitué de dynéine, de dynactine et de la MAP NuMA relie entre eux plusieurs microtubules et, en se déplaçant vers les extrémités « moins » grâce à la dynéine, focalise ces extrémités aux pôles. Ces derniers sont ensuite stabilisés par NuMA qui a la propriété de ponter les microtubules [ 29]. TPX2, une MAP découverte récemment, est également impliquée dans la stabilisation des pôles [30]. La kinésine XCTK2 à polarité « moins » participe à la même fonction que la dynéine [27]. Parallèlement, Eg5, en pontant deux microtubules et en se déplaçant vers l’extrémité « plus » permet d’orienter les extrémités « moins » aux pôles [27]. Certaines des protéines motrices déjà citées (dynéine, XKCM1) ainsi que deux autres kinésines à polarité « plus » (CENP-E, Xkid) sont également impliquées dans le mouvement des chromosomes sur le fuseau mitotique [22] (→). C’est donc l’action combinée de diverses protéines motrices capables de lire la polarité des microtubules qui permet de trier ces derniers, plaçant leur extrémité « plus » au niveau des chromosomes et leur extrémité « moins » localisée aux pôles. (→) m/s 2001, n°10, p. 1056 Dans les cellules végétales et dans la plupart des cellules méiotiques, le fuseau bipolaire est assemblé en l’absence de centrosomes. Dans les cellules animales somatiques, les microtubules sont nucléés à partir du centrosome qui est dupliqué une fois par cycle cellulaire. En début de mitose, les deux centrosomes sont proches l’un de l’autre près de la membrane nucléaire. La formation d’un fuseau bipolaire dans ces cellules nécessite donc leur séparation afin qu’ils forment les deux pôles. Différents types de moteurs sont impliqués dans cette séparation qui a lieu en début de mitose alors que les microtubules deviennent courts et dynamiques. La dynéine est nécessaire au mouvement des centrosomes autour de la membrane nucléaire en début de prophase et permet, ensuite, de maintenir la connexion entre les centrosomes et les microtubules aux deux pôles du fuseau [31]. La kinésine XKLP2, localisée sur les centrosomes, se lierait aux microtubules provenant du pôle opposé et, par son mouvement vers l’extrémité « plus » des microtubules en phase de polymérisation, repousserait les deux centrosomes loin l’un de l’autre [32]. Après séparation des centrosomes et rupture de l’enveloppe nucléaire, la croissance des microtubules a lieu préférentiellement vers les chromosomes où ils seraient stabilisés [33]. La bipolarité du fuseau serait ensuite maintenue par les différents types de protéines motrices déjà citées. Dans les cellules somatiques, les centrosomes ont une activité de nucléation des microtubules dominante par rapport à celle des chromosomes, et dictent la bipolarité du fuseau mitotique. |
Le fuseau mitotique et son utilisation en tant que cible anti-cancéreuse Le fuseau mitotique a depuis longtemps été identifié comme une cible majeure de la chimiothérapie anticancéreuse [34]. Le succès clinique et commercial des poisons de la tubuline comme le Taxol® /Taxotère® a incité les chercheurs à développer de nouvelles générations de drogues plus efficaces et moins toxiques. De plus, la compréhension grandissante du fonctionnement du fuseau mitotique et des mécanismes de contrôle permet d’explorer des approches alternatives prometteuses ciblées sur les cellules en prolifération. Les vinca-alcaloïdes, incluant la vinblastine et la vincristine, sont les premières drogues antimitotiques identifiées provoquant une malformation du fuseau mitotique [34]. Elles ont pour cible la sous-unité β de la tubuline et dépolymérisent les microtubules. La vinblastine et la vincristine sont couramment utilisées dans le traitement de certains cancers (cancer des testicules, maladie de Hodgkin, leucémie lymphocytaire aiguë). Puis, la découverte des taxanes (paclitaxel et docétaxel) et de leur impressionnante efficacité anti-tumorale a relancé l’intérêt des poisons de la tubuline [34, 35]. Les taxanes se distinguent des autres drogues antimitotiques par un mécanisme d’action bien particulier: ils stimulent en effet la polymérisation de la tubuline et empêchent la dépolymérisation des microtubules. L’effet du paclitaxel (Taxol®) sur la dynamique des microtubules a été très étudié dans les cellules vivantes comme dans les systèmes isolés. À faible concentration, le Taxol® (ainsi que les vinca-alcaloïdes) supprime la dynamique des microtubules qui deviennent stables. Dans les cellules, cet effet empêche la formation correcte du fuseau mitotique, provoquant l’apoptose [36]. Néanmoins, malgré le succès des taxanes dans le traitement de nombreux cancers (sein, ovaires et poumons), ils sont, de la même manière que les autres poisons de la tubuline, extrêmement toxiques car ils agissent aussi sur les cellules non cancéreuses en prolifération comme les cellules hématopoïétiques et muqueuses. Par ailleurs, les neurones périphériques, les cellules de Schwann et les axones du nerf sciatique peuvent également être affectés par ces drogues si elles traversent la barrière hémato-encéphalique. Dans un certain nombre de cas, es tumeurs sont (ou deviennent) résistantes aux agents utilisés, limitant leur efficacité à long terme. Les mécanismes de résistance sont variés mais n’ont pas toujours été prouvés in vivo: expression du gène de résistance aux drogues mdr1 (codant pour la glycoprotéine transmembranaire P-gp qui exporte les drogues hors de la cellule), effets compensatoires dans la structure et/ou l’expression de la tubuline, modification de l’expression des MAP rétablissant une dynamique appropriée des microtubules. Les nouvelles générations de taxanes et dérivés des vinca-alcaloïdes ont pour but de pallier certains de ces effets: élimination des résistances, distribution ciblée, combinaison avec des anticorps anti-tumoraux. Par ailleurs, des molécules prometteuses d’origine naturelle (incluant l’épothilone, l’éleuthérobine et la discodermolide) ont été découvertes récemment [35]. Comme le Taxol® , ces molécules stimulent la polymérisation de la tubuline et stabilisent les microtubules. Elles présentent de plus l’intérêt de ne pas être des substrast de la pompe P-gp. D’autres molécules agissant sur la tubuline (colchicine, combretastine) ont la particularité de détruire la vascularisation des tumeurs et de provoquer leur nécrose, ouvrant ainsi le champ à une utilisation anti-vasculaire de ces drogues en clinique. Ces dernières années, une meilleure connaissance des composants du fuseau mitotique a largement favorisé l’émergence d’approches ciblées sur d’autres composants que les microtubules, l’objectif étant de discriminer les cellules mitotiques des cellules en interphase. Les moteurs de la famille des kinésines possèdent, en théorie, des atouts non négligeables pour leur utilisation en tant que cibles pharmacologiques. De nombreux travaux ont permis de mieux comprendre les bases structurales et biochimiques de la motilité des kinésines [37], ouvrant la voie au développement d’inhibiteurs compétitifs ou allostériques bloquant les interactions des kinésines avec les microtubules ou les nucléotides. Jusqu’à présent, deux inhibiteurs spécifiques de kinésines ont été identifiés et ont même permis de mieux comprendre leur rôle dans la cellule. Le premier est l’adociasulfate 2 (AS-2) qui inhibe de façon compétitive l’interaction du domaine moteur avec les microtubules mais ne semble pas spécifique de l’une des trois kinésines testées [37]. Le second est le monastrol, inhibiteur spécifique de la kinésine Eg5, qui provoque la formation de fuseaux monopolaires et l’arrêt mitotique des cellules traitées [38]. Cette inhibition a été confirmée dans des extraits mitotiques d’œufs de xénope où le monastrol empêche l’assemblage correct du fuseau bipolaire [39]. |
Le fuseau mitotique résulte d’un assemblage complexe de microtubules qui met en jeu essentiellement deux aspects: leurs propriétés dynamiques, contrôlées par l’activité antagoniste de MAP et de facteurs de catastrophe et leur organisation spatiale, orchestrée par un ensemble de protéines motrices. Bien que des progrès énormes aient été réalisés ces dernières années pour identifier les différents acteurs de ce processus, la connaissance des mécanismes moléculaires impliqués reste encore incomplète. La reconstitution in vitro du fuseau mitotique à partir de composants purifiés représente une étape importante dans la compréhension de ces mécanismes et facilitera la mise au point de nouvelles drogues antimitotiques spécifiques. |
Nous remercions vivement Cécile Combeau, Denis Chrétien et Jérome Viala pour leurs commentaires et leurs suggestions sur ce manuscrit. I. Arnal et R. Tournebize ont été financés par la Fondation pour la Recherche Médicale.
|
1. Desai A, Mitchison TJ. Microtubule polymerization dynamics. Annu Rev Cell Dev Biol 1997; 13: 83–117. 2. Mitchison T, Kirschner M. Dynamic instability of microtubule growth. Nature 1984; 312: 237–42. 3. Carlier MF. Role of nucleotide hydrolysis in the dynamics of actin filaments and microtubules. Int Rev Cytol 1989; 115: 139–70. 4. Hyman AA, Salser S, Drechsel DN, Unwin N, Mitchison TJ. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue, GMPCPP. Mol Biol Cell 1992; 3: 1155–67. 5. Chrétien D, Jànosi, I, Taveau, JC, Flyvberg, H. Microtubule’s conformational cap. Cell Struct Funct 1999; 24: 299–303. 6. Belmont LD, Hyman AA, Sawin KE, Mitchison TJ. Realtime visualization of cell cycle-dependent changes in microtubule dynamics in cytoplasmic extracts. Cell 1990; 62: 579–89. 7. Verde F, Dogterom M, Stelzer E, Karsenti E, Leibler S. Control of microtubule dynamics and length by cyclin A- and cyclin B-dependent kinases in Xenopus egg extracts. J Cell Biol 1992; 118: 1097–108. 8. Ohkura H, Garcia MA, Toda T. Dis1/TOG universal microtubule adaptors : one MAP for all? J Cell Sci 2001; 114: 3805–12. 9. Andersen SS. Spindle assembly and the art of regulating microtubule dynamics by MAP and Stathmin/Op18. Trends Cell Biol 2000; 10: 261–7. 10. Schuyler SC, Pellman D. Microtubule « plus-endtracking proteins »: the end is just the beginning. Cell 2001; 105: 421–4. 11. Sobel A. Stathmin: a relay phosphoprotein for multiple signal transduction? Trends Biochem Sci 1991; 16: 301–5. 12. Belmont LD, Mitchison TJ. Identification of a protein that interacts with tubulin dimers and increases the catastrophe rate of microtubules. Cell 1996; 84: 623–31. 13. Cassimeris L. The oncoprotein 18/stathmin family of microtubule destabilizers. Curr Opin Cell Biol 2002; 14 : 18–24. 14. Schubart UK, Yu J, Amat JA, Wang Z, Hoffmann MK, Edelmann W. Normal development of mice lacking metablastin (P19), a phosphoprotein implicated in cell cycle regulation. J Biol Chem 1996; 14: 14062–6. 15. Desai A, Verma S, Mitchison TJ, Walczak CE. Kin I kinesins are microtubule-destabilizing enzymes. Cell 1999 : 96: 69–78. 16. Wordeman L, Mitchison TJ. Identification and partial characterization of mitotic centromere-associated kinesin, a kinesin-related protein that associates with centromeres during mitosis. J Cell Biol 1995; 128: 95–104. 17. Quarmby LM, Lohret TA. Microtubule severing. Cell Motil Cytosk 1999; 43: 1–9. 18. Tournebize R, Andersen SS, Verde F, Doree M, Karsenti E, Hyman AA. Distinct roles of PP1 and PP2A-like phosphatases in control of microtubule dynamics during mitosis. EMBO J 1997; 16: 5537–49. 19. Tournebize R, Popov A, Kinoshita K, et al. Control of microtubule dynamics by the antagonistic activities of XMAP215 and XKCM1 in Xenopus egg extracts. Nat Cell Biol 2000; 2 : 13–9. 20. Kinoshita K, Arnal I, Desai A, Drechsel DN, Hyman AA. Reconstitution of physiological microtubule dynamics using purified components. Science 2001; 294: 1340–3. 21. Severin F, Habermann B, Huffaker T, Hyman T. Stu2 promotes mitotic spindle elongation in anaphase. J Cell Biol 2001; 153: 435–42. 22. Wittmann T, Hyman AA, Desai A. The spindle: a dynamic assembly of microtubules and motors. Nat Cell Biol 2001; 3: E28–34. 23. Sablin HP. Kinesins and microtubules: their structures and motor mechanisms. Curr Opin Cell Biol 2000; 12 : 35–41. 24. Hirokawa N, Noda Y, Okada Y. Kinesin and dynein superfamily proteins in organelle transport and cell division. Curr Opin Cell Biol 1998; 10: 60–73. 25. Heald R, Walczak CE. Microtubule-based motor function in mitosis. Curr Opin Struct Biol 1999; 9: 268–74. 26. Karki S, Holzbaur ELG. Cytoplasmic dynein and dynactin in cell division and intracellular transport. Curr Opin Cell Biol 1999; 11 : 45–53. 27. Walczak CE, Vernos I, Mitchison TJ, Karsenti E, Heald R. A model for the proposed roles of different microtubule-based motor proteins in establishing spindle bipolarity. Curr Biol 1998; 8: 903–13. 28. Heald R, Tournebize R, Blank T, et al. Self-organization of microtubules into bipolar spindles around artificial chromosomes in Xenopus egg extracts. Nature 1996; 382: 420–5. 29. Merdes A, Heald R, Samejima K, Earnshaw WC, Cleveland DW. Formation of spindle poles by dynein/dynactin-dependent transport of NuMA. J Cell Biol 2000; 149: 851–62. 30. Wittmann T, Wilm M, Karsenti E, Vernos I. TPX2, a novel xenopus MAP involved in spindle pole organization. J Cell Biol 2000; 149: 1405–18. 31. Robinson JT, Wojcik EJ, Sanders MA, McGrail M, Hays TS. Cytoplasmic dynein is required for the nuclear attachment and migration of centrosomes during mitosis in Drosophila. J Cell Biol 1999; 146: 597–608. 32. Boleti H, Karsenti E, Vernos I. Xklp2, a novel Xenopus centrosomal kinesin-like protein required for centrosome separation during mitosis. Cell 1996; 84: 49–59. 33. Hyman AA, Karsenti E. Morphogenetic properties of microtubules and mitotic spindle assembly. Cell 1996; 84: 401–10. 34. Wood, KW, Cornwell WD, Jackson JR. Past and future of the mitotic spindle as an oncology target. Curr Opin Pharmacol 2001; 1: 370–7. 35. He L, Orr GA, Horwitz SB. Novel molecules that interact with microtubules and have functional activity similar to Taxol. Drug Discov Today 2001; 6: 1153–64. 36. Jordan MA, Wendell K, Gardiner S, Derry WB, Copp H, Wilson L. Mitotic block induced in HeLa cells by low concentrations of paclitaxel (Taxol) results in abnormal mitotic exit and apoptotic cell death. Cancer Res 1996; 56: 816–25. 37. Sakowicz R, Berdelis MS, Ray K, et al. A marine natural product inhibitor of kinesin motors. Science 1998; 280: 292–5. 38. Mayer TU, Kapoor TM, Haggarty SJ, King RW, Schreiber SL, Mitchison TJ. Small molecule inhibitor of mitotic spindle bipolarity identified in a phenotype based screen. Science 1999; 286: 971–4. 39. Kapoor TM, Mayer TU, Coughlin ML, Mitchison TJ. Probing spindle assembly mechanisms with monastrol, a small molecule inhibitor of the mitotic kinesin, Eg5. J Cell Biol 2000; 150: 975–88. |