| |
| Med Sci (Paris). 2004 January; 20(1): 73–77. Published online 2004 January 15. doi: 10.1051/medsci/200420173.Le gène codant pour l’I-BABP est-il impliqué dans l’homéostasie du cholestérol ? Philippe Besnard,* Jean-François Landrier, Jacques Grober, and Isabelle Niot Laboratoire de physiologie de la nutrition, École nationale supérieure de biologie appliquée à la nutrition et à l’alimentation (ENSBANA), UMR 5170-CESG Cnrs/INRA/Université de Bourgogne, 1, esplanade Érasme, 21000 Dijon, France |
Le maintien d’un réservoir de cholestérol dans l’organisme dépend de l’ajustement permanent des pertes (utilisation cellulaire et élimination fécale sous forme native et d’acides biliaires) aux apports (alimentation et synthèse endogène). On sait que le foie et l’intestin jouent un rôle prépondérant et complémentaire dans l’homéostasie du cholestérol : ainsi, la bioconversion hépatique du cholestérol en acides biliaires, puis la régulation de la réabsorption intestinale des acides biliaires sont des mécanismes essentiels au maintien de l’homéostasie du cholestérol. Si la régulation des gènes codant pour les enzymes clés de la biosynthèse hépatique des acides biliaires a largement été étudiée (pour revue, voir [
1]), les informations concernant les acteurs de leur réabsorption intestinale sont en revanche plus rares. |
Vers un décryptage progressif du transport intestinal des acides biliaires La réabsorption des acides biliaires s’effectue le long de l’intestin grêle par l’intermédiaire de différents mécanismes complémentaires (Figure 1). Alors que la réabsorption des acides biliaires non conjugués se fait par simple diffusion, celle des acides biliaires conjugués requiert la présence de transporteurs membranaires plus ou moins spécifiques, dont l’existence au pôle apical des entérocytes est de découverte récente (pour revue, voir [
3]). Au-delà de la participation de l’organic anion transport protein 3 (OATP3) [
4,
5] aux niveaux jéjunal et iléal, l’essentiel de la recapture des acides biliaires s’effectue par l’intermédiaire d’un transport actif strictement iléal. Il s’agit d’un phénomène complexe impliquant des protéines membranaires et solubles présentant une spécificité et une affinité fortes pour les acides biliaires conjugués di- et trihydroxylés (Figure 2). Dans la bordure en brosse de l’iléocyte, les acides biliaires sont pris en charge par l’intestinal bile acid-transporter (I-BAT), une protéine membranaire également appelée apical sodium-dependent bile acid transporter (ASBT) [
6]. Chez l’homme, certaines mutations du gène codant pour l’I-BAT entraînent une malabsorption sévère des acides biliaires qui est à l’origine de profondes perturbations du métabolisme lipidique [
7]. 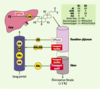 | Figure 1.
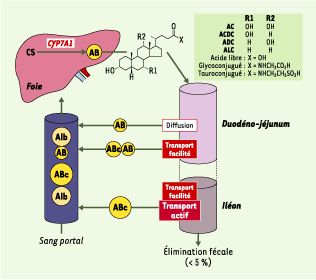
Cycle entérohépatique des acides biliaires. Les acides biliaires (AB) sont synthétisés dans le foie à partir du cholestérol (CS). Après conjugaison avec la glycine ou la taurine, les acides biliaires (ABc) sont sécrétés dans la bile, puis stockés dans la vésicule biliaire. Après une prise alimentaire, les acides biliaires se retrouvent dans la lumière duodénale où ils participent à la digestion et à l’absorption des graisses alimentaires. Plus de 95 % des acides biliaires déversés dans l’intestin sont réabsorbés grâce à trois mécanismes complémentaires : diffusion passive, transport facilité et transport actif. Sous forme liée à l’albumine (Alb), ils regagnent le foie par la voie portale avant d’être sécrétés de nouveau dans la bile. Ce cycle entérohépatique intervient six à dix fois par jour chez l’homme sain. La synthèse hépatique des acides biliaires, sous le contrôle principal de la cholestérol 7α hydroxylase (CYP7A1), compense les pertes fécales. AC : acide cholique ; ACDC : acide chénodésoxycholique ; ADC : acide désoxycholique ; ALC : acide lithocholique. |
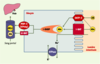 | Figure 2.
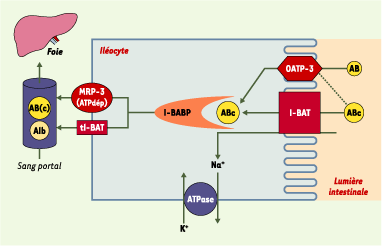
Transport actif des acides biliaires au niveau iléal. L’essentiel de la recapture intestinale des acides biliaires s’effectue par l’intermédiaire d’un transport actif strictement iléal. La capture apicale des acides biliaires conjugués (ABc) ou non (AB) nécessite un cotransport sodium/acides biliaires dépendant de l’ATP et assuré par l’intestinal bile acid transporter (I-BAT). Ce système est complété par une protéine membranaire peu spécifique, l’organic anion transport protein 3 (OATP3). Une fois dans l’iléocyte, les acides biliaires sont liés de façon réversible à l’ileal bile acid-binding protein (I-BABP). Les acides biliaires franchiraient la membrane basolatérale de l’iléocyte par l’intermédiaire de deux transporteurs membranaires dont le rôle respectif n’est pas encore clair, la multidrug resistance protein 3 (MRP 3) et une forme tronquée de l’I-BAT (tI-BAT). Dans le sang portal, les acides biliaires sont principalement liés à l’albumine (Alb). |
Une fois dans la cellule, les acides biliaires sont pris en charge avec une affinité et une spécificité importantes par l’ileal bile acid-binding protein (I-BABP), également dénommée ileal lipid-binding protein (ILBP), une protéine soluble de 15 kDa dont l’ADNc a été cloné dans de nombreuses espèces, notamment chez l’homme [
8]. Enfin, les acides biliaires sont sécrétés dans la circulation portale par l’intermédiaire d’au moins deux transporteurs localisés au niveau de la membrane basolatérale de l’iléocyte : la multidrug resistance protein 3 (MRP3) et tI-BAT, une forme tronquée de l’I-BAT (pour revue, voir [
9]). |
L’I-BABP : une protéine en quête de fonctions Bien que le rôle physiologique de l’I-BABP ne soit pas encore clairement établi, ses propriétés de liaison des acides biliaires, son abondance et sa localisation iléale [
10–
13] suggèrent qu’elle intervient dans la capture et le transport des acides biliaires depuis la membrane apicale vers la membrane basolatérale de l’iléocyte (Figure 2). Dans ce cas, on peut penser que le niveau d’expression de cette protéine retentit sur l’efficacité du recyclage des acides biliaires, et joue un rôle critique dans l’homéostasie du cholestérol. Des acides biliaires inducteurs de gènes La première démonstration du contrôle de l’expression de l’I-BABP par un facteur biliaire a été obtenue en réalisant une dérivation iléale chez le rat [
14], dans l’objectif d’isoler in situ l’iléon distal. L’absence chronique de bile conduit à une chute de l’expression de l’I-BABP (ARNm et protéine), tandis que l’instillation répétée de bile l’induit fortement. Cette régulation est directe, puisque qu’elle a pu être reproduite in vitro sur des explants iléaux de rat et sur des cellules humaines de type entérocytaire de la lignée Caco-2 [ 14]. Les acides biliaires sont les seuls composés de la bile à avoir cet effet inducteur sur l’expression de l’I-BABP ; celui-ci est dépendant de la structure des acides biliaires, les composés les plus hydrophobes (acides chénodésoxycholique et désoxycholique) étant les inducteurs les plus puissants [
15]. En ce qui concerne le mécanisme moléculaire de cette induction, il a été démontré que les acides biliaires sont des ligands et des activateurs physiologiques du farnesoid-X-receptor (FXR) [
16–
18], un récepteur nucléaire jusqu’alors orphelin. Par ailleurs, une colocalisation stricte a été démontrée chez la souris entre le FXR et l’I-BABP [
19], ce qui conforte l’hypothèse d’une relation fonctionnelle entre ces deux protéines. Des expériences de retard de migration sur gel et de transfections transitoires de cellules Caco-2 ont permis d’établir que le FXR, une fois hétérodimérisé avec le RXR (retinoid-X-receptor), reconnaît une séquence de réponse spécifique, baptisée bile acid-responsive element (BARE), responsable de la transactivation du promoteur humain de l’I-BABP par les acides biliaires (Figure 3) [19]. 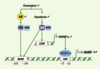 | Figure 3.
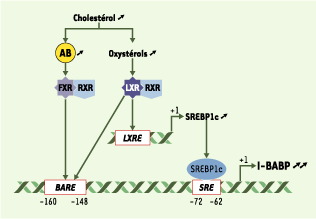
Régulation de l’expression du gène codant pour l’I-BABP par les stérols. Une surcharge en cholestérol s’accompagne d’une augmentation de la synthèse d’acides biliaires (AB) et d’oxystérols, à l’origine de l’activation de deux voies régulatrices aboutissant à l’induction de l’expression du gène codant pour l’I-BABP. Les acides biliaires sont des ligands et des activateurs physiologiques du récepteur nucléaire farnesoid-X-receptor (FXR), qui forme un hétérodimère avec le récepteur retinoid-X-receptor (RXR) ; cet hétérodimère reconnaît la séquence spécifique bile acid responsive element (BARE), responsable de la transactivation du promoteur du gène codant pour l’I-BABP. L’augmentation de la synthèse des oxystérols active, quant à elle, le liver-X-receptor (LXR), qui forme un hétérodimère avec RXR, responsable de la reconnaissance d’une séquence spécifique LXR-responsive element (LXRE) du gène codant pour la sterol responsive element-binding protein 1c (SREBP1c), dont l’expression est augmentée. SREBP1c se fixe sur une séquence sterol responsive element (SRE) du gène codant pour l’I-BABP et augmente son expression. LXR peut également se fixer directement sur le BARE. |
Le gène codant pour l’I-BABP : une cible des stérols Une régulation directe du gène codant pour l’I-BABP par le cholestérol peut également être envisagée. L’hypothèse formulait qu’un excès de cholestérol conduit à une répression de l’expression du gène codant pour l’I-BABP, afin de réduire la réabsorption des acides biliaires et d’augmenter leur excrétion fécale. L’activité transcriptionnelle des sterol-responsive element-binding proteins (SREBP) étant dépendante de la concentration intracellulaire de cholestérol, l’implication de ce type de facteurs de transcription dans ce schéma régulateur était probable. Des souris ont donc été soumises de façon chronique à un régime fortement enrichi en cholestérol. De façon inattendue, compte tenu de l’hypothèse de travail, ce changement nutritionnel s’est accompagné d’une augmentation des concentrations d’ARNm de l’I-BABP dans l’iléon. Une approche ex vivo réalisée sur les explants iléaux a permis d’écarter la possibilité que cet effet soit lié à une augmentation de la production d’acides biliaires après induction de la CYP 7A1 (cholestérol 7α-hydroxylase) par le cholestérol [
20]. Une série d’expériences réalisées chez des souris traitées avec un agoniste pharmacologique spécifique du LXRα (liver X receptor α), le GW3965, a en fait permis d’aboutir à la conclusion qu’une surcharge alimentaire en cholestérol, et donc l’augmentation de la concentration cellulaire en oxystérols, induit une augmentation de l’expression de l’I-BABP via une cascade d’événements incluant la régulation de SREBP1c par le LXR [20] (Figure 3). Une régulation directe via la fixation de LXR sur le BARE vient également d’être démontrée [
21]. |
I-BABP et homéostasie du cholestérol Si la fonction physiologique précise de l’I-BABP est toujours incertaine [
22], l’étroite régulation de l’expression de son gène par le cholestérol, les acides biliaires et les oxystérols, via des acteurs transcriptionnels (FXR, LXR, SREBP1c) qui sont autant de détecteurs cellulaires de stérols, suggère que ce gène pourrait jouer un rôle important dans l’homéostasie du cholestérol. L’intégration de l’I-BABP dans un schéma régulateur plus global fait ressortir une possible implication de cette protéine dans deux événements dont l’impact dans l’homéostasie du cholestérol n’est pas négligeable : le maintien de l’intégrité de la muqueuse iléale et la modulation de la perte fécale du cholestérol (Figure 4).  | Figure 4.
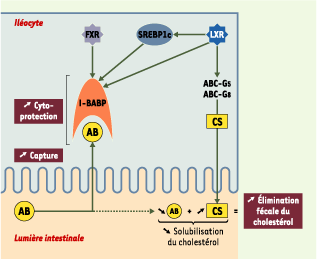
Implications possibles de l’I-BABP dans l’homéostasie du cholestérol. Une surcharge en cholestérol (CS) est susceptible d’entraîner au moins deux effets au niveau de différents gènes intestinaux : l’induction de l’expression de l’ileal bile acid-binding protein (I-BABP), entraînant une augmentation de la réabsorption des acides biliaires (AB) dans l’iléon (voir Figure 3), et l’augmentation, via le liver-X-receptor (LXR), de la synthèse des transporteurs membranaires ATP-binding cassette G5 et G8 (ABC-G5 et G8) responsables de l’efflux cellulaire de cholestérol. Le premier effet concourt au maintien de l’intégrité de la muqueuse iléale, tandis qu’une coordination des deux effets est susceptible d’augmenter l’élimination fécale de cholestérol, en raison du déséquilibre progressif du rapport cholestérol/acides biliaires dans la lumière intestinale et de la chute de solubilisation micellaire du cholestérol qui en résulte. FXR : farnesoid-X-receptor ; SREBP1c : sterol regulatory element-binding protein1c.
|
La surcharge alimentaire en cholestérol s’accompagne d’une augmentation de la synthèse d’acides biliaires et d’oxystérols, ces modifications provoquant à leur tour une forte induction de l’expression du gène codant pour l’I-BABP, via les voies FXR et LXR/SREBP1c. Cette induction aboutit à une augmentation de la capacité de liaison des acides biliaires au niveau de l’iléocyte, qui contribue au maintien de l’intégrité de la muqueuse iléale1, indispensable au bon déroulement du cycle entérohépatique des acides biliaires, et de ce fait à l’homéostasie du cholestérol. Un rôle indirect de l’I-BABP dans l’élimination fécale du cholestérol est également envisageable. Cette hypothèse fait appel à l’implication conjointe de transporteurs membranaires responsables de l’efflux cellulaire du cholestérol, les ATP-binding cassette G-5 et G-8 (ABCG-5 et -8) [
24]. Il a récemment été montré que l’expression des gènes codant pour ces protéines est sous le contrôle de LXR, et l’induction simultanée de l’expression de l’I-BABP, de l’ABCG-5 et de l’ABCG-8 consécutive à une charge en cholestérol pourrait se traduire au niveau de l’iléocyte par une augmentation conjointe de la réabsorption des acides biliaires et de l’efflux du cholestérol. Ces flux cellulaires opposés, provoquant le déséquilibre progressif du rapport cholestérol/acides biliaires dans la lumière intestinale, devraient conduire à une chute de la solubilisation micellaire du cholestérol. La conséquence finale serait une excrétion fécale accrue de cholestérol (Figure 4), phénomène effectivement constaté chez des souris traitées avec un agoniste pharmacologique de LXR [24]. L’utilisation de modèles animaux surexprimant de façon spécifique de tissu l’I-BABP, ou à l’inverse présentant une invalidation du gène codant pour cette protéine, devrait permettre d’éprouver la pertinence de ces hypothèses fonctionnelles. |
Le contrôle étroit de l’expression de l’I-BABP par les stérols suggère que cette protéine intestinale peut être importante pour l’homéostasie du cholestérol. S’il semble exclu que l’I-BABP joue un rôle direct et prépondérant dans la modulation de l’élimination fécale des acides biliaires, on peut raisonnablement penser que ce transporteur soluble d’acides biliaires participe au maintien efficace de la circulation entérohépatique d’acides biliaires et au contrôle de l’excrétion fécale du cholestérol. Une meilleure connaissance du transport intestinal des lipides pourrait, à terme, conduire à des actions thérapeutiques ciblées visant à corriger les dyslipidémies, dont l’incidence sur la santé n’est plus à démontrer. |
Les travaux présentés dans cet article ont été financés par le Conseil Régional de Bourgogne et par GlaxoSmithKline.
|
Footnotes |
1. Russell DW, Setchell KD. Bile acid biosynthesis. Biochemistry 1992; 31 : 4737–49. 2. Repa JJ, Mangelsdorf DJ. The role of orphan nuclear receptors in the regulation of cholesterol homeostasis. Annu Rev Cell Dev Biol 2000; 16 : 459–81. 3. Meier PJ, Stieger B. Bile salt transporters. Annu Rev Physiol 2002; 64 : 635–61. 4. Abe T, Kakyo M, Sakagami H, et al Molecular characterization and tissue distribution of a new organic anion transporter subtype (oatp3) that transports thyroid hormones and taurocholate and comparison with oatp2. J Biol Chem 1998; 273 : 22395–401. 5. Walters HC, Craddock AL, Fusegawa H, Willingham MC, Dawson PA. Expression, transport properties, and chromosomal location of organic anion transporter subtype 3. Am J Physiol Gastrointest Liver Physiol 2000; 279 : G1188–200. 6. Schneider BL, Dawson PA, Christie DM, Hardikar W, Wong MH. Cloning and molecular characterization of the ontogeny of a rat ileal sodium-dependent bile acid transporter. J Clin Invest 1995; 95 : 745–54. 7. Oelkers P, Kirby LC, Heubi JE, Dawson PA. Primary bile acid malabsorption caused by mutations in the ileal sodium-dependent bile acid transporter gene (SLC10A2). J Clin Invest 1997; 99 : 1880–7. 8. Fujita M, Fujii H, Kanda T, Sato E, Hatakeyama K, Ono T. Molecular cloning, expression, and characterization of a human intestinal 15-kDa protein. Eur J Biochem 1995; 233 : 406–13. 9. Shneider BL. Intestinal bile acid transport : biology, physiology, and pathophysiology. J Pediatr Gastroenterol Nutr 2001; 32 : 407–17. 10. Bernlohr DA, Simpson MA, Hertzel AV, Banaszak LJ. Intracellular lipid-binding proteins and their genes. Annu Rev Nutr 1997; 17 : 277–303. 11. Zimmerman AW, van Moerkerk HT, Veerkamp JH. Ligand specificity and conformational stability of human fatty acid- binding proteins. Int J Biochem Cell Biol 2001; 33 : 865–76. 12. Lucke C, Zhang F, Hamilton JA, Sacchettini JC, Ruterjans H. Solution structure of ileal lipid binding protein in complex with glycocholate. Eur J Biochem 2000; 267 : 2929–38. 13. Kramer W, Sauber K, Baringhaus KH, et al. Identification of the bile acid-binding site of the ileal lipid-binding protein by photoaffinity labeling, matrix-assisted laser desorption ionization-mass spectrometry, and nmr structure. J Biol Chem 2001; 276 : 7291–301. 14. Kanda T, Niot I, Foucaud L, et al. Effect of bile on the intestinal bile-acid binding protein (I-BABP) expression. In vitro and in vivo studies. FEBS Lett 1996; 384 : 131–4. 15. Kanda T, Foucaud L, Nakamura Y, et al. Regulation of expression of human intestinal bile acid-binding protein in Caco-2 cells. Biochem J 1998; 330 : 261–5. 16. Wang H, Chen J, Hollister K, Sowers LC, Forman BM. Endogenous bile acids are ligands for nuclear receptor FXR/BAR. Mol cell 1999; 3 : 543–53. 17. Parks DJ, Blanchard SG, Bledsoe RK, et al. Bile acids : natural ligands for an orphan nuclear receptor. Science 1999; 284 : 1365–8. 18. Makishima M, Okamoto AY, Repa JJ, et al. Identification of a nuclear receptor for bile acids. Science 1999; 284 : 1362–5. 19. Grober J, Zaghini I, Fujii H, et al. Identification of a bile acid-responsive element in the human ileal bile acid-binding protein gene. Involvement of the farnesoid x receptor/9-cis-retinoic acid receptor heterodimer. J Biol Chem 1999; 274 : 29749–54. 20. Zaghini I, Landrier JF, Grober J, et al. Sterol regulatory element-binding protein-1c is responsible for cholesterol regulation of ileal bile acid-binding protein gene in vivo. Possible involvement of liver-X-receptor. J Biol Chem 2002; 277 : 1324–31. 21. Landrier JF, Grober J, Demydchuk J, Besnard P. FXRE can function as an LXRE in the promoter of human ileal bile acid-binding protein (I-BABP) gene. FEBS Lett 2003; 553 : 299–303. 22. Landrier JF, Grober J, Zaghini I, Besnard P. Regulation of ileal bile acid-binding protein gene : an approach to determine its physiological function(s). Mol Cell Biochem 2002; 239 : 149–55. 23. Repa JJ, Liang G, Ou J, et al. Regulation of mouse sterol regulatory element-binding protein-1c gene (SREBP-1c) by oxysterol receptors, LXRα and LXRβ. Genes Dev 2000; 14 : 2819–30. 24. Plösch T, Kok T, Bloks VW, et al. Increased hepatobiliary and fecal cholesterol excretion upon activation of the liver-X-receptor (LXR) is independent of ABCA1. J Biol Chem 2002; 277 : 33870–7. |