| |
| Med Sci (Paris). 2004 January; 20(1): 84–88. Published online 2004 January 15. doi: 10.1051/medsci/200420184.Les MAGUK : au-delà de l’accrochage des canaux ioniques David Godreau, Nathalie Neyroud, Roger Vranckx, and Stéphane Hatem* Inserm U. 460, bâtiment 13, CHU Xavier Bichat-Claude Bernard, 46, rue Henri Huchard, 75877 Paris Cedex 18, France |
Il ne suffit pas que des canaux - macromolécules protéiques creuses qui laissent circuler les ions - soient présents dans la membrane des cellules, pour que ces dernières soient excitables, c’est-à-dire capables de déclencher et de transmettre un signal électrique en réponse à une stimulation. Il faut aussi que ces canaux soient localisés dans certaines régions de la membrane, là où sont concentrés les récepteurs, les seconds messagers, les protéines d’ancrage aux cellules voisines ou à la matrice extracellulaire. D’un point de vue anatomique, ces régions sont bien connues, il s’agit des synapses neuronales du système nerveux central, des terminaisons axonales ou encore des disques intercalaires du myocarde. En revanche, l’identification des mécanismes moléculaires qui localisent et regroupent les canaux dans ces domaines spécialisés de la membrane est l’objet d’une intense activité de recherche. De nombreuses protéines participent plus ou moins directement à ce processus, cet article ne portera que sur celles possédant de multiples domaines d’interaction protéique. |
Les MAGUK, armature protéique des synapses C’est l’étude des jonctions synaptiques du système nerveux qui a révélé le rôle central joué dans leur formation par les protéines à domaines PDZ (post synaptic disc-large zona ou zonula occludens). Le groupe le plus important de cette famille est celui des MAGUK (membrane-associated guanylate kinase) dont le chef de file est la SAP90/PSD95 (synapse-associated protein 90/post synaptic density 95) et qui comprend également la SAP97/hdlg (human homolog of Drosophila discs large protein), la SAP102, la chapsyne 110/PSD-93, les protéines ZO (zona occludens) et la CASK (calcium/calmodulin-dependent serine protein kinase) [
1–
3]. Ce sont des protéines à multiples domaines d’interaction protéique qui possèdent un à trois domaines PDZ, un domaine SH3 (Src homology-3) et un domaine de type guanylate kinase, le domaine GuK (Figure 1). Le domaine PDZ est constitué de 90 acides aminés organisés en 2 hélices α et 4 feuillets β et interagit avec une forte affinité avec des motifs Thr/Ser-X-Val/Leu le plus souvent situés sur la partie carboxy-terminale des protéines [
4]. Les premières évidences indiquant que les protéines MAGUK interviennent dans « l’échafaudage » des synapses ont été obtenues dans des systèmes d’expression montrant que la protéine PSD-95/SAP-90 se fixe sur la partie carboxy-terminale des canaux potassiques Shaker et du récepteur-canal NMDA (N-méthyl-D-aspartate) entraînant leur regroupement à la membrane [
5,
6] (Tableau I). Chez la drosophile, le produit du gène discs-large-associated protein 1 (Dlg-A) est une MAGUK apparentée à la PSD-95/SAP-90 qui attache les canaux K+ Shaker à une protéine d’adhérence cellulaire, la fascicline-I. [
7]. Depuis, il a été rapporté que les protéines PSD-95 et CASK se fixent sur différentes protéines transmembranaires qui interviennent dans l’adhérence des cellules entre elles ou avec la matrice extracellulaire comme la neuroligine, la neurexine ou le syndécan (un constituant des protéoglycanes). Des interactions avec des protéines du cytosquelette via la protéine 4.1 qui se fixe sur l’actine cytosquelettique ont également été observées avec la SAP-97 alors que les protéines ZO se fixent directement sur l’actine [
2,
8].  | Figure 1.
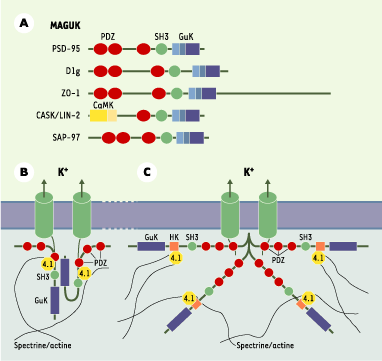
Les protéines MAGUK et leurs domaines d’interaction.A. Les principaux membres de la famille des protéines MAGUK. PSD-95 ( post synaptic density 95 protein) ; Dlg ( discs-large [Drosophila] protein) ; ZO-1 ( zona occludens-1 protein) ; CASK/LIN-2 ( calcium/calmodulin-dependent serine protein kinase) ; SAP-97 ( synapse-associated protein 97) ; PDZ ( domaine PDZ ou post synaptic disc-large zona) ; SH3 (Src homology 3 domain) ; GK (domaine guanylate kinase) ; CaMK ( calcium/calmodulin-dependent protein kinase-like domain). B, C. Modèles de polymérisation des MAGUK, de regroupement des canaux et d’interaction avec les constituants du cytosquelette ( protéine 4.1, spectrine/actine). B. Les protéines PSD-95 interagissent par leurs domaines SH3 et GUK ( modifié d’après [
14]). C. Les protéines hDlg ( human homologue of Drosophila discs large protein) se polymérisent par leur domaine HOOK (HK) ( modifié d’après [
16]). |
 | Tableau I.
Les principaux partenaires des protéines MAGUK.
1 NMDA : N-méthyl-D-aspartate. 2 nNOS : neuronal nitric oxide synthase. 3 GKAP : guanylate kinase domain interacting protein. 4 SAPAP : synapse-associated protein 90/postsynaptic density-95 associated protein. 5 AMPA GluR1 : L-a-amino-3-hydroxy-5-methylisoxazole-4-propionate receptor subunit GluR1. |
|
Les MAGUK ne servent pas seulement à accrocher les canaux à la membrane Lorsque l’on invalide le gène de la PSD-95/SAP-90 chez la souris, la localisation synaptique des récepteurs NMDA est inchangée de même que les caractéristiques du courant qu’ils produisent [
9]. En revanche, les animaux présentent des défauts de mémorisation et de transmission synaptique, témoignant d’un mauvais fonctionnement des récepteurs NMDA. L’explication proposée est que l’absence de PSD-95 chez les souris mutantes serait responsable d’un découplage des récepteurs avec certaines voies de signalisation, en particulier avec la NOS (nitric oxide synthase) neuronale [
10]. Les MAGUK sont aussi des intermédiaires entre des récepteurs et les voies de signalisation. Depuis, d’autres exemples ont été rapportés de fixation de seconds messagers sur les protéines MAGUK comme la calmoduline ou certaines tyrosines kinases qui interagissent avec la PSD-95, la CASK ou encore la SAP-102 [1, 2]. L’importance physiologique de ce rôle d’intermédiaire des MAGUK a bien été démontrée dans le cas des neurones dopaminergiques. Ces cellules possèdent un courant potassique dit à rectification entrante qui traverse des canaux de type Kir3.2c qui s’ouvrent lorsqu’un agoniste se fixe sur un récepteur muscarinique ou purinergique. Cette signalisation s’effectue grâce à des protéines G qui couplent les récepteurs et les canaux Kir3.2c. Lorsque ces derniers sont exprimés seuls dans des œufs de xénope, ils ne sont pas stimulés par les protéines G et ne le deviennent qu’en présence de la protéine SAP-97 [
11]. À côté de leurs effets permissifs sur les voies de signalisation, il existe probablement d’autres mécanismes par lesquels les MAGUK modulent le fonctionnement des canaux. Ainsi, le regroupement des Ca2+-ATPases membranaires par les PSD-95 favorise la fonction de pompe à Ca2+ de ces canaux par un mécanisme encore inconnu de coopération des protéines [
12]. |
Comment les MAGUK favorisent-elles le regroupement et les interactions fonctionnelles des canaux Une explication pourrait être fournie par la capacité des MAGUK de s’agréger « tête-bêche », par leurs domaines SH3 et GuK ou par leur extrémité amino-terminale, entraînant la constitution de réseaux et d’agrégats formés par des protéines accrochées à leurs domaines PDZ, en premier lieu, les canaux [
13–16] (Figure 1B et 1C). Cette concentration de protéines pourrait favoriser les interactions et les coopérations des différents acteurs qui participent à la formation et au fonctionnement du complexe canalaire. Sur le domaine SH3 peut aussi venir se fixer le propre domaine GuK de la protéine ou un domaine riche en acides aminés de type proline présent dans la partie amino-terminale de certaines isoformes de la SAP-97 [16]. Dans ce cas, la MAGUK forme une boucle sur elle-même et ne peut plus s’agréger avec les autres protéines. On ne connaît pas encore les mécanismes qui règlent l’auto- ou l’hétéro-agrégation des MAGUK ni les conséquences de ce processus sur l’organisation des canaux, mais il est probable qu’il s’agit là d’une source importante de plasticité de l’activité électrique des cellules [
17]. |
Les MAGUK sont des protéines ubiquitaires Les cellules nerveuses ne sont pas les seules cellules où les protéines MAGUK interviennent dans l’organisation des protéines membranaires. Ainsi, la SAP-97/hDlg joue un rôle majeur dans la polarisation des barrières épithéliales grâce à la présence dans sa partie amino-terminale d’une soixantaine d’acides aminés, non retrouvés dans les autres MAGUK, qui lui permettent d’interagir avec un complexe de protéines d’adhérence, comprenant l’E-cadhérine/caténine, localisé au niveau des zones d’adhérence des cellules épithéliales [
18,
19]. Dans le myocarde également, la localisation des canaux ioniques au niveau des disques intercalaires ou des tubules T met en jeu des MAGUK, les protéines SAP-97 et ZO-1 étant abondamment exprimées dans ce tissu [
20,
21]. Ainsi, les canaux potassiques Shaker Kv1.5 responsables d’un des principaux courants repolarisants du myocarde humain sont associés, in situ, aux protéines SAP-97 : la plus grande partie des canaux co-précipite avec la MAGUK et la co-expression des deux protéines clonées double l’intensité du courant potassique [21]. Il est possible que la SAP-97 cardiaque, comme celle des autres tissus excitables, optimise l’adressage membranaire des canaux et facilite certaines régulations ou processus de coopération entre des sous-unités canalaires. Ce sont aussi des protéines MAGUK, ZO-1, qui concentrent au niveau des disques intercalaires les connexines qui, en se regroupant, forment de larges canaux, les connexons, qui permettent le couplage électrique des myocytes entre eux. Lorsque ces jonctions communicantes sont altérées, comme c’est le cas au cours de nombreuses cardiopathies, les connexines s’internalisent par un processus qui met en jeu la protéine ZO-1 [
22]. Cette observation surprenante est à rapprocher de ce que l’on connaît du rôle de ZO-1 dans la mise en place des jonctions communicantes au cours de l’ontogenèse. Dans les deux cas, ZO-1 est probablement un acteur clé de la mise en place des jonctions cellulaires et de leur remodelage. Dans d’autres circonstances, les MAGUK pourraient intervenir dans le remodelage des membranes cardiaques. Par exemple, les calpaïnes, des protéases activées par le calcium, clivent la SAP-97 et la PSD-95 cardiaque, entraînant l’accumulation dans le cytosol des myocytes humains de forme courte des MAGUK [21]. Par analogie avec ce qui est connu dans le système nerveux, le clivage des MAGUK par la calpaïne est peut-être une étape importante dans les processus de renouvellement des canaux membranaires, tout particulièrement lorsque l’activité des ces protéases est anormalement augmentée. |
On peut raisonnablement prédire que la liste des protéines dont l’organisation cellulaire est contrôlée par des MAGUK va encore s’allonger. De même, d’autres fonctions de ces protéines d’accrochage seront identifiées. Et c’est probablement toute notre compréhension des mécanismes de la plasticité des membranes des cellules excitables qui sera bouleversée par ces nouvelles connaissances sur les partenaires des canaux ioniques. |
1. Fujita A, Kurachi Y. SAP family proteins. Biochem Biophys Res Commun 2000; 269 : 1–6. 2. Fanning AS, Anderson JM. Protein modules as organizers of membrane structure. Curr Opin Cell Biol 1999; 4 : 432–9. 3. Garner CC, Nash J, Huganir RL. PDZ domains in synapse assembly and signalling. Trends Cell Biol 2000; 10 : 274–80. 4. Doyle D, Lee A, Lewis J, Kim E, Sheng M, MacKinnon R. Crystal structures of a complexed and peptide-free membrane protein-binding domain : molecular basis of peptide recognition by PDZ. Cell 1996; 85 : 1067–76. 5. Kim E, Niethammer M, Rothschild A, Jan YN, Sheng M. Clustering of Shaker-type K+ channels by interaction with a family of membrane-associated guanylate kinases. Nature 1995; 275 : 85–8. 6. Kornau HC, Schenker LT, Kennedy MB, Seeburg PH. Domain interaction between NMDA receptor subunits and the postsynaptic density protéin PSD-95. Science 1995; 269 : 1737–40. 7. Zito K, Fetter RD, Goodman CS, Isacoff EY. Synaptic clustering of fascilin II and shaker : essentiel targeting sequences abd role of Dlg. Neuron 1997; 19 : 1007–16. 8. Cohen AR, Woods DF, Marfatia SM, Walther Z, Chishti AH, Anderson JM. Human CASK LIN-2 binds syndecan-2 and protein 4.1 and localizes to the basolateral membrane of epithelial cells. J Cell Biol 1998; 142 : 129–38. 9. Migaud M, Charlesworth, Dempster M, et al. Enhanced long-term potentiation and impaired learning in mice with mutant postsynaptic density-95 protein. Nature 1998; 396 : 433–9. 10. Christopherson KS, Hillier BJ, Lim WA, Bredt DS. PSD-95 assembles a ternary complex with the N-methyl-D-aspartic acid receptor and a bivalent neuronal NO synthase PDZ domain. J Biol Chem 1999; 274 : 27467–73. 11. Hibino H, Inanobe A, Tanemoto M, et al. Anchoring proteins confer G protein sensitivity to an inward-rectifier K+ channel through the GK domain. EMBO J 2000; 19 : 78–83. 12. DeMarco SJ, Strehler EE. Plasma membrane Ca2+ ATPase isoforms 2β and 4β interact promiscuously abd selectively with members of the membrane-associated guanylate kinase (MAGUK) family of PDZ (PSD-95/Dlg/Zo-1) domain-containing proteins. J Biol Chem 2001; 276 : 21594–600. 13. McGee AW, Bredt DS. Identification of an intramolecular interaction between the SH3 and guanylate kinase domains of PSD-95. J Biol Chem 1999; 274 : 17431–6. 14. McGee AW, Dakoji SR, Olsen O, Bredt DS, Lim WA, Prehoda KE. Structure of the SH3-guanylate kinase module from PSD-95 suggests a mechanism for regulated assembly of MAGUK scaffolding proteins. Mol Cell 2001; 8 : 1291–301. 15. Shin H, Hsueh YP, Yang FC, Kim E, Sheng M. An intramolecular interaction between Src homology 3 domain and guanylate kinase-like domain required for channel clustering by postsynaptic density-95/SAP90. J Neurosci 2000; 20 : 3580–7. 16. Marfatia SM, Byron O, Campbell G, Liu SC, Chisti AH. Human homologue of the drosophilia discs large tumor suppressor protein forms an oligomer in solution. J Biol Chem 2000; 275 : 13759–70. 17. Godreau D, Vranckx R, Maguy A, Goyenvalle C, Hatem SN. Different isoforms of synapse-associated protein, SAP97, are expressed in the heart and have distinct effects on the voltage-gated K+ channel Kv1.5. J Biol Chem 2003; 278 : 47046–52. 18. Wu H, Reuver S, Garner CC. E-cadherin mediated cell adhesion recruits SAP97 into cortical cytoskeleton. J Cell Sci 1998; 111 : 1071–80. 19. Reuver WH, Kuhlendahl S, Chung WJ, Garmer CC. Subcellular targeting and cytoskeletal attachment of SAP97 to the epithelial lateral membrane. J Cell Sci 1998; 111 : 2365–76. 20. Murata M, Buckett PD, Zhou J, Brunner M, Folco E, Koren G. SAP97 interacts with Kv1.5 in heterologus expression systems. Am J Physiol Heart Circ Physiol 2001; 281 : H2575–84. 21. Godreau D, Vranckx R, Maguy A, et al. Expression, regulation and role of the MAGUK protein SAP-97 in human atrial myocardium. Cardiovasc Res 2002; 56 : 433–42. 22. Barker RJ, Price RL, Gourdie RG. Increased association of ZO-1 with connexin43 during remodeling of cardiadc gap junctions. Circ Res 2002; 90 : 317–24. |