Tous les organismes vivants croissent. Ils trouvent dans leur environnement des substances nutritives, les ingèrent, se développent et prolifèrent. Mais la qualité nutritive de l’environnement peut changer, obligeant les organismes à percevoir ces variations et à y répondre. Ainsi, les levures règlent leur croissance en fonction de la disponibilité en nutriments dans le milieu extracellulaire, via un module de signalisation remarquablement conservé faisant intervenir la protéine kinase TOR (target of rapamycin) [ 1]. La même kinase TOR est inhibée dans les cellules de mammifères cultivées in vitro lorsqu’elles sont transférées dans un milieu ne contenant pas d’acides aminés, et la synthèse protéique est immédiatement arrêtée [ 2]. Ces mécanismes de régulation intrinsèques à la cellule sont clairement établis, cependant leur utilisation dans le contexte physiologique de la croissance d’un organisme composé de millions de cellules est encore largement inconnue. Chez les métazoaires, des circuits de régulations humorales, contrôlés par des molécules circulantes comme l’insuline ou les IGF (insulin-like growth factors) permettent d’harmoniser le métabolisme et la croissance des différents organes en fonction des conditions nutritionnelles. Nos travaux récents chez la drosophile font le lien entre ces deux modes de régulation et démontrent que la voie TOR est à l’origine d’un contrôle humoral de la croissance par la nutrition.
Chez la drosophile, comme chez la plupart des insectes holométaboles1, la taille de l’adulte ne varie pas et est déterminée par une période de croissance spectaculaire qui prend place au cours des stades larvaires. De fait, le développement de la larve de drosophile constitue un excellent modèle d’étude de la croissance [ 3]. La voie de signalisation de l’unique récepteur de l’insuline (dInR) et de la phosphatidylinositol-3-kinase (PI3K) contrôle la croissance et le métabolisme des deux types tissulaires qui constituent la larve : les tissus « imaginaux2 » qui prolifèrent, et les tissus endoréplicatifs dont les cellules grossissent sans se diviser [ 4]. Pendant la métamorphose au stade pupal, la plupart des tissus endoréplicatifs sont « histolysés 3 » au profit des tissus imaginaux qui sont réorganisés pour former les structures de l’adulte.
Le corps gras est un tissu endoréplicatif de la larve particulièrement sensible aux variations nutritionnelles [ 5]. Ce tissu dispersé remplit des fonctions équivalentes à celles du foie des mammifères, comme le stockage des protéines, des glucides et des lipides, mais il a aussi des fonctions endocrines. Nos expériences démontrent que le corps gras agit comme un senseur qui orchestre la croissance des autres tissus en fonction des conditions nutritionnelles [ 6].
Au cours d’un crible génétique entrepris pour rechercher des facteurs modifiant la croissance, nous avons identifié et caractérisé slimfast, un gène qui code pour un transporteur d’acides aminés. L’utilisation de lignées transgéniques exprimant un ARN interférent (ARNi) de façon inductible nous a permis d’inactiver la fonction de ce transporteur spécifiquement dans les cellules du corps gras, provoquant dans ces cellules un état de carence en acides aminés. De façon spectaculaire, cette carence ciblée entraîne un défaut de croissance de l’ensemble de la larve : la morphologie du corps gras est altérée, et la taille des tissus endoréplicatifs (corps gras inclus) est réduite. La croissance des tissus mitotiques formant les structures adultes est moins affectée, cependant la réduction de taille des adultes qui émergent peut atteindre 50 % (Figure 1). Ces effets sont similaires à ceux que l’on observe lors de carences nutritionnelles fortes ou chez les mutants dTOR [ 7, 8], et démontrent que le corps gras larvaire est le siège d’un mécanisme senseur de la nutrition.
| Figure 1.
Mise en carence ciblée du corps gras. Chez la mouche de droite (slimfastAnti), le gène slimfast qui code pour un transporteur d’acides aminés est inactivé sélectivement dans le corps gras par un effet ARNi. La croissance générale est affectée, indiquant que le corps gras joue un rôle « senseur » de la nutrition. |
Afin de comprendre comment le corps gras répond aux variations nutritionnelles, nous avons analysé la voie de signalisation TOR, conservée chez la drosophile. L’utilisation de formes dominante-négatives de la kinase TOR nous a permis de montrer que l’inhibition de cette voie dans le corps gras conduit aux mêmes défauts systémiques de croissance que ceux qu’entraîne l’inactivation de slimfast dans ce tissu. Inversement, la surexpression dans le corps gras d’une cible de la kinase TOR, la S6-kinase, suffit à annuler les effets de la carence nutritionnelle. Cela indique que le mécanisme senseur dans le corps gras utilise le module TOR pour déclencher une réponse systémique à la carence.
La question qui se pose alors est de savoir comment le corps gras module la croissance des autres tissus, une fois le senseur nutritionnel activé. Un des moyens d’affecter la croissance à distance est de moduler l’activité de la voie IGF/InR/PI3K. Plusieurs molécules de type IGF, les Dilp (Drosophila insulin-like peptides) sont sécrétées chez la drosophile par deux groupes de sept cellules neurosécrétrices, puis relâchées dans la circulation générale [ 9]. Des études d’ablation spécifique ont montré que l’activité sécrétrice de ces neurones est nécessaire à la croissance globale de l’organisme [ 10]. Afin de tester l’activité de la voie InR/PI3K dans les cellules réceptrices, nous avons utilisé un marqueur fluorescent (fusion GFP-domaine PH) qui permet de visualiser l’activité de la PI3-kinase dans les tissus. De façon remarquable, la mise en carence nutritionnelle du corps gras induit une très forte réduction de l’activité PI3-kinase dans les tissus périphériques.
En conditions de carence nutritionnelle, le corps gras affecte donc à distance la signalisation Dilp/InR dans les tissus de la larve. Cependant, l’expression des messagers DILP dans le cerveau n’est pas affectée par la carence en acides aminés, suggérant que le contrôle de la signalisation InR ne se fait pas directement au niveau de l’expression des ligands de type IGF. Une hypothèse possible pour expliquer ces effets est qu’en l’absence de nutriments, le corps gras cesse d’émettre un signal qui normalement potentialise l’activité des Dilp circulants. Nous avons récemment identifié une molécule pouvant remplir ce rôle: il s’agit de l’orthologue chez la drosophile de la glycoprotéine ALS (acid-labile subunit). Chez les mammifères, ALS lie l’IGF-BP (binding protein) et l’IGF-I dans un complexe ternaire, ce qui entraîne une forte stabilisation de l’IGF-I circulant [ 11]. Chez la drosophile, dALS pourrait avoir le même effet sur les Dilp. Le gène dALS est exprimé à des niveaux élevés dans le corps gras et son expression est supprimée par la carence nutritionnelle ou par l’inactivation de slimfast dans ce tissu. De façon remarquable, dALS est aussi exprimée dans les cellules neurosécrétrices exprimant les Dilp, renforçant l’hypothèse selon laquelle cette protéine joue le rôle de partenaire des Dilp circulants.
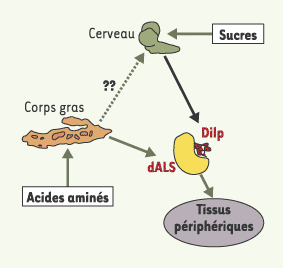
Nos expériences permettent d’établir un nouveau modèle pour le contrôle de la croissance larvaire qui intègre le contrôle intrinsèque par la voie TOR et le contrôle humoral par la voie IGF/InR/PI3K (Figure 2). En conditions nutritionnelles favorables, les taux élevés de carbohydrates circulants induisent la sécrétion des Dilp par le cerveau. Le niveau élevé d’acides aminés active la signalisation TOR dans tous les tissus et joue un rôle permissif sur la croissance. Dans le corps gras, les acides aminés activent la sécrétion de dALS, qui stabiliserait les Dilp circulants, potentialisant ainsi la croissance des tissus périphériques par un effet humoral.
Les parallèles avec les voies insuline et IGF décrites chez les mammifères sont nombreux et permettent d’envisager que ces découvertes contribuent à une meilleure compréhension des mécanismes généraux de contrôle de la croissance en relation avec la nutrition.