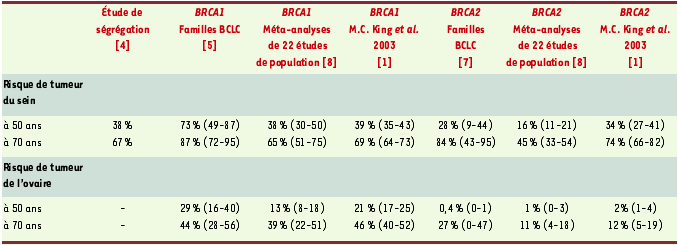
En octobre 2003 est paru un article dans Science signé par Mary-Claire King sur l’estimation des risques de cancers du sein et de l’ovaire associés aux altérations des gènes BRCA1 et BRCA2 [ 1] ; cet article est publié 13 ans quasiment jour pour jour après la publication par le même auteur et dans le même journal de la localisation de BRCA1 [ 2] et neuf ans après l’identification de BRCA1 [ 3]. Ce délai peut paraître long, et la publication dans Science inhabituelle, mais cela souligne combien l’estimation des risques est difficile, mais essentielle pour définir une stratégie de prise en charge des femmes ayant un risque important de développer une pathologie cancéreuse. L’étude de M.C. King n’est cependant pas la première qui ait examiné la pénétrance des altérations des gènes BRCA, mais son originalité vient de ce qu’après avoir identifié des femmes porteuses d’une mutation BRCA à partir de cas consécutifs de cancer du sein, c’est-à-dire sans faire intervenir l’histoire familiale dans la sélection (étude de population), le maximum de leurs apparentées ont été testées et la pénétrance a été estimée à partir de l’histoire médicale des seules apparentées porteuses d’une mutation BRCA. En effet, dans les études de population précédentes, l’analyse de la pénétrance prenait en compte la seule histoire médicale des apparentées et non l’analyse génétique des mutations des gènes BRCA. L’étude de M.C. King est donc plus informative. Entre 1996 et 2000, 1 008 femmes atteintes de cancer du sein et d’origine ashkénaze ont accepté la recherche de trois mutations des gènes BRCA1 : 185delAG, 5382insC, ou BRCA2 : 6174delT, mutations dont la fréquence dans la population ashkénaze est estimée à 2,5 %. Cent quatre (10,3 %) se sont avérées porteuses de l’une des trois mutations, ce qui ne différait pas d’études précédentes. Les risques de cancer du sein et de l’ovaire ont donc été estimés à partir des antécédents de cancer du sein et de l’ovaire des apparentées porteuses de mutations, et sont présentés dans le Tableau I. Nous y avons également indiqué les risques estimés par d’autres études : (1) l’étude d’épidémiologie génétique de E.B. Claus (étude de ségrégation qui a permis de retenir que 5 % des cas de cancer du sein dans la population générale américaine sont liés à une prédisposition génétique transmise selon le mode dominant et qui confère un risque donné de cancer du sein, risque non spécifique aux gènes BRCA) [ 4] ; (2) études des familles du Breast Cancer Linkage Consortium, familles qui ont contribué à l’identification des gènes BRCA ; et (3) méta-analyse de 22 études de population [4– 8].
| Tableau I. Risques de cancer du sein et de l’ovaire et mutations BRCA selon différentes études. BCLC : breast cancer linkage consortium ; entre parenthèses : intervalle de confiance. |
Dans leur ensemble, les risques de cancer du sein et de l’ovaire se rapprochent plus de ceux des études de familles que de ceux des études de population. Néanmoins, les risques de cancer du sein en présence de mutations BRCA1 et le risque de cancer de l’ovaire en présence de mutations BRCA2 ne sont pas différents quelles que soient les études. Bien que le plus grand soin ait été apporté pour limiter les biais, il n’est pas dit qu’ils l’aient été. En effet, pour un risque de cancer du sein de 82 % (intervalle de confiance : 77-87) chez les femmes porteuses d’une mutation BRCA, et en prenant en compte un risque cumulé de cancer du sein de 12 % dans la population générale, la fréquence attendue des femmes porteuses dans la population étudiée est de 14,9 % (IC : 14,1-15,7) et non de 10,3 %. On peut, de la même façon, calculer le risque de cancer du sein attendu pour une fréquence observée de 10,3 % de femmes prédisposées : 54 % et non 82 %. Il faut souligner que lorsque l’ensemble des femmes d’une fratrie n’a pas pu être étudiée, la fratrie n’a pas été prise en compte dans l’estimation des risques. Si la mobilisation de la fratrie a été plus facile lorsqu’au moins une des sœurs était atteinte, un biais en faveur de l’augmentation du risque a pu être introduit.
L’un des intérêts de l’étude réside dans l’observation que dans la moitié des cas, les patientes prédisposées n’ont pas d’histoire familiale de cancer du sein. Le génotypage des apparentées a permis alors de connaître l’origine parentale de la prédisposition et de mettre en évidence qu’il s’agissait dans la majorité des cas d’une mutation d’origine paternelle. Cette observation doit nous faire réfléchir sur les indications des études moléculaires BRCA qui, à notre sens, doivent sortir (aujourd’hui les indications sont subordonnées à une histoire familiale de cancer du sein) des stricts critères familiaux, en particulier devant le cas de femmes jeunes lors du diagnostic et dont l’histoire de la famille paternelle est peu informative du fait du faible nombre, voire de l’absence de femmes. Selon M.C. King, le corollaire de cette observation est qu’il n’y a pas ou peu d’hétérogénéité intrafamiliale du risque tumoral, ce qui ne plaiderait pas en faveur de l’existence de gènes modificateurs des risques tumoraux. Restons cependant prudents, car ce n’est pas ce que rapporte la méta-analyse des 22 études de population qui a repéré une variabilité du risque tumoral familial en fonction de l’âge du cas index et de la nature de la lésion tumorale (sein ou ovaire) [8].
Un autre intérêt de l’étude de M.C. King est d’avoir repéré un effet de l’environnement sur l’augmentation du risque de cancer du sein, effet que traduit l’année de naissance. En effet, l’étude a permis de mettre en évidence une augmentation du risque de cancer du sein au cours de ces dernières décennies : le risque à 50 ans est 2,5 fois plus important chez les femmes nées après 1940 que chez celles dont l’année de naissance est antérieure à 1940. Cette étude vient confirmer celle de S.A. Narod qui avait déjà estimé l’augmentation du risque relatif à 2,53 chez les femmes nées après 1930 par rapport à celles qui étaient nées avant 1930 [ 9]. L’étude avait été faite dans de très grandes familles dans lesquelles la mise en évidence d’une liaison au locus BRCA1 avait permis de distinguer de façon indirecte les femmes prédisposées de celles qui ne l’étaient pas. Le risque de cancer de l’ovaire était également augmenté d’un facteur 2,17 dans l’étude de S.A. Narod alors qu’il ne l’est pas dans l’étude de M.C. King. Les facteurs précis d’augmentation du risque de cancer au cours du temps restent à définir. Le poids, l’exercice physique pourraient être des facteurs protecteurs selon l’étude de M.C. King. Identifier ces paramètres représente sûrement le prochain défi qu’il nous faudra relever : c’est vrai aussi bien chez les femmes prédisposées que chez les femmes non prédisposées dont le risque de cancer du sein a également doublé au cours de ces 20 dernières années. Le suivi prospectif de femmes porteuses de mutations BRCA et dont on a analysé le mode de vie et les modalités de surveillance (notamment la place des mammographies répétées) devrait apporter des réponses.