| |
| Med Sci (Paris). 2004 April; 20(4): 437–441. Published online 2004 April 15. doi: 10.1051/medsci/2004204437.Protéines d’ancrage et mort subite cardiaque : comment et pourquoi ? Marc Pourrier1 and Stanley Nattel*2 1Département de pharmacologie et Centre de recherche 2Département de médecine, Centre de recherche et Institut de Cardiologie de Montréal. Université de Montréal, 5000, rue Bélanger Est, Montréal, Québec, H1T 1C8 Canada |
Le fonctionnement de nombreux tissus excitables (tissus cardiaque, cérébral, nerveux, musculaires lisse et strié) est contrôlé par le flux de courant ionique à travers les membranes cellulaires. Le cœur bat approximativement 100 000 fois par jour, et chaque battement requiert un ensemble coordonné de contractions musculaires, elles-mêmes déclenchées par une activité électrique finement rythmée et contrôlée. Lorsque l’activité électrique normale du cœur est perturbée (arythmie cardiaque), le dysfonctionnement de l’activité mécanique du cœur qui en résulte peut aboutir à l’évanouissement, voire à la mort subite. La mort subite peut être causée par plusieurs mécanismes, mais le plus commun est une rythmicité excessivement rapide et désordonnée de la contraction des ventricules, qui empêche le fonctionnement cardiaque. Aux États-Unis, 300 000 morts sont chaque année attribuées à des arythmies cardiaques. Il est maintenant établi que des anomalies génétiques prédisposent à ces arythmies mortelles. Jusqu’à présent, toutes les mutations qui leur étaient associées impliquaient directement des canaux ioniques (Tableau I). Mais, P.J. Mohler et al. ont identifié une nouvelle cause génétique de mort subite cardiaque [
1] ; celle-ci affecte une protéine adaptatrice ayant pour fonction de cibler des protéines cellulaires vers des domaines spécialisés situés au niveau de la membrane plasmique ou du réticulum endoplasmique.
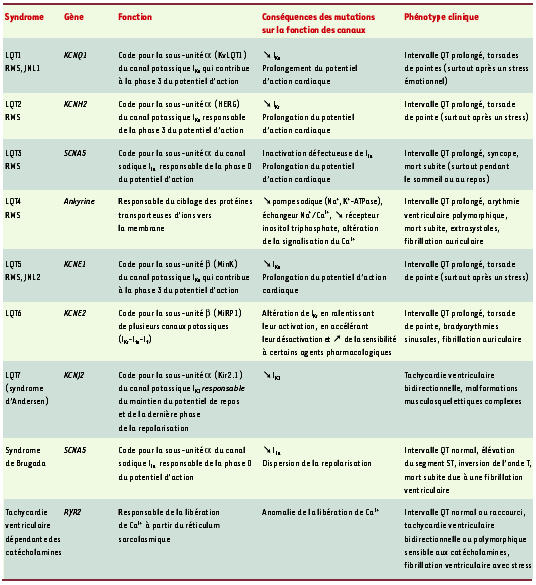
 | Tableau I.
Syndromes génétiques d’arythmie. RWS : syndrome de Romano Ward, forme autosomique dominante du syndrome du QT long (LQT) (1 à 6) ; JNL : syndrome de Jervell-Lange-Nielsen, forme autosomique récessive associée à une surdité congénitale ; RYR2 : récepteur de la ryanodine. KvLQT1 : voltage-gated potassium channel LQT1 ; HERG : human ether-a-go-go-related gene ; MinK : minimal potassium channel ; MiRP1 : MinK related peptide 1 ; Kir : inward rectifier potassium channel, 2.1 (famille 2, sous-famille 1). INa : courant sodique ; IKr : courant potassique sortant à composante rapide ; IKs : courant potassique sortant à composante lente ; IK1 : courant potassique à rectification entrante ; Ito : ouverture transitoire de courants potassiques ; If : courant pacemaker (I signifie courant). |
|
L’activité électrique cardiaque Les mécanismes cellulaires essentiels au contrôle de l’activité électrique cardiaque sont représentés dans la Figure 1, et ses fondements ioniques sous-jacents indiqués dans la Figure 2A. L’activité électrique débute au niveau du nœud sinusal à une fréquence qui permet de répondre aux besoins physiologiques. L’impulsion qui en résulte est ensuite conduite à travers le tissu cardiaque grâce, notamment, à l’entrée d’ions Na+ durant la phase 0 du potentiel d’action. Il s’ensuit une dépolarisation de la cellule (le potentiel membranaire devient plus positif) et le déclenchement du mécanisme de contraction musculaire par la libération d’ions Ca2+
à partir du réticulum endoplasmique. Une fois excitée, la cellule rentre dans une phase de non-excitabilité, ou période réfractaire, jusqu’à ce qu’elle retrouve son état de repos initial résultant de la repolarisation cellulaire.
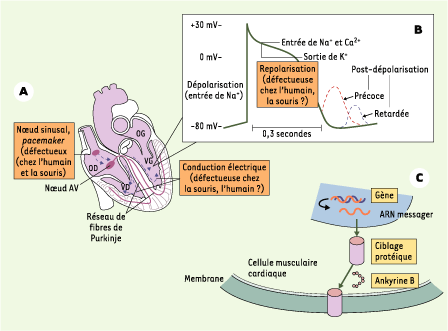
 | Figure 1.
Activité électrique responsable des battements cardiaques et rôle de l’ankyrine B. A.L’activité électrique se propage le long du cœur à partir du nœud sinusal (le terme pacemaker indique la fonction initiatrice du rythme cardiaque par le nœud sinusal) (OD : oreillette droite ; OG : oreillette gauche ; VD : ventricule droit ; VG ; ventricule gauche ; AV : auriculo-ventriculaire). B. Potentiel d’action classique dans les cellules musculaires du cœur. Les mécanismes ou structures présentant un dysfonctionnement chez les souris porteuses d’une seule copie fonctionnelle du gène codant pour l’ankyrine B (ankyrine B+/-) ou chez les sujets atteints du syndrome du QT long de type 4 (LQT4) (ayant une mutation du gène codant pour l’ankyrine B [ 1]) sont indiqués dans les encadrés orange. La conduction électrique est ainsi défectueuse chez la souris ankyrine+/-, alors qu’elle ne l’est pas chez l’humain atteint de LQT4. Par ailleurs, la repolarisation est anormale chez l’humain présentant un LQT4, mais normale chez les souris ankyrine+/-. Les troubles de la dépolarisation peuvent être observés lors d’un déséquilibre des courants sortant et entrant au niveau des phases 2 et 3 (le plateau et la repolarisation rapide) du potentiel d’action. Cela entraîne une augmentation de la durée du potentiel d’action et une susceptibilité aux postdépolarisations précoces (EAD). Une surcharge en Ca 2+
intracellulaire peut, quant à elle, entraîner une augmentation du fonctionnement de l’échangeur Na +/Ca 2+
, entraînant une entrée excessive de Na + et des postdépolarisations retardées (DAD). C. Mécanismes et molécules impliqués dans la formation de la protéine transporteur ionique fonctionnelle (en rose). La protéine transporteur ionique est insérée dans la membrane cellulaire grâce à l’ankyrine B. Des mutations du gène codant pour le transporteur ionique, des anomalies dans le ciblage protéique vers la membrane et des dysfonctionnements de l’ankyrine B (encadrés jaunes) peuvent tous mener à des arythmies cardiaques et à une mort subite. |
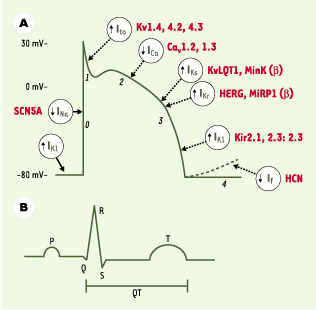
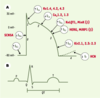 | Figure 2.
Relation entre un potentiel d’action cardiaque, avec ses courants sous-jacents (A), et un électrocardiogramme (B). Lors de la phase 0 du potentiel d’action, les canaux sodiques se trouvent dans une configuration ouverte, laissant les ions Na
+
entrer dans la cellule : c’est la phase de dépolarisation. Une phase rapide de repolarisation s’ensuit (phase 1), liée à l’ouverture transitoire de courants K
+
(Ito). La phase 2 est caractérisée par un plateau reflétant l’équilibre entre courants entrants (ICa) et courants sortants (IK) (avec leurs composantes rapide IKr et lente IKs). L’inactivation des courants Ca2
+
(ICa) permet au courant K
+
sortant (IK) de repolariser la cellule (phase 3). La phase finale de repolarisation est assurée par la sortie d’ions K
+
due au courant à rectification rentrante (IK1). Certaines cellules, comme celles du nœud sinusal ou du nœud auriculoventriculaire, montrent une phase de dépolarisation lente due au courant pacemaker If. Les sous-unités protéiques impliquées dans les canaux portant chacun des courants sont indiquées en rouge. SCNA5 : gène codant pour la sous-unité α du canal sodique ; Kv : voltage-gated potassium channel ; Kv1.4 (famille Shaker, sous-famille 4), Kv4.2 (famille Shal, sous-famille 2) et Kv4.3 (famille Shal, sous famille 3) ; KvLQT1, Kv (voltage-gated potassium channel) LQT1 (long QT1) ; MinK : minimal potassium channel ; HERG : human ether-a-go-go-related gene ; MiRP1 : MinK related peptide 1 ; Kir : inward rectifier potassium channel ; Kir2.1/2.2/2.3 (famille 2, sous-familles 1, 2, 3) ; HCN : hyperpolarization-activated cyclic nucleotide-gated channel.
|
Le processus de repolarisation est le résultat d’un équilibre fragile entre les courants ioniques entrants, ions Na+ ou Ca2+
entrant dans la cellule afin de la dépolariser, et les courants ioniques K+ sortants, qui repolarisent la cellule jusqu’à son niveau de repos initial, et dont les deux courants les plus importants sont les composantes rapide (IKr) et lente (IKs) du courant delayed rectifier IK (Figure 2A). Le moindre déséquilibre entre les courants entrants et sortants perturbe le phénomène de repolarisation cellulaire, et le cœur devient alors plus susceptible au développement d’arythmies cardiaques. Cela explique pourquoi des mutations dans les gènes codant pour les divers canaux impliqués dans la repolarisation (Figure 2A) sont sources d’arythmies et peuvent conduire au syndrome de mort subite (Figure 1A et 1B). L’intervalle QT relevé sur un électrocardiogramme correspond au temps nécessaire à la repolarisation ventriculaire, et représente donc la durée du potentiel d’action cardiaque (Figure 2B). Par conséquent, une augmentation du segment QT signe une anomalie au niveau de la repolarisation cardiaque, qui peut aller jusqu’à provoquer des arythmies létales appelées « torsades de pointes » [
2]. |
Le syndrome du QT long de type 4 est associé à une mutation du gène codant pour l’ankyrine B P.J. Mohler et al. se sont appliqués à identifier les fondements moléculaires du syndrome du QT long (LQT) de type 4 (LQT4). Jusque-là, tous les syndromes du QT long provenaient soit d’une perte de fonction des canaux K+, soit au contraire d’un gain de fonction des canaux Na+, provoquant une réduction du courant net sortant. Le retard à la repolarisation qui s’ensuit peut être à l’origine d’arythmies potentiellement létales. Le LQT de type 4 a été décrit dans une famille française par J.J. Schott et al. [
3]. Cette forme du syndrome, outre le fait de provoquer le prolongement du segment QT, affecte aussi le fonctionnement du nœud sinusal. P.J. Mohler et al. ont démontré que les patients atteints du LQT4 avaient une mutation spécifique du gène codant pour l’ankyrine B. Cette mutation concerne le résidu acide glutamique en position 1425, remplacé par un résidu glycine (E1425G) [1]. L’ankyrine B est un complexe protéique composé de 22 répétitions d’une séquence de 33 acides aminés appelée ANK. Cette séquence particulière est impliquée dans la reconnaissance de nombreuses protéines [
4,
5], notamment celles qui interviennent dans les phénomènes d’homéostasie ionique cardiaque : sous-unité α du canal Na+, pompe Na+,K+-ATPase (maintenant le gradient d’ions Na+ et K+), échangeur Na+/Ca2+
et le canal récepteur de la ryanodine, responsable de la libération de Ca2+
à partir du réticulum sarcoplasmique. Des souris hétérozygotes invalidées pour un seul des allèles codant pour l’ankyrine B ont un phénotype similaire à celui observé chez les sujets atteints du LQT4. La transfection du gène fonctionnel codant pour l’ankyrine B dans les cellules de ces souris nouveau-nées rétablit un phénotype normal, alors que la transfection du mutant E1425G n’a aucun effet, indiquant une perte de fonction. |
Quels sont les mécanismes altérés par une mutation du gène codant pour l’ankyrine B ? Après avoir établi le fondement moléculaire du LQT4, P.J. Mohler et al. ont cherché à élucider le lien entre le génotype étudié et le phénotype observé. La mutation du gène codant pour l’ankyrine B provoque une désorganisation cellulaire de la pompe Na
+
,K
+
-ATPase et de l’échangeur Na
+
/Ca
2+
. Les souris transgéniques ankyrine
B
+/-
montrent certaines anomalies de la fonction du nœud sinusal et une vitesse de conduction ralentie, mais la repolarisation des myocytes n’est pas affectée (Figure 1). La concentration intracellulaire de Ca2+
est augmentée, et l’on observe des troubles de la dépolarisation de type EAD (early after depolarisations, ou postdépolarisations précoces) ou DAD (delayed after depolarisations, ou postdépolarisations retardées), ainsi que l’apparition d’extrasystoles (Figure 2B). Si l’étude de P.J. Mohler et al. répond à plusieurs questions, elle en soulève également d’autres. Ainsi, les auteurs attribuent le phénotype observé à une accumulation intracellulaire de Ca
2+
liée à une déficience de la pompe Na
+
,K
+
-ATPase (en raison d’une mutation du gène codant pour l’ankyrine B), la pompe Na
+
/K
+
-ATPase étant normalement responsable de l’échange d’ions Na
+
(exclus de la cellule) par des ions K+ (entrant dans la cellule). Un dysfonctionnement de cette pompe, produit par exemple par la digitaline, provoque en effet une accumulation intracellulaire d’ions Na+, qui a pour conséquence d’augmenter le fonctionnement de l’échangeur Na+/Ca2+
. Or l’augmentation de Ca2+
intracellulaire étant susceptible de provoquer des conditions arythmiques [
6], une telle augmentation liée à un dysfonctionnement de la pompe Na+,K+-ATPase pourrait expliquer les phénomènes d’arythmies enregistrés dans le syndrome du QT long. Cependant, le pouvoir arythmique d’une accumulation de Ca2+
intracellulaire n’est pas lié à un prolongement de la repolarisation, et les arythmies dues à une intoxication par la digitaline ne sont pas associées à une prolongation de l’intervalle QT. Par ailleurs, le ralentissement de la vitesse de conduction de l’impulsion électrique observée chez les souris ankyrine B−/−
ne peut être attribuée simplement à des anomalies liées à la concentration intracellulaire de Ca2+
. D’où la possibilité que l’arythmie observée dans le syndrome du QT long 4 soit liée à un dysfonctionnement des canaux Na+. En effet, les myocytes cardiaques prélevés chez des souris nouveau-nées ankyrine B−/− montrent des courants Na+ anormaux, dont la densité est diminuée et l’inactivation altérée [
8] ; les souris ankyrine B+/- présentent elles aussi ces caractéristiques, avec toutefois une sévérité moindre. Des mutations humaines du gène codant pour la sous-unité α du canal sodique sont également responsables d’un ralentissement de la conduction, d’un dysfonctionnement du nœud sinusal et d’une altération de la repolarisation [
9]. Même si les souris ankyrine B+/-
ne montrent de modifications ni de la concentration, ni de la distribution [1] des canaux Na+, il est possible que leurs propriétés fonctionnelles soient, elles, affectées. De plus, il ne faut pas exclure le fait qu’une déficience du gène codant pour l’ankyrine B affecte d’autres canaux impliqués dans la repolarisation des cellules cardiaques. |
L’étude de P.J. Mohler et al. est importante car elle met en évidence de nouvelles causes génétiques responsables du phénomène de mort subite et démontre l’importance des protéines d’ancrage membranaire pour assurer la fonction d’autres protéines, et notamment des transporteurs ioniques. Toutes les études décrivant les syndromes génétiques de mort subite avaient jusqu’alors rapporté des mutations affectant directement des protéines impliquées dans l’homéostasie ionique, pour la plupart des canaux ioniques. Ce travail est donc le premier à attribuer à une protéine impliquée dans l’organisation cellulaire des transporteurs ioniques (Figure 1C) la responsabilité d’un syndrome de mort subite. De plus en plus de résultats suggèrent que les protéines membranaires ne sont pas insérées au hasard, mais requièrent au contraire un environnement bien particulier, et les résultats présentés par P.J. Mohler et al. montrent combien cette organisation cellulaire est importante. Même si les auteurs traitent en premier lieu d’un phénotype typiquement cardiaque, il est raisonnable de penser que des mutations du gène codant pour l’ankyrine B, en raison de l’expression ubiquitaire de cette protéine, pourrait être impliquées dans des maladies génétiques non cardiaques. |
1. Mohler PJ, Schott JJ, Gramolini AO, et al. Ankyrin-B mutation causes type 4 long-QT cardiac arrhythmia and sudden cardiac death. Nature 2003; 421 : 634–9. 2. Dessertenne F. La tachycardie ventriculaire à deux foyers opposés variable. Arch Mal Cœur 1966; 59 : 263–72. 3. Schott JJ, Charpentier F, Peltier S, et al. Mapping of a gene for long QT syndrome to chromosome 4q25-27. Am J Hum Genet 1995; 57 : 1114–22. 4. Mohler PJ, Gramolini AO, Bennett V. Ankyrins. J Cell Sci 2002; 11 : 1565–6. 5. Bennett V, Baines AJ. Spectrin and ankyrin-based pathways : metazoan inventions for integrating cells into tissues. Physiol Rev 2001; 81 : 1353–92. 6. Nattel S, Khairy P, Schram G. Arrhythmogenic ionic remodelling : adaptive responses with maladaptive consequences. Trends Cardiovasc Med 2001; 11 : 295–301. 7. Anderson ME. Calmodulin and the philosopher’s stone : changing Ca2+
into arrhythmias. J Cardiovasc Electrophysiol 2002; 13 : 195–7. 8. Chauhan VS, Tuvia S, Buhusi M, et al. Abnormal cardiac Na+ channel properties and QT heart rate adaptation in neonatal ankyrin-B knockout mice. Circ Res 2000; 86 : 441–7. 9. Van den Berg MP, Wilde AA, Viersma TJW, et al. Possible bradycardic mode of death and successful pacemaker treatment in a large family with features of long QT syndrome type 3 and Brugada syndrome. J Cardiovasc Electrophysiol 2001; 12 : 630–6. |