| |
| Med Sci (Paris). 2004 June; 20(6-7): 669–673. Published online 2004 June 15. doi: 10.1051/medsci/2004206-7669.Localisation des ARN dans le cytoplasme Eugenia Basyuk,1 Brigitte Lavoie,2 Rémy Bordonné,1 and Édouard Bertrand1* 1IGMM-CNRS UMR 5535, Université Montpellier II, IFR 122, 1919, route de Mende, 34293 Montpellier Cedex 5, France 2Molecular plasticity section, National Institute of Neurological Disorders and Stroke, 36 Convent Dr, MSC 4066, Bethesda, MD 20892, États-Unis |
Un certain nombre d’embryons développent leurs axes de polarité antéropostérieur, dorsoventral et médiolatéral grâce à des déterminants d’origine maternelle [
1]. Grâce aux études menées chez l’ascidie et la drosophile, on a très tôt réalisé que certains de ces déterminants étaient en fait de l’ARN et étaient localisés dans des régions précises de l’œuf [1–
3]. On connaît actuellement de nombreux ARN localisés, et cela dans la plupart des organismes modèles étudiés : levure, plantes, ascidie, drosophile, poisson-zèbre, xénope, poulet et mammifères [3]. |
Rôle de la localisation des ARN Dans la plupart des cas, les ARN localisés sont codants, leur localisation permettant alors une synthèse locale de protéine [
4]. Toutefois, et bien que ce soit exceptionel, il s’agit parfois d’ARN non codants, comme par exemple ceux que l’on retrouve dans le plasme polaire de nombreux embryons [
5,
6]. Il a été proposé que ces ARN non codants contrôlent l’expression d’ARNm, mais il est également possible qu’ils jouent un rôle structural, en permettant l’assemblage de structures cellulaires impliquées dans la polarité cellulaire, telles que le plasme polaire. Les ARNm codants et localisés sont nombreux et, suivant le type de protéines pour lesquels ils codent, sont impliqués dans des processus cellulaires variés. Division cellulaire asymétrique Il s’agit de la situation où une seule des deux cellules-filles hérite de l’ARN localisé et adopte de ce fait un destin différent. On peut citer les ARNm Ash1 dans la levure [
7] et prospero chez la drosophile [
8]. Une application spécialisée de la division asymétrique est représentée par le cas des ARNm localisés dans les œufs ou les embryons précoces, les plus connus étant bicoid, oskar et nanos chez la drosophile, Vg1 chez le xénope et macho chez l’ascidie [ 1, 3]. Ces ARNm codent pour des déterminants du devenir cellulaire en agissant sur la transcription et la traduction, ou encore comme facteurs sécrétés. Signalisation intercellulaire Dans le blastocyste cellularisé de la drosophile, les cellules forment une monocouche entourant le vitellus et sont polarisées selon un axe apical-basal. De nombreux ARNm sont localisés à l’un des pôles de ces cellules [
9]. Par exemple, les ARNm codant pour wingless, un morphogène sécrété de la famille de Wnt, sont localisés au pôle apical et cette localisation est essentielle pour la signalisation induite par wingless [
10]. Wingless étant une protéine sécrétée qui transite par le réticulum endoplasmique et l’appareil de Golgi, il est possible que la localisation de l’ARNm soit nécessaire pour que la protéine entre dans un domaine particulier du réticulum endoplasmique, afin d’assurer un ciblage préférentiel de la protéine vers les vésicules sécrétoires du pôle apical [ 10]. Contrôle de la fonction synaptique Les compartiments postsynaptiques contiennent des ARNm qui peuvent être traduits localement [
11,
12]. Dans certains systèmes, cette traduction est requise pour l’établissement de formes particulières de modifications de l’activité synaptique, comme la potentialisation à long terme (LTP) [
13]. Un cas particulièrement intéressant est celui de l’ARNm codant pour la kinase dépendante de la calmoduline de type IIalpha [
14], puisque son transport est activé par la dépolarisation des neurones et qu’il code pour une protéine importante dans la LTP. Un second modèle très intéressant est celui de l’ARNm du gène Arc, qui code pour une protéine attachée au cytosquelette neural (Arc, activity-regulated cytoskeleton-associated protein) : in vivo, lorsqu’une stimulation localisée est appliquée aux neurones, l’ARNm d’Arc se localise à proximité de la région dendritique activée et y est traduit [ 11, 12]. Apport direct de polypeptides sur leur lieu de fonction Ce mécanisme peut être nécessaire lorsque les protéines traduites sont très toxiques, comme c’est le cas pour la protéine de myéline basique (MBP), un composant essentiel de la gaine de myéline des oligodendrocytes [
15]. Une traduction localisée est également fréquemment requise pour les protéines membranaires ou sécrétées, car le passage de la membrane est un événement cotraductionnel intervenant au niveau du réticulum endoplasmique [
16]. Dans ce cas, la localisation de ces ARN est principalement due au SRP (signal recognition particle). Le même concept s’applique également aux ARNm codant pour des protéines mitochondriales [
17]. Un dernier exemple concerne c-myc, dont l’ARNm et la protéine ont tous deux des demi-vies très courtes. Cet ARNm est localisé sur le cytosquelette périnucléaire grâce à un signal porté par sa région 3’ non traduite, et il a été proposé que cette localisation facilite le ciblage de la protéine vers le noyau [
18]. Cycle cellulaire Dans l’embryon précoce de xénope, les ARNm codant pour la cycline B1, une cycline mitotique, sont localisés sur le fuseau mitotique et y sont directement traduits [
19]. Cette traduction locale semble essentielle à la fonction de la cycline B1, puisque la délocalisation de son ARNm induit des défauts dans le déroulement du cycle cellulaire. |
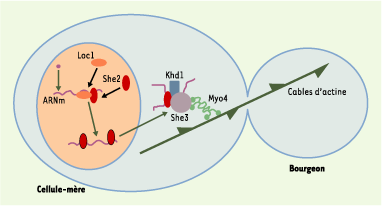
Mécanismes de localisation de l’ARNm Ash1 La levure de boulanger S. cerevisiae est un exemple remarquable de division asymétrique. Les deux cellules issues d’une division diffèrent par de nombreux aspects, et notamment par leur capacité à changer de type sexuel [
20]. Lors d’une mitose, la cellule-mère peut changer de type sexuel, mais la cellule-fille doit réaliser un cycle de division et devenir une cellule-mère à son tour pour pouvoir en changer [20]. Ce mécanisme permet d’assurer qu’une population de levure contient des niveaux similaires des deux types sexuels afin de rendre toujours possible une fécondation. Le changement de type sexuel se fait par l’excision d’un fragment d’ADN dans le locus Mat, par l’endonucléase HO, suivie de la réparation de la lésion par remplacement à partir d’une des deux copies inactives, de type a ou alpha, présentes dans le génome. L’endonucléase HO est exprimée uniquement par la cellule-mère, le noyau de la cellule-fille contenant un répresseur transcriptionnel du gène HO, la protéine Ash1. Le gène codant pour la protéine Ash1 n’est exprimé que pendant une courte période, en anaphase, et son ARNm est localisé dans une zone corticale située à l’extrémité du bourgeon [7] (Figure 1). La localisation de l’ARNm est dépendante du cytosquelette d’actine et nécessite l’action de plusieurs gènes, dont les mieux caractérisés sont les gènes SHE. Comme SHE1/Myo4 code pour une myosine, il avait été proposé que l’ARNm Ash1 soit transporté par cette myosine sur les microfilaments d’actine jusqu’aux sites d’ancrage dans le cortex du bourgeon [7]. Effectivement, l’analyse du mouvement des ARNm par vidéomicroscopie dans les cellules vivantes a apporté une démonstration directe de cette hypothèse [
21]. Ces expériences ont également montré l’existence d’agrégats macromoléculaires, encore appelés granules, contenant de nombreuses copies de l’ARNm Ash1. De manière intéressante, la formation de ces granules est corrélée à la capacité de cet ARNm à être transporté. Ainsi, les agrégats ne s’assemblent pas dans des mutants de She2 et She3 incapables de localiser l’ARNm [21]. Les protéines She2 et She3 sont concentrées dans les granules [21–
23] : la protéine She2 interagit spécifiquement avec l’ARNm et est requise pour que She3 soit recrutée dans les granules [
22, 23]. La myosine She1/Myo4 se lie ensuite aux granules par l’intermédiaire d’une interaction directe avec She3 [21, 22,
24]. De manière remarquable, la myosine She1/Myo4 est incapable de se localiser dans le bourgeon en l’absence de granules d’ARNm Ash1 [
25]. Ainsi, dans les mutants de She2, où lorsque l’export nucléaire des ARNm est bloqué, les granules ne s’assemblent pas et la myosine reste dans le cytoplasme de la cellule-mère. Bien que le mécanisme moléculaire sous-jacent ne soit pas clair, il évite néanmoins que la myosine ne soit déjà dans le bourgeon alors que l’ARNm arrive à peine dans le cytoplasme de la cellule-mère.  | Figure 1. Mécanisme de la localisation de l’ARNm Ash1 dans la levure S. cerevisiae. L’ARNm s’associe dans le noyau avec Loc1 et She2. Dans le cytoplasme, il se lie à She3 et à la myosine She1/Myo4 afin d’être transporté vers le bourgeon via les cables d’actines. Par souci de simplification, la levure est représentée à un stade du cycle cellulaire plus précoce que celui où l’ARN est normalement exprimé (c’est-à-dire en anaphase). |
Le rôle des événements nucléaires dans la localisation de l’ARNm Ash1 est également remarquable. Un crible destiné à sélectionner des protéines interagissant avec la séquence de localisation a mis en évidence une protéine, Loc1 [
26], qui se lie avec l’ARN Ash1 in vitro et in vivo, et qui est requise pour le localiser. De manière surprenante, cette protéine est strictement nucléaire, et ne fait pas la navette entre le noyau et le cytoplasme [26]. Son association avec l’ARNm dans le noyau est donc vraisemblablement requise pour que celui-ci soit compétent pour se localiser dans le cytoplasme. La protéine She2 est présente à la fois dans le noyau et le cytoplasme, et pourrait ainsi s’associer avec l’ARNm Ash1 dès sa transcription dans le noyau, peut-être grâce à Loc1 [25]. Il existe probablement deux raisons au moins à ce pré-assemblage nucléaire. La première est une contrainte cinétique : l’ARNm n’étant exprimé que pendant un court moment, lors de l’anaphase, il dispose de peu de temps pour être transporté. Le pré-assemblage nucléaire permettrait alors son incorporation accélérée dans les granules. La deuxième est une contrainte liée à la traduction : il est en effet très important pour la cellule que l’ARNm Ash1 ne soit pas traduit lors de son arrivée dans le cytoplasme, car cela entraînerait l’expression de la protéine Ash1 (et donc la répression de l’endonucléase HO) dans la cellule-mère. Si l’ARNm Ash1 n’était pas marqué par son association avec des protéines spécifiques dès sa synthèse dans le noyau, il y aurait une compétition entre sa traduction et son transport. En accord avec cette idée, on sait que trois des quatre séquences de localisation de l’ARNm Ash1 sont présentes à l’intérieur de la phase codante de l’ARNm [
27], la quatrième chevauchant les derniers codons. L’assemblage du complexe de localisation sur les séquences codantes de l’ARNm bloque sa traduction, tandis que le déplacement de ces séquences vers les régions 3’ non traduites entraîne, à l’inverse, une délocalisation de l’ARN et sa traduction prématurée dans la cellule-mère [
28]. Un des effecteurs de la régulation traductionnelle d’Ash1 est la protéine Khd1, qui possède des domaines de liaison à l’ARN de type KH (K homology domain), et qui se lie aux séquences de localisation présentes dans la phase codante de l’ARNm Ash1 [
29]. Une question majeure, non résolue pour l’instant, est le mécanisme qui active la traduction de l’ARNm lorsqu’il atteint sa destination finale. Il est probable que les complexes ribonucléoprotéiques soient remodelés lorsqu’ils arrivent dans le bourgeon, afin de permettre la traduction de l’ARNm et son accrochage permanent sur le cortex [29]. |
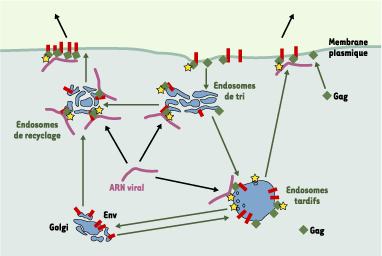
Un exemple atypique de transport et de localisation des ARN est celui des ARN génomiques des rétrovirus. En effet, ces ARN doivent être transportés vers la membrane plasmique pour être encapsidés dans la particule virale en formation. De plus, les rétrovirus quittent les cellules polarisées (comme les cellules épithéliales) par leur pôle basolatéral [
30] : l’ARN doit donc être spécifiquement ciblé vers ce côté de la cellule. Un travail récent a analysé ce phénomène en utilisant une méthode de détection de molécules uniques d’ARNm dans les cellules vivantes [
31] : dans des cellules d’encapsidation ou chroniquement infectées, les ARN génomiques du virus de la leucémie murine (MLV) sont transportés par des vésicules endosomiques. Ce transport est dépendant des protéines virales Gag et Env, elles-mêmes transportées à la surface des vésicules endosomales (Figure 2). Env est une protéine transmembranaire qui circule au niveau des membranes intracellulaires, notamment endosomales, grâce à des signaux de routage présents dans sa partie cytoplasmique. Gag est quant à elle une protéine myristoylée se liant aux membranes, ainsi qu’à l’ARN rétroviral grâce à un domaine à doigt de zinc [
32,
33]. Gag est également ciblée vers des compartiments endosomaux, notamment grâce à des signaux de mono-ubiquitinylation. Elle est ainsi principalement présente dans les endosomes tardifs [31] mais, en présence d’enveloppe, se redistribue à la surface des endosomes précoces et de recyclage. Le mécanisme mis en jeu n’est pas connu, mais il fait vraisemblablement intervenir une interaction, directe ou non, avec la partie cytoplasmique de la protéine Env. L’ensemble de ces données suggère qu’Env et Gag servent de protéines adaptatrices pour arrimer l’ARN à un système de transport vésiculaire endosomique et le diriger ainsi vers des sites spécifiques de la membrane plasmique [31].  | Figure 2. Ciblage des ARN rétroviraux murins vers la membrane plasmique. Des complexes entre les protéines Gag et Env se forment au niveau des vésicules endosomales et y recrutent l’ARN viral. Les complexes sont ensuite ciblés vers la membrane plasmique par l’intermédiaire du trafic vésiculaire. La voie de sortie est influencée par des signaux de routage présents sur la protéine Env. Le virus utilise la machinerie cellulaire (matérialisée par les étoiles) des corps multivésiculaires pour sortir des cellules. |
Pour le virus, cet assemblage sur les membranes endosomales peut être déterminant pour trois raisons. Tout d’abord, il permet probablement de transporter les gros ARN que sont les ARN viraux génomiques de manière efficace. Ensuite, il permet de diriger les complexes viraux en cours d’assemblage vers les sites appropriés de la membrane plasmique, grâce aux signaux de routage présents sur l’enveloppe. Cet événement est vraisemblablement essentiel car la propagation du virus in vivo fait souvent intervenir des contacts cellule-cellule au cours desquels celles-ci se polarisent de manière transitoire [
34]. Enfin, les rétrovirus utilisent pour bourgeonner hors des cellules une machinerie cellulaire [
35] qui fonctionne dans les compartiments endosomiques tardifs, au niveau desquels transitent les complexes viraux en cours d’assemblage [31]. Les rétrovirus sont ainsi des parasites du système endosomique. |
De manière très intéressante, le paradigme du transport des ARN rétroviraux par des membranes ou des vésicules a probablement une contrepartie cellulaire. Il a ainsi été montré dans l’oocyte de xénope que l’ARNm Vg1, localisé au pôle végétatif, y est transporté en association avec une région spécialisée du réticulum endoplasmique [
36]. De même, dans les œufs d’ascidies, de nombreux ARN sont localisés au pôle végétatif en association avec le réticulum cortical [1]. De manière peut-être plus frappante encore, la localisation de l’ARNm oskar au pôle postérieur de l’œuf de drosophile est dépendante d’un compartiment endosomal particulier et organisée par la petite GTPase Rab11 [
37,
38]. Enfin, l’association des ARNm avec les membranes intracellulaires ne se limite pas aux seuls cas des ARN localisés ; dans toutes les cellules, de nombreux ARNm, codant ou non pour des protéines sécrétées, sont associés au réticulum endoplasmique. Ainsi, il existe dans le cytoplasme de nombreux liens entre la circulation des ARN et celle des protéines, et le paradigme décrit pour les rétrovirus pourrait être d’une application plus générale. |
1. Prodon F, Prulière G, Chenevert J, Sardet C. Établissement et expression des axes embryonnaires : comparaison entre différents organismes modèles. Med Sci (Paris) 2004; 20 : 526–38. 2. Jeffery W, Tomlinson C, Brodeur R. Localization of actin messenger RNA during early ascidian development. Dev Biol 1983; 99 : 408–17. 3. Bashirullah A, Cooperstock RL, Lipshitz HD. RNA localization in development. Annu Rev Biochem 1998; 67 : 335–94. 4. Driever W, Nusslein-Volhard C. A gradient of bicoid protein in Drosophila embryos. Cell 1988; 54 : 83–93. 5. Nakamura A, Amikura R, Mukai M, et al. Requirement for a noncoding RNA in Drosophila polar granules for germ cell establishment. Science 1996; 274 : 2075–9. 6. Kobayashi S, Amikura R, Okada M. Presence of mitochondrial large ribosomal RNA outside mitochondria in germ plasm of Drosophila melanogaster. Science 1993; 260 : 1521–4. 7. Long R, Singer R, Meng X, et al. Mating type switching in yeast controlled by asymmetric localization of ASH1 mRNA. Science 1997; 277 : 383–7. 8. Li P, Yang X, Wasser M, et al. Inscuteable and Staufen mediate asymmetric localization and segregation of prospero RNA during Drosophila neuroblast cell divisions. Cell 1997; 90 : 437–47. 9. Davis I, Ish-Horowicz D. Apical localization of pair-rule transcripts requires 3’ sequences and limits protein diffusion in the Drosophila blastoderm embryo. Cell 1991; 67 : 927–40. 10. Simmonds A, dosSantos G. Livne-Bar I, Krause H. Apical localization of wingless transcripts is required for wingless signaling. Cell 2001; 105 : 197–207. 11. Richter J, Lorenz L. Selective translation of mRNAs at synapses. Curr Opin Neurobiol 2002; 12 : 300–4. 12. Steward O, Schuman E. Protein synthesis at synaptic sites on dendrites. Annu Rev Neurosci 2001; 24 : 299–325. 13. Casadio A, Martin K, Giustetto M, et al. A transient, neuron-wide form of CREB-mediated long-term facilitation can be stabilized at specific synapses by local protein synthesis. Cell 1999; 99 : 221–37. 14. Rook M, Lu M, Kosik K. CaMKIIalpha 3’ untranslated region-directed mRNA translocation in living neurons : Visualization by GFP linkage. J Neurosci 2000; 20 : 6385–93. 15. Carson J, Cui H, Krueger W, et al. RNA trafficking in oligodendrocytes. Results Probl Cell Differ 2001; 34 : 69–81. 16. Keenan R, Freymann D, Stroud R, Walter P. The signal recognition particle. Annu Rev Biochem 2001; 70 : 755–75. 17. Corral-Debrinski M, Blugeon C, Jacq C. In yeast, the 3’ untranslated region or the presequence of ATM1 is required for the exclusive localization of its mRNA to the vicinity of mitochondria. Mol Cell Biol 2000; 20 : 7881–92. 18. Hesketh J, Campbell G, Piechaczyk M, Blanchard J. Targeting of c-myc and beta-globin coding sequences to cytoskeletal-bound polysomes by c-myc 3’ untranslated region. Biochem J 1994; 298 : 143–8. 19. Groisman I, Huang Y, Mendez R, et al. CPEB, maskin, and cyclin B1 mRNA at the mitotic apparatus : Implications for local translational control of cell division. Cell 2000; 103 : 435–47. 20. Haber J. Mating-type gene switching in Saccharomyces cerevisiae. Annu Rev Genet. 1998; 32 : 561–99. 21. Bertrand E, Chartrand P, Schaefer M, et al. Localization of ASH1 mRNA particles in living yeast. Mol Cell 1998; 2 : 437–45. 22. Bohl F, Kruse C, Frank A, et al. She2p, a novel RNA-binding protein tethers ASH1 mRNA to the Myo4p myosin motor via She3p. EMBO J 2000; 19 : 5514–24. 23. Long R, Gu W, Lorimer E, Singer R, Chartrand P. She2p is a novel RNA-binding protein that recruits the Myo4p-She3p complex to ASH1 mRNA. EMBO J 2000; 19 : 6592–601. 24. Takizawa P, Vale R. The myosin motor, Myo4p, binds Ash1 mRNA via the adapter protein, She3p. Proc Natl Acad Sci USA 2000; 97 : 5273–8. 25. Kruse C, Jaedicke A, Beaudouin J, et al. Ribonucleoprotein-dependent localization of the yeast class V myosin Myo4p. J Cell Biol 2002; 159 : 971–82. 26. Long R, Gu W, Meng X, et al. An exclusively nuclear RNA-binding protein affects asymmetric localization of ASH1 mRNA and Ash1p in yeast. J Cell Biol 2001; 153 : 307–18. 27. Chartrand P, Meng X, Singer R, Long R. Structural elements required for the localization of ASH1 mRNA and of a green fluorescent protein reporter particle in vivo. Curr Biol 1999; 9 : 333–6. 28. Chartrand P, Meng X, Huttelmaier S, et al. Asymmetric sorting of Ash1p in yeast results from inhibition of translation by localization elements in the mRNA. Mol Cell 2002; 10 : 1319–30. 29. Irie K, Tadauchi T, Takizawa P, et al. The Khd1 protein, which has three KH RNA-binding motifs, is required for proper localization of ASH1 mRNA in yeast. EMBO J 2002; 21 : 1158–67. 30. Roth M, Srinivas R, Compans R. Basolateral maturation of retroviruses in polarized epithelial cells. J Virol 1983; 45 : 1065–73. 31. Basyuk E, Galli T, Mougel M, et al. Retroviral genomic RNAs are transported to the plasma membrane by endosomal vesicles. Dev Cell 2003; 5 : 161–74. 32. .Freed EO. HIV-1 gag proteins : Diverse functions in the virus life cycle. Virology 1998; 251 : 1–15. 33. Garoff H, Hewson R, Opstelten D. Virus maturation by budding. Microbiol Mol Biol Rev 1998; 62 : 1171–90. 34. Perotti M, Tan X, Phillips D. Directional budding of human immunodeficiency virus from monocytes. J Virol 1996; 70 : 5916–21. 35. Garrus J, von Schwedler U, Pornillos O, et al. Tsg101 and the vacuolar protein sorting pathway are essential for HIV-1 budding. Cell 2001; 107 : 55–65. 36. Deshler J, Highett M, Schnapp B. Localization of Xenopus Vg1 mRNA by Vera protein and the endoplasmic reticulum. Science 1997; 276 : 1128–31. 37. Dollar G, Struckhoff E, Michaud J, Cohen R. Rab11 polarization of the Drosophila oocyte : A novel link between membrane trafficking, microtubule organization, and oskar mRNA localization and translation. Development 2002; 129 : 517–26. 38. Jankovics F, Sinka R, Erdelyi M. An interaction type of genetic screen reveals a role of the Rab11 gene in oskar mRNA localization in the developing Drosophila melanogaster oocyte. Genetics 2001; 158 : 1177–88. |