1.
Reichel E, Berrocal A, Ip M, et al. Transpupillary thermotherapy of occult subfoveal choroidal neovascularization in patients with age-related macular degeneration. Ophthalmology 1999; 106 : 1908–14.
2.
Schmidt-Refurth U, Miller J, Sickenberg M, et al. Photodynamic therapy with verteprofin for choroidal neovascularization cauzed by age-related macular degeneration. Arch Ophthalmol 1999; 117 : 1177–87.
3.
Hauswirth WW, Lewin AS. Ribozyme uses in retinal gene therapy. Prog Retin Eye Res 2000; 19 : 689–710.
4.
Acland GM, Aguire GD, Ray J, et al. Gene therapy restores vision in a canine model of childhood blindness. Nat Genet 2001; 28 : 92–5.
5.
Liang FQ, Dejneka NS, Cohen DR, et al. Aav-mediated delivery of ciliary neurotrophic factor prolongs photoreceptor survival in the rhodopsin knockout mouse. Mol Ther 2001; 3 : 241–8.
6.
Ferrara N, Alitalo K. Clinical applications of angiogenic growth factors and their inhibitors. Nature Med 1999; 5 : 1359–64.
7.
Nir I, Kedzierski W, Chen J, Travis GH. Expression of Bcl-2 protects against photoreceptor degeneration in retinal degeneration slow (rds) mice. J Neurosci 2000; 15 : 2150–4.
8.
Frasson M, Sahel JA, Fabre M, et al. Retinitis pigmentosa : Rod photoreceptor rescue by a calcium-channel blocker in the rd mouse. Nature Med 1999; 5 : 1183–7.
9.
Maurice D, Mishima S. Ocular pharmacokinetics in ML. In : Sears ML, ed. Pharmacology of the eye. Berlin : Springer-Verlag, 1984 : 19–116.
10.
Tojo K, Isowaki A. Pharmacokinetic model for in vivo/in vitro correlation of intravitreal drug delivery. Advanced Drug Delivery Rev 2001; 52 : 17–24.
11.
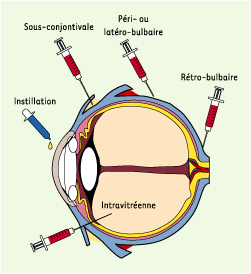
Weijtens O, van der Sluijs FA, Schoemaker RC, et al. Peribulbar corticosteroids injection : Vitreal and serum concentrations after dexamethasone disodium phosphate injection. Am J Ophthalmol 1997; 123 : 358–63.
12.
Bodker FS, Ticho BH, Feist RM, Lam TT. Intraocular dexamethasone penetration via subconjunctival or retrobulbar injections in rabbits. Ophthalmic Surg 1993; 24 : 453–7.
13.
Blair NP, Evans MA, Lesar TS, Zeimer RC. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Invest Ophthalmol Vis Sci 1986; 27 : 1107–14.
14.
Araie M, Maurice DM. The loss of fluorescein, fluorescein glucuronide and fluorescein isothiocyanate dextran from the vitreous by the anterior and retinal pathways. Exp Eye Res 1991; 52 : 27–39.
15.
Martin DF, Parks DJ, Mellow SD, et al. Treatment of CMV retinitis with an intraocular sustained-release ganciclovir implant : A randomized controlled clinical trial. Arch Ophthalmol 1994; 112 : 1531–9.
16.
Jaffe G, Ben-Nun J, Guo H, et al. Fluocinolone acetonide sustained drug delivery device to treat severe uveitis. Ophthalmology 2000; 11 : 2024–33.
17.
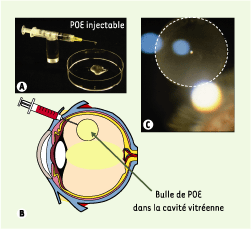
Kimura H, Ogura Y, Hashizoe M, et al. A new vitreal drug delivery system using an implantable biodegradable polymeric device. Invest Ophthalmol Vis Sci 1994; 35 : 2815–9.
18.
Kunou N, Ogura Y, Yasukawa T, et al. Long term sustained release of GC from biodegradable scleral implant for the treatment of CMV retinitis. J Control Release 2000; 10 : 263–71.
19.
Hashizoe M, Ogura Y, Takanashi T, et al. Implantable biodegradable polymeric device in the treatment of experimental proliferative vitreoretinopathy. Curr Eye Res 1995; 14 : 473–7.
20.
Kunou N, Ogura Y, Honda Y, et al. Biodegradable scleral implant for controlled intraocular delivery of betamethasone phosphate. Int J Biomat Res 2000; 51 : 634–41.
21.
Peyman GA, Yang D, Khoobehi B, et al. In vitro evaluation of polymeric matrix and porous biodegradable reservoir devices for slow-release drug delivery. Ophthalmic Surg and lasers 1996; 27 : 384–91.
22.
Chasin M, Domb A, Ron E, et al. Polyanhydrides as drug delivery systems. In : Chasin M, Langer R, eds. Biodegradable polymers as drug delivery systems. New York : Marcel Dekker, 1990 : 43–70.
23.
Heller J, Barr J, Shen H, et al. Poly(ortho esters)-their development and some recent applications. Eur J Pharm Biopharm 2000; 50 : 121–8.
24.
Behar-Cohen F, BenEzra D, Einmahl S, Gurny R. Challenge of intraocular dug delivery. Eur J Pharm Rev 2001; 6 : 35–40.
25.
Einmahl S, Capancioni S, Schwach-Abdellaoui K, et al. Therapeutic applications of viscous and injectable poly(ortho) esters. Adv Drug Deliv Rev 2001; 53 : 45–73.
26.
Einmahl S, Behar-Cohen F, Tabatabay C, et al. A viscous bioerodible poly(ortho ester) as a new biomaterial for intraocular application. J Biomed Mater Res 2000; 5 : 566–73.
27.
Einmahl S, Behar-Cohen F, D’Hermies F, et al. A new poly(ortho ester)-based drug delivery system for the adjunct treatment of filtering surgery. Invest Ophthalmol Vis Sci 2000; 42 : 695–700.
28.
Einmahl S, Savoldelli M, D’Hermies F, et al. Evaluation of a new biomaterial in the suprachoroidal space. Invest Ophthalmol Vis Sci 2002; 43 : 1533–9.
29.
Sakurai E, Ozeki H, Kunou N, Ogura Y. Effect of particle size of polymeric nanospheres on intravitreous kinetics. Ophthalmic Res 2001; 33 : 31–6.
30.
Bourges JL, Gautier SE, Delie F, et al. Ocular drug delivery targeting the retina and retinal pigment epithelium using polylactides nanoparticles. Invest Ophthalmol Vis Sci 2003; 44 : 3562–9.
31.
Peyman G, Convay M, Khoobei B, Soike K. Clearance of of microsphere-entrapped 5-FU and cytosine arabinoside from the vitreous of primate. Int Ophthalmol 1992; 16 : 109–13.
32.
Moritera T, Ogura Y, Yoshimura N, et al. Biodegradable microspheres containing adriamycin in the treatment of proliferative vitreo retinopathy. Invest Ophthalmol Vis Sci 1992; 33 : 3125–30.
33.
Akula SK, Ma PE, Peyman GA, et al. Treatment of cytomegalovirus retinitis with intravitreal injection of liposome encapsulated ganciclovir in a patient with AIDS. Br J Ophthalmol 1994; 78 : 677–80.
34.
Bochot A, Fattal E, Boutet V, et al. Intravitreal delivery of oligonucleotides by sterically stabilized liposomes. Invest Ophthalmol Vis Sci 2002; 43 : 253–9.
35.
Barza M, Stuart M, Szoka F, Jr. Effect of size and lipid composition on the pharmacokinetics of intravitreal liposomes. Invest Ophthalmol Vis Sci 1987; 28 : 893–900.
36.
Ambati J, Canakis CS, Miller JW, et al. Diffusion of high molecular weight compounds through sclera. Invest Ophthalmol Vis Sci 2000; 41 : 1181–5.
37.
Geroski DH, Edelhauser HF. Transscleral drug delivery for posterior segment disease. Adv Drug Deliv Rev 2001; 52 : 37–48.
38.
Ambati J, Gragoudas ES, Miller JW, et al. Transscleral delivery of bioactive protein to the choroid and retina. Invest Ophthalmol Vis Sci 2000; 41 : 1186–91.
39.
Behar-Cohen F, Parel JM, El Aouni A, Chauvaud D. Iontophoresis : The past and the future. J Fr Ophthalmol 2001; 24 : 319–27.
40.
Voigt M, de Kozak Y, Halhal M, et al. Down regulation of NOSII gene expression by iontophoresis of anti-sense oligonucleotide in endotoxin-induced uveitis. Biochem Biophys Res Comm 2002; 295 : 336–41.
41.
Lam TT, Fu J, Tso MO. A histopathological study of retinal lesions inflicted by transscleral iontophoresis Graefe’s Arch Clin Exp Ophthalmol 1991; 229 : 389–94.
42.
Behar-Cohen FF, El Aouni A, Gautier S, et al. Transscleral coulomb-controlled iontophoresis of methylprednisolone into the rabbit eye : Influence of duration of treatment, current intensity and drug concentration in ocular tissues and fluids levels. Exp Eye Res 2002; 74 : 51–9.
43.
Halhal M, Renard G, Courtois Y, et al. Iontophoresis from the lab to the bedside. Exp Eye Res 2004; 78 : 751–7.