| |
| Med Sci (Paris). 2004 August; 20(8-9): 799–803. Published online 2004 August 15. doi: 10.1051/medsci/2004208-9799.L’acide lysophosphatidique : un phospholipide « bioactif » Jean-Sébastien Saulnier-Blache* Inserm U.586, Institut Louis Bugnard, CHU Rangueil, 31404 Toulouse, France |
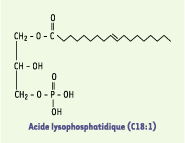
L’acide lysophosphatidique (LPA) est un phospholipide constitué d’un squelette glycérol-phosphate sur lequel est greffé un acide gras, en position 1 ou en position 2, par l’intermédiaire d’une liaison acyl, alkyl ou alkényl (Figure 1). Chez les mammifères, les espèces majoritaires de LPA retrouvées dans les liquides biologiques sont constituées d’acides gras à longue chaîne saturée (C18 :0 ; C16 :0) ou insaturée (C18 :1 ; C20 :4). Ces espèces majoritaires présentent généralement l’activité biologique la plus forte. 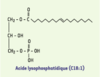 | Figure 1. Formule chimique de l’acide lysophosphatidique (LPA). Le LPA est constitué d’un squelette glycérol phosphate sur lequel est greffé un acide gras, en position 1 ou en position 2, par l’intermédiaire d’une liaison acyl, alkyl ou alkényl. Il s’agit sur ce schéma de la forme oléoyl (C18 :1), qui est la plus couramment utilisée dans les études expérimentales. |
La première démonstration de l’existence d’un LPA bioactif remonte à 1963 où W. Vogt démontra que le LPA était impliqué dans l’effet vasoconstricteur induit par des extraits d’intestin de grenouille sur des cellules musculaires lisses de lapin [
1]. Plusieurs années après, en 1978, il fut montré que l’injection intraveineuse de LPA conduisait à des effets rapides sur la pression artérielle [
2]. À la même période, le LPA, connu comme un puissant facteur pro-agrégant [
3], était mis en évidence dans le sang lors de l’agrégation plaquettaire [
4]. Les effets biologiques engendrés par le LPA bioactif ne résultaient pas d’une perturbation non spécifique de la structure de la membrane cellulaire due à une possible action détergente (propriété classique de certains lysophospholipides), mais de la mise en jeu probable d’un récepteur. Ainsi, le LPA était capable d’augmenter la synthèse d’ADN dans des fibroblastes selon un mécanisme sensible à la toxine pertussique [
5], suggérant l’implication d’un récepteur couplé à une protéine G. Le premier récepteur du LPA fut cloné en 1996 [
6]. |
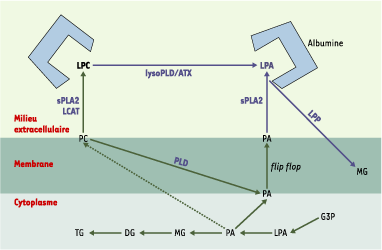
Où trouve-t-on du LPA « bioactif » ? Le LPA est présent dans plusieurs liquides biologiques où il est maintenu en solution grâce à sa liaison à l’albumine qui lui sert de véhicule (Figure 2). Il est présent dans le sang où son origine cellulaire semble multiple. Il peut s’agir des plaquettes sanguines : le sérum obtenu après agrégation plaquettaire contient de fortes concentrations de LPA (2 à 20 muM) [
7]. Le LPA est présent en forte concentration dans les ascites prélevées chez des patientes atteintes de cancer ovarien [
8]. Le LPA est également retrouvé en abondance dans le liquide folliculaire, associé aux lipoprotéines [
9,
10]. Notre groupe a trouvé du LPA dans le milieu interstitiel du tissu adipeux sous-cutané humain prélevé par microdialyse, avec comme origine cellulaire, les adipocytes [
11]. Enfin, le LPA est présent dans l’humeur aqueuse et le liquide lacrymal après blessure de la cornée [
12], ainsi que dans la salive [
13]. 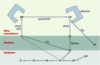 | Figure 2. Anabolisme et catabolisme de l’acide lysophosphatidique. L’acide lysophosphatidique (LPA) est synthétisé directement à l’extérieur de la cellule. Il se trouve en solution dans le milieu extra cellulaire grâce à sa liaison à l’albumine. Le LPA peut provenir de l’hydrolyse de la lysophosphatidylcholine (LPC) sous l’action d’une activité lysophospholipase D (lysoPLD). Une activité lysoPLD soluble est portée par l’autotaxine (ATX). La LPC est générée par hydrolyse de la phosphatidylcholine (PC) membranaire sous l’action de petites phospholipases, les phospholipases A2 sécrétées (sPLA2). Les sPLA2 peuvent également catalyser la formation de LPA à partir d’acide phosphatidique (PA), lui-même issu de l’hydrolyse de la PC par une phospholipase D (PLD). Le LPA est inactivé par déphosphorylation sous l’action des lipide phosphate phosphohydrolases (LPP) en donnant des monoacylglycérol (MG). G3P : glycérol-3-phosphate ; DG : diacylglycérol ; TG : triacylglycérol ; LCAT : lécithine cholestérol acyl transférase ; flip-flop : diffusion transversale des phospholipides d’une couche à l’autre de la membrane. |
|
Métabolisme du LPA « bioactif » En raison de sa nature polaire, la diffusion passive du LPA au travers des membranes biologiques est peu probable. La présence de LPA dans un milieu biologique extracellulaire ne peut résulter que d’un transport actif ou d’une synthèse directement dans le milieu extracellulaire. Il existe des protéines de liaison du LPA (albumine, protéines de liaison des acides gras, gelsoline), mais aucun transporteur transmembranaire n’a été mis en évidence. En revanche, des enzymes susceptibles de synthétiser du LPA à l’extérieur de la cellule existent. Il peut s’agir d’enzymes sécrétées ou d’enzymes membranaires possédant un site catalytique orienté vers l’extérieur de la cellule. Deux types d’enzymes remplissent ces conditions : les phospholipases A2 sécrétées (sPLA2) et la lysophospholipase D sécrétée (s-lysoPLD) (Figure 2).
|
Les sPLA2 sont de petites phospholipases (autour de 15 kDa) qui catalysent l’hydrolyse des glycérophospholipides, produisant des acides gras et des lysophospholipides [
14]. En utilisant l’acide phosphatidique (PA) (lui même issu de l’hydrolyse de la phosphatidylcholine par une phospholipase D) comme substrat, l’activité PLA2 conduit à la synthèse de LPA (Figure 2). Or, dans les conditions normales, le PA est peu abondant et se trouve majoritairement au niveau du feuillet interne de la membrane plasmique. Néanmoins, dans certaines conditions inflammatoires, les membranes de certaines cellules (plaquettes, érythrocytes) peuvent subir de profonds remaniements (diffusion des phospholipides d’une couche à l’autre de la membrane ou flip-flop, production de microvésicules) rendant le PA accessible aux sPLA2 [
15]. |
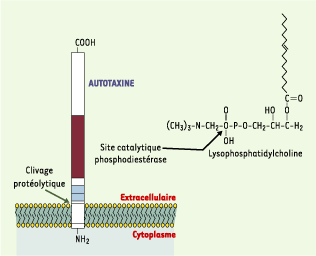
La lysophospholipase D sécrétée Certains lysophospholipides comme la lysophosphatidylcholine (lyso-PC) peuvent être hydrolysés en LPA par une activité lysophospholipase D (lysoPLD) (Figure 2). Le lyso-PC est retrouvé en abondance (lié à l’albumine ou à des lipoprotéines) dans les liquides biologiques et est synthétisé à partir de la phosphatidylcholine sous l’action d’une PLA2 ou de la lécithine cholestérol acyltransférase (LCAT) (Figure 2). Une activité lysoPLD soluble (s-lysoPLD) a été mise en évidence dans le plasma sanguin [
16], ainsi que dans des milieux de culture d’adipocytes [
17]. L’enzyme responsable de cette activité a récemment été purifiée et identifiée [
18,
19]. C’est une ecto-nucléotide pyrophosphatase phosphodiestérase de type II, également appelée autotaxine (ATX). Il s’agit d’une protéine soluble de 125 kDa qui serait ancrée dans la membrane plasmique par son extrémité aminoterminale, et libérée dans le milieu extracellulaire par clivage protéolytique (Figure 3). Dans sa partie extracellulaire, l’ATX possède un site catalytique, initialement impliqué dans l’hydrolyse de liaisons phosphodiesters et pyrophosphates de substrats comme l’ATP ou l’ADP [
20]. Les ARN messagers de l’ATX sont retrouvés dans plusieurs tissus dont le tissu adipeux où ils sont particulièrement abondants [19]. 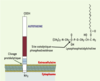 | Figure 3. Structure et activité lysophospholipase D de l’autotaxine. L’autotaxine (ATX) est une ecto-nucléotide pyrophosphatase phosphodiestérase de type II. Il s’agit d’une protéine de 125 kDa ancrée dans la membrane par son extrémité aminoterminale, et libérée dans le milieu extracellulaire par clivage protéolytique. Dans sa partie extracellulaire, l’ATX possède un site catalytique, initialement impliqué dans l’hydrolyse de liaisons phosphodiesters et pyrophosphates de substrats comme l’ATP ou d’ADP, et qui transforme la lysophosphatidylcholine (LPC) en acide lysophosphatidique (LPA). |
|
Les lipide phosphate phosphohydrolases Parallèlement à sa synthèse, le LPA subit également un catabolisme intense. La très grande majorité (plus de 90 %) de son hydrolyse (donc de son inactivation) correspond à sa déphosphorylation par des lipide phosphate phosphohydrolases (LPP). Il s’agit de phosphatases dont le site catalytique est orienté vers la face externe de la membrane plasmique [
21,
22]. |
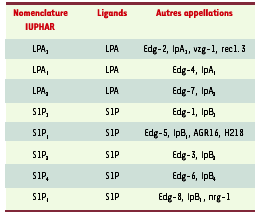
En général, les effets cellulaires engendrés par le LPA sont spécifiques et remplissent les critères d’une transmission par des récepteurs : concentration efficace de l’ordre du micromolaire, dose-dépendance, sensibilité à la toxine pertussique. Il faut cependant être prudent sur l’interprétation des résultats obtenus avec des concentrations de LPA supérieures à 10 muM. A ces concentrations, le LPA tend à former un précipité avec le calcium engendrant des effets cellulaires qui pourraient être indépendants de ceux d’un récepteur. Au moins trois sous-types de récepteurs du LPA ont été identifiés. Il s’agit de récepteurs à sept domaines transmembranaires couplés aux protéines G et appartenant à la famille EDG (endothelial differentiation gene). La nomenclature de cette famille vient récemment d’être modifiée [
23]. Elle est constituée de trois sous-types de récepteurs du LPA (LPA-1, -2, -3) et de cinq sous-types de récepteurs d’un autre phospholipide bioactif, la sphingosine-1-phosphate (Tableau 1). 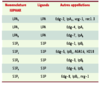 | Tableau I. Nomenclature des récepteurs des lysophospholipides. IUPHAR : international union of pharmacology ; LPA : acide lysophosphatidique ; S1P : sphingosin-1-phosphate ; vzg : ventricular zone gene ; Edg : endothelial differentiation gene ; ngr : nerve growth factor regulated G protein-coupled receptor. |
Les voies de transduction du signal mises en jeu par l’activation des récepteurs du LPA sont étroitement liées à la nature des protéines G auxquelles ils sont couplés [
24]. Grâce à leur couplage à la protéine Gi (inhibitrice), les trois sous-types de récepteur conduisent à l’activation des MAPK (mitogen activated protein kinases) et des PI3K (phosphatidyl inositol 3-kinase). Ces activations, qui peuvent être directes ou mettre en jeu la transactivation de récepteurs de facteurs de croissance comme celui de l’EGF (epidermal growth factor) [
25], sont impliquées dans les effets mitogéniques et antiapoptotiques du LPA. Les trois sous-types de récepteur conduisent également à l’activation de la phospholipase C et à l’augmentation du calcium intracellulaire via un couplage à la protéine Gq. Seuls les récepteurs LPA1 et LPA2 conduisent à une inhibition de l’adénylate cyclase via un couplage à la protéine Gi. Le récepteur LPA3 entraîne au contraire une activation de l’adénylate cyclase, probablement grâce à un couplage à la protéine Gs (stimulatrice). Les récepteurs LPA1 et LPA2 conduisent également à l’activation de la contraction de l’actomyosine grâce à leur couplage à la protéine G13 et à l’activation de la GTPase Rho. Cette voie de transduction est impliquée dans les différents effets du LPA sur la motilité et l’adhérence cellulaire. Le couplage des récepteurs LPA1 et LPA2 à la protéine G13 peut également conduire à la régulation de la transcription de certains gènes possédant un SRE (serum responsive element) dans leur promoteur. L’invalidation des récepteurs LPA1 et LPA2 a été réalisée par recombinaison homologue chez la souris [
26,
27]. Alors que les souris invalidées pour le récepteur LPA2 ne présentent pas de phénotype particulier, les souris invalidées pour le récepteur LPA1 présentent une mortalité néonatale importante (50 %) liée à une perturbation de l’olfaction et une réduction du comportement de succion chez les nouveau-nés. A l’âge adulte, les souris survivantes sont de plus petite taille mais se reproduisent normalement. Sur la base de ces observations, l’impact majeur du récepteur LPA1 semble se situer aux phases précoces du développement néonatal. La double invalidation des récepteurs LPA1 et LPA2 ne génère pas de phénotype essentiellement différent de l’invalidation du seul récepteur LPA1 [27]. Cependant, l’analyse de la sensibilité au LPA de fibroblastes issus d’embryons de ces souris, montre que la double invalidation LPA1/LPA2 est nécessaire pour entraîner une perte complète de l’effet du LPA sur certaines réponses cellulaires, suggérant une redondance entre les deux sous-types. |
Possibles implications physiopathologiques du LPA « bioactif » Tonicité et maintien de l’intégrité vasculaire In vitro, le LPA augmente la contraction des cellules musculaires lisses des vaisseaux. Ces effets in vitro sont en accord avec les effets hypertenseurs observés après injection in vivo [
28]. Le LPA augmente également la prolifération, la contraction, la migration et la cohésion des cellules endothéliales, suggérant une participation dans la ré-endothélialisation et le maintien de l’intégrité des vaisseaux lésés [
29]. L’invalidation du récepteur LPA1 chez la souris s’accompagne effectivement d’une augmentation, au stade périnatal, de la fréquence d’apparition d’hématomes frontaux [ 26]. Le LPA est retrouvé en abondance dans le corps lipidique des lésions athéroscléreuses, probablement en raison de la captation des LDL (low density lipoprotein) oxydées. L’exposition au LPA de cellules endothéliales en culture, augmente l’expression de protéines d’adhérence des monocytes (E-sélectine, V-CAM), participant ainsi aux processus inflammatoires associés à l’athérosclérose. Le LPA stimule également la prolifération, la dédifférenciation et la migration des cellules musculaires lisses, ce qui favoriserait leur infiltration dans l’intima des vaisseaux, un événement classiquement associé à la progression de l’athérosclérose. Enfin, le LPA augmente la production de certaines métallo-protéases par les lymphocytes, ce qui pourrait entraîner une fragilisation de la matrice de collagène et contribuer au phénomène de rupture de la plaque d’athérome [
30]. Cicatrisation Parallèlement à son rôle possible dans la ré-endothélialisation des vaisseaux, le LPA pourrait participer à la cicatrisation de tissus comme la cornée [ 12], l’épithélium gastrique [
31] ou la peau. Il a ainsi été observé que l’application topique de LPA sur une blessure cutanée chez le rat, accélérait de façon significative la fermeture de la plaie et augmentait l’épaisseur de la couche épithéliale néoformée [
32]. Cancer Le LPA est présent dans des biopsies de tumeurs du colon alors qu’il est absent dans des biopsies de colons sains [
33]. Le LPA est retrouvé dans les ascites prélevées chez des patients atteints de cancer, en particulier ovarien [ 8]. Bien que cela reste controversé [
34], les concentrations plasmatiques de LPA seraient augmentées chez des patientes atteintes de cancer ovarien [
35]. Quel pourrait être le rôle du LPA dans le cancer ? En raison de ses effets mitogéniques, le LPA pourrait entretenir ou amplifier la croissance des cellules cancéreuses. En augmentant la production de facteurs pro-angiogéniques comme le VEGF (vascular endothelial growth factor), le LPA pourrait favoriser le processus d’angiogenèse nécessaire à l’expansion des tumeurs. Le LPA stimule également la production de certaines métalloprotéases, ainsi que la migration cellulaire, des événements favorables au processus métastasique. Enfin, le LPA est un agent anti-apoptotique, y compris in vivo, comme cela a pu être démontré sur des cellules cancéreuses ainsi que sur des cellules normales exposées à des traitements chimiques (cisplatine) ou des irradiations [
36]. Reproduction Le LPA est retrouvé en abondance (à des concentrations d’environ 20 mM) dans le liquide folliculaire [ 10]. En outre, les concentrations plasmatiques de LPA augmentent au cours de la gestation [
37]. Ainsi, une implication possible du LPA dans la maturation de l’ovocyte a été proposée. Cette hypothèse est en accord avec des études chez l’animal montant que le LPA accélérait la maturation nucléaire de l’ovocyte, le transport de l’ovocyte dans l’oviducte isolé de souris, ainsi que la croissance et la différenciation des cellules déciduales après leur implantation [
38]. Obésité Notre groupe a montré que LPA est libéré par les adipocytes in vitro et est présent in vivo dans le milieu extracellulaire du tissu sous-cutané adipeux humain prélevé par microdialyse [ 11]. En parallèle, le LPA augmente la prolifération des préadipocytes en culture via l’activation du récepteur Edg2 (endothelial differentiation gene 2)/LPA1 [
39]. Enfin, l’expression de l’enzyme responsable de la synthèse de LPA par l’adipocyte, l’autotaxine (voir ci-dessus), est fortement augmentée dans les adipocytes de souris db/db génétiquement obèses et diabétiques [ 29]. Ainsi, grâce à son action sur la prolifération et la différenciation des préadipocytes, le LPA pourrait influencer le recrutement de nouveaux adipocytes au sein du tissu adipeux au cours de la mise en place de l’obésité. |
Conclusions et perspectives Un nombre croissant d’études in vitro suggère que le LPA produit dans le milieu extracellulaire pourrait être impliqué dans l’étiologie de certaines maladies (maladies cardio-vasculaires, cancers, obésité). Les protéines récemment identifiées impliquées dans l’activité biologique (récepteurs) ou la production (enzymes de synthèse et de dégradation) du LPA, constituent autant de cibles pharmacologiques ou transgéniques qui devraient permettre de déterminer l’implication physiopathologique du LPA in vivo. |
1. Vogt W. Pharmacologically active acidic phospholipds and glycolipids. Biochem
Pharmacol 1963; 12 : 415–20. 2. Tokumura A, Fukuzawa K, Akamatsu Y, et al. Identification of vasopressor phospholipid in crude soybean lecithin. Lipids 1978; 13 : 468–72. 3. Schumacher KA, Classen HG, Spath M. Platelet aggregation evoked in vitro and in vivo by phosphatidic acids and lysoderivatives : Identity with substances in aged serum (DAS). Thromb Haemost 1979; 42 : 631–40. 4. Mauco G, Chap H, Simon MF, Douste-Blazy L. Phosphatidic and lysophosphatidic acid production in phospholipase C-and thrombin-treated platelets. Possible involvement of a platelet lipase. Biochimie 1978; 60 : 653–61. 5. Van Corven EJ, Groenink A, Jalink K, et al. Lysophosphatidate-induced cell proliferation : Identification and dissection of signaling pathways mediated by G proteins. Cell 1989; 59 : 45–54. 6. Hecht JH, Weiner JA, Post SR, Chun J. Ventricular zone gene-1 (vzg-1) encodes a lysophosphatidic acid receptor expressed in neurogenic regions of the developing cerebral cortex. J Cell Biol 1996; 135 : 1071–83. 7. Aoki J, Taira A, Takanezawa Y, et al. Serum lysophosphatidic acid is produced through diverse phospholipase pathways. J Biol Chem 2002; 277 : 48737–44. 8. Westermann A, Havik E, Postma F, et al. Malignant effusions contain lysophosphatidic acid (LPA)-like activity. Ann Oncol 1998; 9 : 437–42. 9. Tokumura A, Miyake M, Nishioka Y, et al. Production of lysophosphatidic acids by lysophospholipase D in human follicular fluids of in vitro fertilization patients. Biol Reprod 1999; 61 : 195–9. 10. Jaspard B, Collet X, Barbaras R, et al. Biochemical characterization of pre-beta 1 high-density lipoprotein from human ovarian follicular fluid : Evidence for the presence of a lipid core. Biochemistry 1996; 35 : 1352–7. 11. Valet P, Pages C, Jeanneton O, et al. Alpha2-adrenergic receptor-mediated release of lysophosphatidic acid by adipocytes. A paracrine signal for preadipocyte growth. J Clin Invest 1998; 101 : 1431–8. 12. Liliom K, Guan Z, Tseng JL, et al. Growth factor-like phospholipids generated after corneal injury. Am J Physiol 1998; 274 : C1065–74. 13. Sugiura T, Nakane S, Kishimoto S, et al. Lysophosphatidic acid, a growth factor-like lipid, in the saliva. J Lipid Res 2002; 43 : 2049–55. 14. Capper EA, Marshall LA. Mammalian phospholipases A(2) : Mediators of inflammation, proliferation and apoptosis. Prog Lipid Res 2001; 40 : 167–97. 15. Fourcade O, Simon MF, Viodé C, et al. Secretory phospholipase A2 generates the novel lipid mediator lysophosphatidic acid in membrane microvesicles shed from activated cells. Cell 1995; 80 : 919–27. 16. Tokumura A, Miyabe M, Yoshimoto O, et al. Metal-ion stimulation and inhibition of lysophospholipase D which generates bioactive lysophosphatidic acid in rat plasma. Lipids 1998; 33 : 1009–15. 17. Gesta S, Simon M, Rey A, et al. Secretion of a lysophospholipase D activity by adipocytes : Involvement in lysophosphatidic acid synthesis. J Lipid Res 2002; 43 : 904–10. 18. Tokumura A, Majima E, Kariya Y, et al. Identification of human plasma lysophospholipase D, a lysophosphatidic acid-producing enzyme, as autotaxin, a multifunctional phosphodiesterase. J Biol Chem 2002; 277 : 39436–42. 19. Ferry G, Tellier E, Try A, et al. Autotaxin is released from adipocytes, catalyses lysophosphatidic acid synthesis, and activates preadipocyte proliferation : Up-regulated expression with adipocyte differentiation and obesity. J Biol Chem 2003; 278 : 18162–9. 20. Bollen M, Gijsbers R, Ceulemans H, et al. Nucleotide pyrophosphatases/phosphodiesterases on the move. Crit Rev Biochem Mol Biol 2000; 35 : 393–432. 21. Brindley DN, English D, Pilquil C, et al. Lipid phosphate phosphatases regulate signal transduction through glycerolipids and sphingolipids. Biochim Biophys Acta 2002; 1582 : 33–44. 22. Simon MF, Rey A, Castan-Laurel I, et al. Expression of ecto-lipid phosphate phosphohydrolases in 3T3F442A preadipocytes and adipocytes : Involvement in the control of lysophosphatidic acid production. J Biol Chem 2002; 277 : 23131–6. 23. Chun J, Goetzl EJ, Hla T, et al. International union of pharmacology. XXXIV. Lysophospholipid receptor nomenclature. Pharmacol Rev 2002; 54 : 265–9. 24. Ishii I, Contos JJ, Fukushima N, Chun J. Functional comparisons of the lysophosphatidic acid receptors, LP(A1)/VZG-1/EDG-2, LP(A2)/EDG-4, and LP(A3)/EDG-7 in neuronal cell lines using a retrovirus expression system. Mol Pharmacol 2000; 58 : 895–902. 25. Wu J, Cunnick JM. Trans-regulation of epidermal growth factor receptor by lysophosphatidic acid and G protein-coupled receptors. Biochim Biophys Acta 2002; 1582 : 100–6. 26. Contos JJ, Fukushima N, Weiner JA, et al. Requirement for the lpA1 lysophosphatidic acid receptor gene in normal suckling behavior. Proc Natl Acad Sci USA 2000; 97 : 13384–9. 27. Contos JJ, Ishii I, Fukushima N, et al. Characterization of lpa(2) (Edg4) and lpa(1)/lpa(2) (Edg2/Edg4) lysophosphatidic acid receptor knockout mice : Signaling deficits without obvious phenotypic abnormality attributable to lpa(2). Mol Cell Biol 2002; 22 : 6921–9. 28. Tigyi G, Hong L, Yakubu M, et al. Lysophosphatidic acid alters cerebrovascular reactivity in piglets. Am J Physiol 1995; 268 : H2048–55. 29. Karliner JS. Lysophospholipids and the cardiovascular system. Biochim Biophys Acta 2002; 1582 : 216–21. 30. Siess W. Athero- and thrombogenic actions of lysophosphatidic acid and sphingosine-1-phosphate. Biochim Biophys Acta 2000; 1582 : 204–15. 31. Sturm A, Sudermann T, Schulte KM, et al. Modulation of intestinal epithelial wound healing in vitro and in vivo by lysophosphatidic acid. Gastroenterology 1999; 117 : 368–77. 32. Balazs L, Okolicany J, Ferrebee M, et al. Topical application of the phospholipid growth factor lysophosphatidic acid promotes wound healing in vivo. Am J Physiol Regul Integr Comp Physiol 2001; 280 : R466–72. 33. Merchant TE, Kasimos JN, de Graaf PW, et al. Phospholipid profiles of human colon cancer using 31P magnetic resonance spectroscopy. Int J Colorectal Dis 1991; 6 : 121–6. 34. Baker DL, Morrison P, Miller B, et al. Plasma lysophosphatidic acid concentration and ovarian cancer. Jama 2002; 287 : 3081–2. 35. Xu Y, Shen Z, Wiper DW, et al. Lysophosphatidic acid as a potential biomarker for ovarian and other gynecologic cancers. JAMA 1998; 280 : 719–23. 36. Fang X, Schummer M, Mao M, et al. Lysophosphatidic acid is a bioactive mediator in ovarian cancer. Biochim Biophys Acta. 2002; 1582 : 257–64. 37. Tokumura A, Kanaya Y, Miyake M, et al. Increased production of bioactive lysophosphatidic acid by serum lysophospholipase D in human pregnancy. Biol Reprod 2002; 67 : 1386–92. 38. Budnik LT, Mukhopadhyay AK. Lysophosphatidic acid and its role in reproduction. Biol Reprod 2002; 66 : 859–65. 39. Pagès C, Daviaud D, An S, et al. Endothelial differentiation gene-2 receptor is involved in lysophosphatidic acid- dependent control of 3T3F442A preadipocyte proliferation and spreading. J Biol Chem 2001; 276 : 11599–605. |