Obtenir un nombre élevé de cellules souches hématopoïétiques (CSH) est un objectif majeur lors de la mise en place de protocoles de thérapies cellulaire ou génique et dans le développement de recherches sur l’hématopoïèse. Les CSH représentent un petit contingent de cellules présentes majoritairement dans la moelle osseuse et, de façon plus minoritaire, dans le sang circulant et placentaire (« sang de cordon »). Les CSH sont caractérisées par leur capacité de s’autorenouveler ou de se différencier en fonction des besoins de l’organisme, et de produire l’ensemble des cellules du sang tout au long de la vie. Leur expansion dans le cadre d’un projet thérapeutique nécessite des techniques préservant leurs propriétés d’autorenouvellement et de homing dans la moelle osseuse, ainsi que leur pluripotentialité. Différentes procédures pour parvenir à ce but ont été décrites, en particulier l’utilisation de cocktails de cytokines, en association ou non avec d’autres facteurs solubles. Cependant, ce type de manipulation peut être aléatoire dans le contexte de l’utilisation ultérieure de ces CSH en thérapeutique humaine : il peut en effet induire une perte de certaines des propriétés de ces cellules et conduire à leur engagement dans un processus de différenciation irréversible.
Une alternative à l’utilisation des cytokines consiste en l’infection des CSH par des rétrovirus recombinants codant pour des facteurs de transcription qui interviennent dans leur détermination et leur développement, et dont la surexpression n’est pas transformante. Cela a été réalisé avec succès chez la souris par l’équipe de Guy Sauvageau à Montréal (Québec), avec le gène codant pour l’homéoprotéine HOXB4. Cette équipe a montré que la surexpression constitutive du gène HoxB4 dans les cellules hématopoïétiques provoquait une expansion forte et persistante du pool des cellules souches in vivo, sans induire leur différenciation ni leur transformation maligne, même à long terme [ 1]. Chez l’homme, il a également été montré que l’infection des CSH avec un vecteur rétroviral contenant la séquence codante du gène HoxB4 permettait d’obtenir une expansion de ces cellules in vitro [ 2]. Cependant, les CSH ainsi infectées sont modifiées génétiquement et expriment la protéine HOXB4 de façon constitutive, ce qui n’est pas dénué de risque dans le cadre d’une éventuelle application thérapeutique.
Afin d’éviter tout effet délétère en rapport avec l’intégration stable du gène HoxB4 dans les cellules souches humaines, nous avons utilisé la propriété des protéines HOX de traverser spontanément les membranes cellulaires, en l’absence de récepteur spécifique. Cette propriété, liée à une structure propre à ces protéines, l’homéodomaine, avait été décrite par l’équipe d’Alain Prochiantz (ENS, Paris, France) dans des cultures de neurones. Cette équipe avait clairement établi qu’il s’agissait là d’un processus passif et réversible, et que les protéines ainsi transférées conservaient leurs activités biologiques [ 3]. Nous avons donc tiré parti de cette propriété pour faire pénétrer la protéine HOXB4 dans les CSH humaines afin d’expandre ces cellules ex vivo (Figure 1), la protéine HOXB4 étant produite, en permanence et in situ, par une lignée stromale permettant, par ailleurs, le soutien à long terme de l’hématopoïèse humaine in vitro.
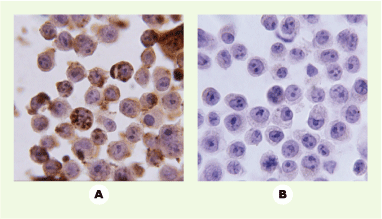
| Figure 1.
Transfert de la protéine HOXB4 dans des cellules hématopoïétiques humaines. Après co-culture avec (A) des cellules stromales sécrétant activement HOXB4, (B) les mêmes cellules stromales ne sécrétant pas la protéine. Analyse immunocytochimique des cellules hématopoïétiques avec un anticorps anti-HOXB4, révélé par une coloration à la diamino-benzidine. |
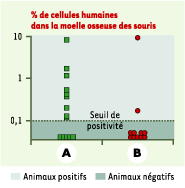
Nous avons ainsi pu établir que la protéine HOXB4 était capable d’amplifier en culture les cellules humaines les plus immatures identifiables expérimentalement soit in vitro, les LTC-IC (long term culture-initiating cells) (x 20 par rapport au nombre de LTC-IC au démarrage de la culture), soit in vivo dans un système de greffe xénogénique, les SRC (SCID repopulating cells) (x 3 par rapport au nombre de SRC de départ) (Figure 2). Nous avons montré que ces cellules amplifiées gardaient, au cours de leur différenciation chez l’animal, leur pluripotentialité intacte [ 4]. Cette capacité de HOXB4 d’amplifier les CSH sous la forme d’une protéine exogène ajoutée aux cultures a été confirmée dans un modèle où HOXB4 était fusionnée à la protéine transactivatrice TAT du VIH (cette protéine ayant les mêmes propriétés de transduction passive que l’homéodomaine des protéines HOX) et utilisée dans des cultures de cellules murines [ 5].
Au total, nous avons mis au point un système permettant l’amplification des CSH humaines primitives sans ajout de cytokines et sans modification génétique de ces cellules. Il s’agit d’un modèle d’expansion cellulaire non viral qui pourrait constituer une base pour le développement de nouvelles stratégies thérapeutiques utilisant la protéine HOXB4 pour l’amplification des cellules souches humaines hématopoïétiques.
Aujourd’hui, les sources de CSH disponibles sont principalement la moelle osseuse, dont l’utilisation implique que soient effectués des prélèvements par ponctions multiples des os riches en moelle productrice de cellules (sternum, os iliaque), et le sang périphérique, après « mobilisation » des cellules du donneur par des cytokines (G-CSF, essentiellement). Les prélèvements, réalisés alors par cytaphérèse, ne sont pas dénués de certains effets secondaires, surtout chez des patients affaiblis ou âgés ; de plus, chez certains donneurs dits « faibles mobilisateurs », le nombre de cellules souches recueillies est trop faible pour autoriser une greffe. Le sang placentaire est, quant à lui, réservé à la greffe de jeunes enfants, compte tenu du trop petit nombre de cellules souches contenues dans ces greffons.
Quelle que soit l’origine des cellules souches, l’efficacité des greffes est d’autant plus grande que le nombre de cellules injectées est élevé : c’est pourquoi leur multiplication ex vivo constitue une étape cruciale pour l’amélioration des protocoles thérapeutiques. Dans cette perspective, la production en masse de la protéine recombinante HOXB4, actuellement en cours, pourra permettre de tester directement l’activité de ce facteur sur les CSH humaines en l’absence de cellules stromales productrices. L’adaptation de cette méthodologie à des conditions répondant aux normes utilisées dans les unités de thérapie cellulaire devrait alors pouvoir être envisagée.