La maladie de Parkinson est une maladie neurodégénérative caractérisée par la perte progressive d’un seul type cellulaire du cerveau, les neurones dopaminergiques de la substance noire pars compacta. Cette perte cellulaire entraîne une déficience du striatum en dopamine, et il n’existe pour l’instant aucun traitement capable d’arrêter ou d’inverser durablement l’évolution de cette maladie. Une approche thérapeutique consiste à restaurer la fonction du striatum en transplantant des cellules neurales capables, à terme, de remplacer les neurones nigraux perdus. Des essais cliniques appliquant cette stratégie dite « substitutive » sont menés depuis maintenant près de 15 ans [ 1], essentiellement en transplantant des tissus mésencéphaliques issus de plusieurs fœtus humains (parfois 6 à 10 par patient). L’approvisionnement, l’amplification et la standardisation de ce type de greffon étant très problématique, la généralisation de cette approche thérapeutique n’est, au-delà de toute considération éthique, pas envisageable pour l’instant. Pour pouvoir traiter un plus grand nombre de patients parkinsoniens par transplantation cellulaire, il faudrait disposer d’une source de greffons au moins aussi efficace que les tissus fœtaux, mais permettant la préparation standardisée de grandes quantités de neurones dopaminergiques.
Dérivées à partir de certaines cellules d’embryons âgés de seulement quelques jours (stade blastocyste), les cellules souches embryonnaires (ES) sont capables de se multiplier pratiquement sans limite et de se différencier en tous types cellulaires de l’organisme (cellules pluripotentes). Les cellules ES d’origine humaine constituent donc une source idéale de greffons pour des applications cliniques de thérapie cellulaire, mais seulement si l’on sait diriger efficacement leur croissance et leur différenciation vers les types cellulaires souhaités. Depuis quelques années, plusieurs équipes ont réussi à différencier des cellules ES murines, génétiquement modifiées ou non, en neurones dopaminergiques [ 2– 5]. Ces neurones ont, chez le rat parkinsonien, un potentiel thérapeutique proche de celui de tissus fœtaux [ 6, 7]. Jusqu’à présent, les divers essais de différenciation neurale de cellules ES humaines n’avaient permis de produire que très marginalement des neurones exprimant au moins un marqueur dopaminergique [ 8, 9]. Dans un article récemment publié dans les Proceedings of the National Academy of Sciences (USA) [ 10], l’équipe de L. Studer décrit un nouveau protocole permettant l’obtention de grandes quantités de neurones dopaminergiques mésencéphaliques à partir de différentes lignées de cellules ES humaines. Les auteurs montrent que les voies de différenciation et de signalisation clés au cours du développement du mésencéphale, in vivo, peuvent être reproduites de manière systématique afin de diriger avec succès la différenciation des cellules ES en neurones dopaminergiques.
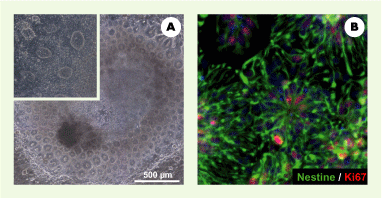
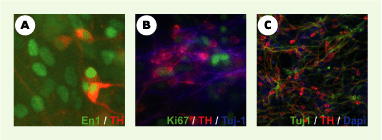
Le premier mois de différenciation in vitro des cellules ES humaines permet d’obtenir des progéniteurs neuraux ayant une forte capacité proliférative. L’induction neurale est déclenchée en cultivant les cellules à très faible densité sur une couche de cellules stromales de moelle osseuse. Cette propriété des cellules stromales est similaire à celle observée auprès de lignées de cellules ES de souris ou de singe avec plusieurs lignées de cellules stromales d’origine similaire (PA6, MS5, S17, S2) [5, 6]. À la différence de ce qui est obtenu en utilisant des cellules ES murines, la différenciation neurale de cellules ES humaines sur des cellules stromales (MS5) engendre des colonies de cellules neuro-épithéliales constituées de centaines de structures cellulaires circulaires désignées sous le terme de rosettes neurales (Figure 1A). Dans ces colonies, l’induction neurale se caractérise par l’apparition d’îlots cellulaires (préfigurant les futures rosettes) qui cessent d’exprimer des marqueurs de cellules souches embryonnaires tels que Oct-4, Nanog ou Cripto, et commencent à exprimer des marqueurs neuraux tels que le filament intermédiaire nestine (Figure 1B), les facteurs de transcription Sox-1 ou Pax-6, ou encore la molécule d’adhérence cellulaire neurale N-CAM. Contrairement à ce que leur morphologie pourrait suggérer [8], les rosettes issues des cellules ES ne représentent pas un équivalent in vitro de tube neural. L’absence de marqueurs de régionalisation dorso-ventrale dans les rosettes indique qu’elles représentent plutôt un équivalent de plaque neurale, une structure qui apparaît plus précocement au cours du développement neural. La régionalisation dorso-ventrale caractérisée par la formation de domaines distincts d’expression de facteurs de transcription précis est en effet très largement achevée lors de la fermeture du tube neural chez la souris. En accord avec cette interprétation, les auteurs observent que les cellules de rosettes répondent de manière spécifique à la présence de deux signaux de régionalisation, Shh et FGF8, essentiels au développement in vivo du mésencéphale ventral [ 11]. Comme cela est observé au cours du développement de la souris, des précurseurs humains exprimant les facteurs de transcription Pax2 et Lmx1b apparaissent en premier in vitro, suivis par des précurseurs de neurones post-mitotiques et des jeunes neurones exprimant des marqueurs spécifiques plus tardifs, tels que les facteurs de transcription En1 et Pitx3, et finalement la tyrosine hydroxylase (enzyme clé de la biosynthèse de la dopamine) (Figure 2A-B). Après environ 50 jours de culture, les neurones obtenus, bien qu’encore assez immatures, expriment la majorité des marqueurs caractéristiques des neurones dopaminergiques du mésencéphale. Ils possèdent des propriétés électrophysiologiques typiques de ces neurones et sont capables de libérer de la dopamine de manière contrôlée. La culture finale résultant de la différenciation dirigée est composée presque exclusivement de cellules neurales, parmi lesquelles figure un nombre important (~ 70 %) de neurones post-mitotiques dopaminergiques (Figure 2C).
| Figure 1.
Induction neurale de cellules ES humaines déclenchée par des cellules stromales de moelle osseuse. A. Photo en contraste de phase d’une colonie de cellules ES humaines après 28 jours de culture sur une monocouche de cellules MS5. Plusieurs centaines de structures cellulaires en rosette sont visibles (agrandissement en encart). B. Précurseurs neuraux en rosette après 35 jours de culture : immunodétection de la nestine (en vert) et d’un marqueur de prolifération cellulaire (Ki67) (en rouge). Les noyaux sont marqués en bleu par du DAPI. |
| Figure 2.
Caractérisation phénotypique des neurones dopaminergiques mésencéphaliques issus de cellules ES humaines. A. Certains précurseurs de neurones dopaminergiques du mésencéphale, après 42 jours de culture, co-expriment le facteur de transcription En-1 (en vert) et la tyrosine hydroxylase (TH) (en rouge). B. Après 50 jours de culture, les neurones dopaminergiques qui co-expriment la tyrosine hydroxylase (en rouge) et la tubuline ²III (Tuj-1) (en bleu) sont post-mitotiques car ils ne sont pas marqués par l’anticorps Ki67 (en vert). C. Au-delà de 50 jours de culture, près de 70 % des neurones Tuj-1+ (en vert) co-expriment la tyrosine hydroxylase (en rouge). Les noyaux sont marqués en bleu par du DAPI. |
Les essais cliniques de thérapie cellulaire de la maladie de Parkinson à partir de tissus fœtaux ont montré que la qualité tout autant que la quantité des tissus à transplanter étaient essentielles à l’obtention de bons résultats thérapeutiques. La possibilité de produire des neurones dopaminergiques à partir de cellules ES humaines constitue une première étape qui rend maintenant possible la mesure du potentiel thérapeutique de ces cellules dans des modèles animaux de la maladie de Parkinson. La première étape doit d’abord permettre de valider in vivo la qualité du greffon issu de cellules ES humaines. Plusieurs propriétés importantes du greffon nécessitent en particulier d’être confirmées : (1) une absence totale de formation de tumeur doit être observée, démontrant l’absence de contamination par des cellules ES non différenciées, fortement tumorigènes ; (2) les cellules greffées doivent survivre et maintenir, ou même développer durablement, leur phénotype neuronal et dopaminergique in situ après la transplantation ; (3) enfin, les neurones du greffon doivent s’intégrer fonctionnellement dans le cerveau hôte, en commençant par ré-innerver le striatum de la manière la plus complète possible. Les étapes ultérieures consistent ensuite en des tests de comportement permettant de mesurer l’efficacité thérapeutique (diminution durable des déficits moteurs) des greffons dans des modèles animaux de la maladie de Parkinson.
La bonne maîtrise de la différenciation neuronale des cellules ES humaines est clairement indispensable à l’exploration du potentiel thérapeutique de ces cellules pour les maladies neurodégénératives comme la maladie de Parkinson [ 12]. En offrant la possibilité de standardiser les greffons, les cellules ES humaines permettront d’évaluer avec beaucoup plus de rigueur et de facilité, voire d’accroître, les bénéfices thérapeutiques d’une approche substitutive de thérapie cellulaire de la maladie de Parkinson. Il est toutefois encore trop tôt pour déterminer si cette stratégie pourra, à terme, apporter des améliorations des symptômes, meilleures et plus stables que celles apportées par d’autres approches thérapeutiques, pharmacologiques ou chirurgicales, comme, par exemple, les stimulations cérébrales profondes.