Les cellules dendritiques capturent, dégradent et présentent les antigènes aux lymphocytes T sous forme de peptides associés aux molécules du complexe majeur d’histocompatibilité (CMH). Ces cellules possèdent la capacité unique d’activer les lymphocytes T naïfs et de déclencher la réponse immunitaire spécifique. Elles sont présentes dans les tissus périphériques sous un état immature, et se différencient, en réponse à un pathogène, en cellules matures capables de déclencher l’activation des lymphocytes T et leur différenciation en cellules effectrices. La plupart des produits bactériens sont détectés par l’organisme grâce à des récepteurs TLR (Toll-like receptors) exprimés à la surface des cellules dendritiques. L’activation de ces récepteurs entraîne un programme de maturation des cellules dendritiques, se traduisant, au niveau transcriptionnel, par une augmentation de l’expression des molécules du CMH présentant les peptides bactériens et d’autres molécules dites de « co-stimulation » nécessaires à la fonction de stimulation des lymphocytes T. D’autres changements de la machinerie cellulaire responsable de la dégradation et de la présentation des antigènes ont lieu. Pendant ce processus de maturation se produit également une réorganisation du cytosquelette d’actine de la cellule dendritique [ 1], conduisant à l’émergence d’extensions membranaires (dendrites). Cette activité membranaire est généralement sous le contrôle du cytosquelette d’actine, lui-même réglé par les petites protéines de la famille des Rho GTPases [ 2, 3]. Deux études récemment publiées dans Science, l’une menée par le groupe de C. Watts [ 4] et la seconde réalisée dans notre laboratoire [ 5], ont permis de mieux comprendre le rôle de la régulation du cytosquelette d’actine au cours des différentes phases de la présentation antigénique.
L’équipe de C. Watts vient de montrer que l’activation des TLR à la surface des cellules dendritiques immatures conduit à une augmentation de leur capacité de macropinocytose des antigènes et, par conséquent, à une augmentation de la présentation antigénique par les molécules du CMH. Ce phénomène est rapide et transitoire, atteignant un maximum 30 à 45 minutes après l’engagement des TLR, et évolue vers une perte progressive de la capacité d’endocytose. Cette augmentation de l’endocytose des antigènes résulte d’une stimulation de l’activité des extensions membranaires de la cellule dendritique et dépend du cytosquelette d’actine de la cellule dendritique puisqu’elle est inhibée par la cytochalasine D, une substance qui dépolymérise les filaments d’actine. L’activation des TLR, outre la stimulation de l’activité membranaire de la cellule dendritique, conduit à un désassemblage rapide des podosomes, regroupements d’extensions cytoplasmiques riches en actine impliqués dans la migration des cellules [ 6, 7]. La perte de ces structures podosomiques est transitoire, et la cinétique de leur disparition est inversement corrélée à la phase précoce d’augmentation de la capacité d’endocytose des cellules dendritiques après l’activation des TLR.
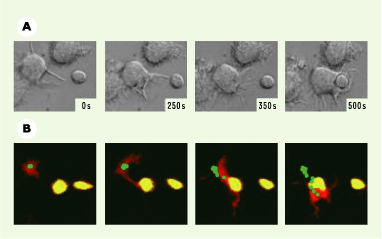
Nous avons pu montrer que la régulation du cytosquelette de la cellule dendritique est également importante au cours des phases plus tardives de la présentation des antigènes aux lymphocytes T. Les cellules dendritiques matures projettent leurs dendrites de façon aléatoire tout autour de leur corps cellulaire au sein des ganglions lymphatiques, jusqu’à ce qu’une dendrite entre en contact avec un lymphocyte T naïf. À la suite de ce contact initial, la cellule dendritique polarise activement ses dendrites vers le lymphocyte T, puis déplace entièrement son corps cellulaire pour aller « enlacer » le lymphocyte T (Figure 1). Ainsi, une interaction très stable s’établit entre la cellule dendritique et le lymphocyte T, et conduit au développement d’une réponse optimale des lymphocytes T. Seules les cellules matures possèdent la capacité d’activer les lymphocytes T naïfs. La polarisation des dendrites vers le lymphocyte T naïf est spécifique de la cellule dendritique mature et n’existe pas pour les cellules dendritiques immatures. Nous avons donc émis l’hypothèse selon laquelle ce phénomène pouvait être indispensable à l’induction d’une réponse efficace des lymphocytes T. Le mécanisme moléculaire qui contrôle l’activité du cytosquelette des cellules dendritiques pendant les phases précoces de l’activation de lymphocytes T a été identifié. Deux petites protéines de la famille des Rho GTPases, Rac1 et Rac2, sont en effet nécessaires à l’établissement de ce phénomène de migration de la cellule dendritique vers le lymphocyte T naïf, et par conséquent à la formation d’une interaction très forte entre les deux types cellulaires. En effet, dans des cellules dendritiques déficientes pour Rac1 et Rac2 (Rac1/2 −/−), ni la formation de dendrites, ni la migration du corps cellulaire vers le lymphocyte T n’ont lieu. Par conséquent, les cellules dendritiques Rac1/2 −/− qui présentent un antigène particulier induisent une activation et une prolifération défectueuse des lymphocytes T spécifiques pour cet antigène. Ces résultats démontrent pour la première fois l’importance des mouvements des dendrites, et donc du cytosquelette d’actine, des cellules dendritiques pour l’activation des lymphocytes T.
| Figure 1.
Interactions entre la cellule dendritique et le lymphocyte T. La cellule dendritique projette ses dendrites de façon aléatoire jusqu’à ce qu’une dendrite rencontre un lymphocyte T. Les dendrites se polarisent alors vers le lymphocyte T, et la cellule dendritique se déplace entièrement pour aller « enlacer » le lymphocyte T. Nous avons pu démontrer ce phénomène in vitro, grâce à la vidéo-microscopie (A) et, au sein des ganglions lymphatiques, grâce à la microscopie à deux-photons (B). Cette interaction très étroite, entre la cellule dendritique et le lymphocyte T, est dépendante du cytosquelette d’actine de la cellule dendritique et nécessaire au développement d’une réponse optimale des lymphocytes T (d’après [5]). |
En conclusion, ces deux études suggèrent qu’afin d’augmenter la capture et la présentation des antigènes à la suite d’une stimulation bactérienne, le cytosquelette d’actine de la cellule dendritique est très rapidement désorganisé, particulièrement au niveau des podosomes. Par la suite, alors que la capacité d’endocytose des antigènes de la cellule dendritique diminue progressivement, son cytosquelette, via les molécules Rac1 et Rac2, se mobilise à nouveau afin de polariser ses dendrites vers le lymphocyte T et d’induire une activation de ce dernier la plus efficace possible.