| |
| Med Sci (Paris). 2005 March; 21(3): 279–283. Published online 2005 March 15. doi: 10.1051/medsci/2005213279.Structure de la sous-unité β du canal calcique : la place du β-interaction domain
Matthieu Rousset, Pierre Charnet,* and Thierry Cens Équipe de Neurobiologie moléculaire, Centre de Recherche de Biochimie macromoléculaire, CNRS FRE 2593, 1919, route de Mende, 34293 Montpellier, France |
L’entrée de calcium dans les cellules par les canaux calciques dépendants du voltage est d’une importance primordiale dans de nombreux processus cellulaires : contraction, sécrétion, activation de gènes… Ces canaux calciques sont des complexes protéiques composés de différentes sous-unités (α2-δ, β et γ) qui sont associées à une protéine centrale (α1), dont une des propriétés importantes est de pouvoir produire, sous l’influence d’une dépolarisation de la membrane plasmique, un pore permettant l’entrée exclusive du calcium dans la cellule (pour revue, voir [
1]). Aux sept gènes connus de sous-unités α1 codant pour des canaux calciques à haut seuil (CaV1.1-4 et CaV2.1-3), peuvent s’associer une des quatre sous-unités β, une des quatre sous-unités α2-δ identifiées, et une des huit sous-unités γ. |
Anatomie fonctionnelle de la sous-unité β La sous-unité β joue certainement le rôle régulateur le plus déterminant sur l’influx calcique, modifiant aussi bien le nombre de canaux à la membrane, que leur sensibilité au potentiel, leurs cinétiques d’ouverture ou de fermeture, leurs régulations par les voies de signalisation intracellulaire, voire même leur pharmacologie [
2]. Les quatre gènes codant pour cette sous-unité produisent des protéines ayant une structure proche, où deux domaines très homologues (C1 et C2) sont entourés de trois régions plus variables (V1, V2 et V3) (Figure 1A).
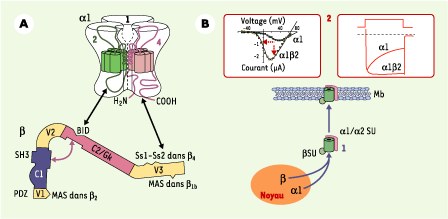
 | Figure 1.
Structure et effets fonctionnels des sous-unités β. A. Structure modulaire typique des sous-unités β des canaux calciques avec deux domaines conservés (C1 et C2) et trois domaines variables (V1-V3). Sur ces domaines sont localisés : les sites d’ancrage au canal générique (BID) et spécifiques (Ss1-Ss2), les domaines SH3 (sur C1) et GK (sur C2) dont l’interaction pourrait être nécessaire pour la fixation de β sur le canal, et les domaines d’ancrage à la membrane (MAS) spécifiques de β 1 et β 2. Une représentation schématique de la sous-unité α1 (le pore du canal) permet de visualiser les régions d’interaction avec β : AID (α interaction domain) (dans la boucle reliant les domaines 1 et 2, en vert) et les parties amino- et carboxyterminales (en noir et rose, respectivement). Seuls les domaines 1, 2 et 4 du canal et les boucles 1-2 et amino- et carboxyterminales sont visualisés ( voir [ 1] pour plus de détails). B. Représentation schématique des deux grandes classes d’effets fonctionnels : (1) sur l’expression et l’adressage du canal. Cet effet passe par le masquage d’un site de rétention dans le réticulum endoplasmique présent dans la région de l’AID. La fixation des petites GTPases de la famille Kir/Gem, en empêchant l’interaction α1-β, démasque le site de rétention et diminue le transit du canal vers la membrane (le petit cercle bleu représente la sous-unité β, le cylindre bleu et son habillage rouge, la sous-unité α1 associée à la sous-unité α2) ; (2) sur les propriétés biophysiques des canaux. Au niveau de la membrane plasmique, l’interaction α1-β augmente la probabilité d’ouverture et modifie fortement les cinétiques d’ouverture et de fermeture (sont visualisés, à gauche, l’augmentation d’amplitude, la sensibilisation au voltage et, à droite, le ralentissement de l’inactivation induit par β2) des différentes classes de canaux calciques à haut seuil. Cet effet ajoute à l’effet sur le transit pour produire des flux calciques de plus grandes amplitudes disponibles pour de plus faibles dépolarisations. La sous-unité béta réduit aussi la sensibilité des canaux à l’inhibition par les sous-unités βγ des protéines G trimériques. |
Sur cette séquence, plusieurs sites jouant un rôle fonctionnel important ont été caractérisés [
3,
4] : (1) un site d’ancrage au canal ou BID (β-interaction domain) d’une trentaine d’acides aminés, localisé au début du domaine C2 [
5]. Plusieurs groupes ont montré que ce site était primordial pour l’interaction entre le domaine C2 et un site particulier appelé AID (α-interaction domain) localisé sur le segment reliant les domaines I et II de la sous-unité α1 des canaux calciques à haut seuil (CaV1.x et CaV2.x). L’interaction C2-AID masque un site de rétention pour le réticulum endoplasmique situé sur la boucle I-II des sous-unités α1 et permet ainsi un meilleur adressage du canal à la membrane, responsable en partie de l’augmentation du courant calcique engendrée par la co-expression de la sous-unité β avec α1 (Figure 1B). Cette interaction provoque également un déplacement de la courbe courant-voltage du canal vers des potentiels hyperpolarisés qui, in fine, augmente la sensibilité du canal au voltage ; (2) un site SH3 (Src homology domain 3) situé dans le domaine C1 et un site possédant une homologie avec les domaines guanylate kinase (GK en C2) [
6], dont les rôles ne sont pas encore précisément connus, mais dont l’agencement rappelle celui des protéines de la famille des guanylate kinases associées à la membrane (MAGUK). Ces protéines facilitent, grâce à leurs multiples sites d’interaction, la création de véritables échafaudages moléculaires aux abords de la membrane cellulaire, permettant ainsi l’organisation des voies de signalisation intracellulaire (pour revue, voir [
7]) ; (3) un site potentiel PDZ d’interaction protéine-protéine, situé en V1 et qui ne serait présent que dans certaines isoformes de sous-unités β [6,
8] ; (4) des sites d’ancrage à la membrane MAS (membrane anchoring sites), localisés respectivement dans les régions V1 et V3 des sous-unités β2 et β1 [
9,
10], et qui permettent à ces deux sous-unités d’être associées à la membrane en l’absence de sous-unité α1. Sur la sous-unité β2, l’accrochage à la membrane, réalisé par la palmitoylation de deux cystéines, assure une immobilisation de la boucle I-II du canal responsable du ralentissement important de l’inactivation obtenu en présence de sous-unité β2 (Figure 1B) ; (5) des sites d’interactions secondaires, soit entre la sous-unité α1 et la partie V3 de certaines sous-unités β [
11,
12] permettant un réglage fin des flux calciques en modifiant les cinétiques et la dépendance vis-à-vis du voltage du canal, soit avec les petites GTPases de la famille Rad-Gem-Kir [
13] empêchant l’accrochage du canal sur β et bloquant ainsi son transit vers la membrane, avec pour conséquence une forte diminution des flux de calcium (Figure 1B). Jusqu’en 2003, le schéma de fonctionnement des sous-unités β semblait donc relativement clair, avec un site principal, le BID/C2, responsable de l’interaction avec le canal et de l’ensemble des modifications de propriétés communes aux quatre sous-unités β, et des sites annexes, souvent situés sur des régions variables, et impliqués dans les modifications spécifiques de chaque sous-unité β. Des données obtenues au cours de ces deux dernières années semblent cependant remettre en cause certaines de ces conclusions. Tout d’abord, de manière analogue aux protéines de la famille MAGUK, il existerait une interaction intramoléculaire entre les domaines SH3 (situé en C1) et GK (situé en C2). Cette interaction serait nécessaire à l’assemblage complet de l’unité SH3 et primordiale pour obtenir un accrochage sur le canal et enregistrer des effets fonctionnels (Figure 2A). Ce couple SH3-GK peut fonctionner aussi bien en intramoléculaire qu’en intermoléculaire. En effet la co-expression de deux sous-unités β fonctionnellement déficientes, mutées respectivement sur leurs SH3 et GK, permet de reconstituer un dimère fonctionnel. Dans ce schéma, les parties variables V1, V2 et V3 ne possèderaient pas de structure clairement identifiée et seraient disponibles pour des interactions spécifiques avec d’autres parties du canal. De tels résultats accordent au BID un rôle nécessaire mais non suffisant [8,
14,
15].
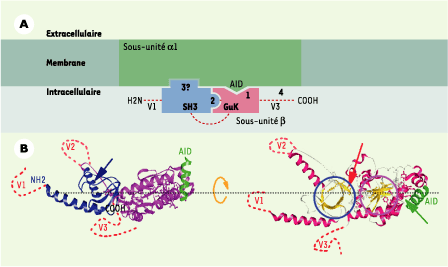
 | Figure 2.
Structure tridimensionnelle de la sous-unité β. A. Schéma représentant les interactions intra- et intermoléculaires entre le canal et les sous-unités β déduit d’expériences de mutagenèse, de biochimie et d’électrophysiologie. Le site primaire d’interaction (1) entre ces deux sous-unités est constitué sur le canal de l’AID et sur la sous-unité β du BID/C2. Cet ancrage pourrait nécessiter une interaction intramoléculaire (2) entre les domaines SH3 et GK retrouvés sur toutes les sous-unités β. Une interaction entre le domaine SH3 et le canal a également été proposée (3) [ 15]. Enfin, des sites d’interaction secondaires spécifiques de chacune des sous-unités β existent dans les parties variables (4).B. Structure tridimensionnelle de la sous-unité β déduite des données de cristallographie. Partie gauche : les parties variables V1, V2 et V3 qui n’ont pu être cristallisées sont schématisées en pointillé. Les deux domaines SH3 et GK sont visibles en bleu et rose, l’AID, partie du canal interagissant avec la sous-unité β et cocristallisée, est visible en vert. Le BID, séquence qui semble plus importante pour l’intégralité structurale de la sous-unité que pour son interaction directe avec le canal, comme cela avait été initialement proposé, est distinguée par la représentation en bâtonnet de ses acides aminés. La deuxième hélice du domaine SH3 qui occupe le site de fixation des partenaires polyproline est identifiée par la flèche bleue (d’après [
16], protein data base accession number : 1T3L). On peut noter le confinement de la zone d’interaction avec le canal, laissant libre une large surface de la sous-unité pour d’autres interactions. Partie droite : même structure, mais avec une symbolisation colorée de la structure secondaire : feuillet β en jaune et hélice α en rouge (à l’exception de l’AID en vert). Les cercles bleu et rose isolent les cœurs en feuillets β des domaines SH3 et GK respectivement. La flèche rouge signale le 5e feuillet du domaine SH3 appartenant à la région C2 et constitué du début de la séquence BID. La flèche verte montre la partie du BID qui participe aux interactions avec le canal (AID en vert). La stabilité de ces interactions nécessite l’intégralité du domaine C2. Cette structure a subi une légère rotation autour d’un axe horizontal par rapport à celle de la partie gauche. |
|
Structure tridimensionnelle de la sous-unité β Ce schéma structural a été partiellement confirmé par la détermination de la structure tridimensionnelle d’une sous-unité β minimale, composée des domaines C1-C2, cristallisée seule ou en présence d’AID (Figure 2B) [16–
18]. Deux domaines, d’un volume de 94 x 54 x 48 Å, similaires aux domaines SH3 et GK, sont clairement visibles sur la structure cristalline (en bleu et rose, respectivement, sur la Figure 2B). Ils confirment l’affiliation de la sous-unité β à la famille des protéines MAGUK. Le domaine SH3 est constitué de cinq feuillets dont le dernier, à l’instar des autres membres de la famille MAGUK, bien que faisant formellement partie de structure SH3, est en réalité situé sur le domaine C2 et constitue la partie aminoterminale du BID (séquence figurée avec ses résidus sur la partie GK, flèche rouge, Figure 2B). Une des deux hélices de ce domaine (flèche bleue, Figure 2B) occupe le site habituel des ligands SH3, et le rend ainsi inaccessible à la fixation d’autres partenaires à sites polyproline. Le cœur du domaine GK est, quant à lui, composé de cinq feuillets β parallèles (cercle rose, Figure 2B) pris en tenaille par cinq hélices α. La substitution du site de fixation pour le GMP par une autre séquence ear lobe et la conformation générale de ce domaine, proche d’une structure de type ApoGK (ouverte), suggèrent que les sous-unités β ne peuvent certainement fixer ni l’ATP, ni le GMP, mais rendent possible la fixation d’autres petites molécules. L’information la plus surprenante de cette structure est la localisation du site de fixation de l’AID (flèche verte, Figure 2B) sur le domaine GK de la sous-unité β. Ce site se trouve dans une poche complexe où vient habituellement se fixer l’ATP chez les autres membres de la famille des MAGUK. La fixation de l’AID est principalement gouvernée par des interactions de type Van der Waals et hydrophobes, confirmant le rôle important accordé par des expériences de mutagenèse au niveau de certains acides aminés apolaires [4]. Cette fixation ne fait intervenir directement que la partie carboxyterminale du BID, la partie aminoterminale participant plus à la stabilisation de la structure de la poche, qu’à des interactions directes avec le canal [16–18]. Il semble, par ailleurs, que la liaison avec la sous-unité β fasse subir à l’AID un changement de conformation qui favoriserait la stabilité de l’interaction et participerait sans doute à la genèse des conséquences électrophysiologiques enregistrées lors de la co-expression de la sous-unité β. Les mécanismes proposés pour ces modifications de la dépendance vis-à-vis du voltage et des cinétiques d’activation et d’inactivation font intervenir des variations du potentiel électrostatique à la sortie du canal [
19] et des réductions de la mobilité de certaines parties du canal [9,
20]. Enfin, la fixation possible de ce domaine GK à des moteurs moléculaires pourrait être impliquée dans les mécanismes d’adressage propres aux sous-unités β [
21]. La structure proposée pour les trois sous-unités (β2, β3 et β4) semble en accord sur tous ces points, bien que la structure des différentes régions variables (V1, V2 et V3) n’ait pas pu être déterminée. Dans chacune de ces études, la fixation de l’AID se fait sur une extrémité restreinte de la sous-unité β laissant une large surface libre pour des interactions avec d’autres parties du canal [11, 12], d’autres partenaires protéiques [13,
22], ou des constituants de la membrane cytoplasmique [9,
23,
24]. Cependant, dans tous les cas, l’interaction entre les domaines SH3 et GK apparaît plus lâche que dans les autres protéines de la famille MAGUK (par exemple, PSD95 [
17]). L’importance fonctionnelle de ce relâchement n’est pas connue, mais il pourrait expliquer les résultats contradictoires obtenus par la co-expression de sous-unités β invalidées pour leur domaine SH3, montrant soit un effet important du seul domaine GK sur l’expression [8, 17,
25], les cinétiques d’inactivation et de facilitation [
26,
27] ou la régulation par les protéines G [23] des canaux CaV2.1 (Figure 3), soit aucun effet en l’absence de domaine SH3 fonctionnel sur les canaux CaV1.2 [15].
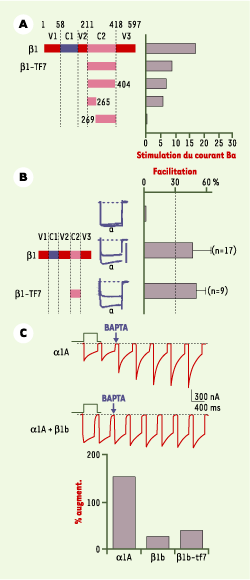
 | Figure 3.
Exemples du rôle fonctionnel du domaine C2 isolé. Dans les trois cas, la sous-unité β est progressivement tronquée pour être réduite à son domaine C2. A. L’augmentation du courant calcique induite par la coexpression de ces différentes troncations avec les canaux Ca V2.1 est largement conservée tant que le domaine C2 (AID) est préservé (d’après [ 25]). B. L’augmentation du courant transitant par les canaux Ca V1.2 induite par une forte prédépolarisation (facilitation dépendante du voltage des canaux L) n’est enregistrée que lorsqu’une sous-unité β possédant au moins le domaine C2 est coexprimée (d’après [ 26]). C. Le canal CaV2.1, exprimé seul, est sous l’influence d’une inhibition tonique par les protéines G sensible au Ca 2+ et qui se révèle par une augmentation du courant consécutive à l’injection d’un chélateur calcique (ici le BAPTA, voir [ 23]). La coexpression de la sous-unité β (ici β 1b), ou de son seul domaine C2 (nommé β 1b-TF7), est suffisante pour empêcher cette inhibition tonique, suggérant que ce domaine isolé peut remplir les fonctions de β. |
|
La détermination de la structure tridimensionnelle des sous-unités β va permettre une réinterprétation du rôle du BID dans l’interaction avec le canal et offrir de nouvelles pistes pour mieux comprendre les effets pléiotropiques de ce régulateur majeur de l’influx calcique. |
Les auteurs tiennent à remercier le CNRS, l’Inserm, l’Association Française contre les Myopathies, l’Association pour la Recherche contre le Cancer, la Fédération pour la Recherche sur le Cerveau et la Fondation Simone et Cino del Duca pour leur soutien financier et les Drs I. Lefevre, P.F. Mery et M. De Waard pour la lecture critique de ce manuscrit.
|
1. Nargeot J, Charnet P. Diversité moléculaire des canaux calciques : du gène à la fonction. Med Sci (Paris) 1994; 12 : 1293–308. 2. Cens T, Restituito S, Rousset M, et al. Roles of β subunits in voltage-gated calcium channel functions. In : Zamponi GW, ed. Voltage-gated calcium channels. Georgetown, TX : Landes Bioscience, 2004. 3. Dolphin AC. Beta subunits of voltage-gated calcium channels. J Bioenerg Biomembr 2003; 35 : 599–620. 4. Walker D, De Waard M. Subunit interaction sites in voltage-dependent Ca2+ channels : role in channel function. Trends Neurosci 1998; 21 : 148–54. 5. De Waard M, Scott VE, Pragnell M, et al. Identification of critical amino acids involved in alpha1-beta interaction in voltage-dependent Ca2+ channels. FEBS Lett 1996; 380 : 272–6. 6. Hanlon MR, Berrow NS, Dolphin AC, et al. Modelling of a voltage-dependent Ca2+ channel beta subunit as a basis for understanding its functional properties. FEBS Lett 1999; 445 : 366–70. 7. Fanning AS, Anderson JM. Protein modules as organizers of membrane structure. Curr Opin Cell Biol 1999; 11 : 432–9. 8. McGee AW, Nunziato DA, Maltez JM, et al. Calcium channel function regulated by the SH3-GK module in beta subunits. Neuron 2004; 42 : 89–99. 9. Restituito S, Cens T, Barrere C, et al. The β2a subunit is a molecular groom for the Ca2+ channel inactivation gate. J Neurosci 2000; 20 : 9046–52. 10. Bogdanov Y, Brice NL, Canti C, et al. Acidic motif responsible for plasma membrane association of the voltage-dependent calcium channel beta1b subunit. Eur J Neurosci 2000; 12 : 894–902. 11. Walker D, Bichet D, Campbell KP, et al. A beta 4 isoform-specific interaction site in the carboxyl-terminal region of the voltage-dependent Ca2+ channel alpha 1A subunit. J Biol Chem 1998; 273 : 2361–7. 12. Walker D, Bichet D, Geib S, et al. A new beta subtype-specific interaction in alpha1A subunit controls P/Q- type Ca2+ channel activation. J Biol Chem 1999; 274 : 12383–90. 13. Beguin P, Nagashima K, Gonoi T, et al. Regulation of Ca2+ channel expression at the cell surface by the small G-protein kir/Gem. Nature 2001; 411 : 701–6. 14. Opatowsky Y, Chomsky-Hecht O, Kang MG, et al. The voltage-dependent calcium channel beta subunit contains two stable interacting domains. J Biol Chem 2003; 278 : 52323–32. 15. Takahashi SX, Miriyala J, Colecraft HM. Membrane-associated guanylate kinaselike properties of beta-subunits required for modulation of voltage-dependent Ca2+ channels. Proc Natl Acad Sci USA 2004; 101 : 7193–8. 16. Opatowsky Y, Chen CC, Campbell KP, et al. Structural analysis of the voltage-dependent calcium channel beta subunit functional core and its complex with the alpha1 interaction domain. Neuron 2004; 42 : 387–99. 17. Chen YH, Li MH, Zhang Y, et al. Structural basis of the alpha1-beta subunit interaction of voltage-gated Ca2+ channels. Nature 2004; 429 : 675–80. 18. Van Petegem F, Clark KA, Chatelain FC, et al. Structure of a complex between a voltage-gated calcium channel beta-subunit and an alpha-subunit domain. Nature 2004; 429 : 671–5. 19. Cens T, Dalle C, Charnet P. Expression of beta subunit modulates surface potential sensing by calcium channels. Pflug Arch 1998; 435 : 865–7. 20. Cens T, Restituito S, Galas S, et al. Voltage and calcium use the same molecular determinants to inactivate calcium channels. J Biol Chem 1999; 274 : 5483–90. 21. Brice NL, Dolphin AC. Differential plasma membrane targeting of voltage-dependent calcium channel subunits expressed in a polarized epithelial cell line. J Physiol (Lond) 1999; 515 : 685–94. 22. Finlin BS, Crump SM, Satin J, et al. Regulation of voltage-gated calcium channel activity by the Rem and Rad GTPases. Proc Natl Acad Sci USA 2003; 100 : 14469–74. 23. Rousset M, Cens T, Gouin-Charnet A, et al. Ca2+ and phosphatidylinositol 4,5-bisphosphate stabilize a G-beta-gamma-sensitive state of CaV2 Ca2+ channels. J Biol Chem 2004; 279 : 14619–30. 24. Wu L, Bauer CS, Zhen XG, et al. Dual regulation of voltage-gated calcium channels by PtdIns(4,5)P(2). Nature 2002; 419 : 947–52. 25. De Waard M, Pragnell M, Campbell KP. Ca2+ channel regulation by a conserved beta subunit domain. Neuron 1994; 13 : 495–503. 26. Cens T, Restituito S, Vallentin A, et al. Promotion and inhibition of L-type Ca2+ channel facilitation by distinct domains of the subunit. J Biol Chem 1998; 273 : 18308–15. 27. Cens T, Restituito S, Charnet P. Regulation of Ca-sensitive inactivation of a 1-type Ca2+ channel by specific domains of beta subunits. FEBS Lett 1999; 450 : 17–22. |