Jusqu’à une époque récente, le monde des arrestines n’était familier qu’à un nombre restreint de biologistes s’intéressant aux récepteurs à sept domaines transmembranaires (7TM) couplés aux protéines G hétérotrimériques. Comme leur nom l’indique, les arrestines sont des protéines dont la plus ancienne fonction connue est d’arrêter, en partenariat avec les G protein-coupled receptor kinases (GRK), des protéine kinases spécifiques des 7TM, le signal cellulaire propagé par cette famille de récepteurs via les protéines G. Cette fonction est essentielle car, pour être opérationnelle, toute régulation cellulaire par des récepteurs nécessite d’être limitée dans le temps. Ainsi, les arrestines visuelles des cônes et des bâtonnets interrompent l’activation de la transducine (la protéine G rétinienne) par la rhodopsine exposée à la lumière. Dans tous les autres tissus, les béta-arrestines 1 et 2 (bétaarr1 et bétaarr2) interagissent avec la plupart des autres 7TM en assurant le même type de régulation, connu sous le terme générique de désensibilisation.
Un premier saut quantitatif dans l’élucidation des fonctions des bétaarr remonte à environ huit ans quand il a été rapporté que ces molécules étaient également nécessaires au phénomène d’endocytose des 7TM activés par leurs ligands. Comme nous l’avons rappellé plus haut, la plupart des 7TM sont phosphorylés et désensibilisés après activation. La translocation des bétaarr du cytosol vers les récepteurs activés permet d’établir un pont moléculaire entre ces derniers et des molécules de la machinerie d’endocytose comme la protéine adaptatrice AP2 et la clathrine. Les récepteurs sont alors mobilisés vers les puits recouverts de clathrine de la voie d’endocytose constitutive et internalisés. L’importance biologique de ce phénomène et le devenir des récepteurs internalisés ont fait l’objet d’un récent article dans médecine/sciences [ 1].
L’explosion de nos connaissances sur les multiples fonctions des bétaarr remonte aux cinq dernières années (pour revue, voir [ 2– 4]). De protéines purement régulatrices, les bétaarr sont progressivement apparues comme des protéines possédant de nombreuses fonctions de transduction du signal, et cela de façon souvent indépendante de l’activation des protéines G hétérotrimériques. À titre d’exemple, les bétaarr participent au contrôle de la prolifération et de la survie cellulaire par les 7TM. Elles activent, en effet, la tyrosine kinase Src et sont des protéines d’échafaudage des cascades d’activation des mitogen-activated protein kinases ERK 1/2 et JNK3. S’il a été bien établi que l’ubiquitinylation des bétaarr par l’E3 ubiquitine-ligase Mdm2 participe à la régulation de l’endocytose des 7TM, l’interaction des bétaarr avec Mdm2 pourrait, de plus, contrôler la concentration et la fonction de la protéine anti-oncogénique p53, dont la dégradation par le protéasome est sous le contrôle de l’ubiquitinylation par Mdm2. Les voies de signalisation impliquant les bétaarr concernent également les réponses inflammatoires et l’immunité. L’invalidation des gènes codant pour les bétaarr chez la souris (qui est létale quand l’expression de bétaarr1 et bétaarr2 est abolie simultanément) et les résultats d’expériences d’interférence par l’ARN indiquent que les bétaarr jouent un rôle essentiel dans la migration leucocytaire. Par exemple, des souris dont le gène codant pour la bétaarr2 a été invalidé et sensibilisées à un pneumallergène ne développent pas de réaction asthmatique à cause d’un défaut de migration pulmonaire de lymphocytes T. Dans un contexte différent, la bétaarr2 limite la réaction inflammatoire en stabilisant, par interaction directe, la protéine IkappaBalpha qui inhibe le médiateur inflammatoire NF-kappaB. Cette stabilisation est accrue par la stimulation béta-adrénergique et constitue l’un des mécanismes par lesquels le système nerveux sympathique contrôle le système immunitaire. La liste des fonctions biologiques impliquant les bétaarr est trop longue pour pouvoir être développée ici de façon exhaustive. Elle est probablement loin d’être complète car des études récentes indiquent que les bétaarr pourraient avoir également des fonctions nucléaires et qu’elles pourraient participer au contrôle des voies de signalisation déclenchées par des récepteurs d’autres familles, comme les récepteurs de l’insuline, des low density lipoproteins (LDL) ou du transforming growth factor béta.
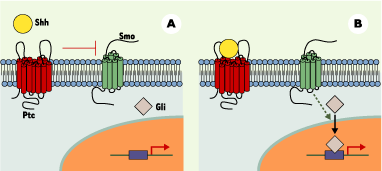
Les bétaarr ont fait une entrée remarquée dans le domaine du développement à l’occasion de la publication récente de deux articles indiquant le rôle joué par bétaarr2 dans le contrôle de la fonction de la protéine Smoothened (Smo) [ 5, 6]. Smo est une protéine à sept domaines transmembranaires participant à la voie de signalisation de Sonic Hedgehog (Shh), une glycoprotéine essentielle à la structuration embryonnaire. Chez l’adulte, cette voie de signalisation joue un rôle dans l’homéostasie tissulaire comme le montre le fait que son activation constitutive peut être associée à des cancers. Shh est sécrétée et agit à distance en se liant à une protéine comprenant 12 domaines transmembranaires, connue sous le nom de Patched (Ptc). En l’absence de Shh, Ptc inhibe de façon catalytique Smo (Figure 1). L’inactivation de Ptc par la liaison de Shh permet l’activation de Smo qui conduit à l’activation des facteurs de transcription de la famille Gli. Malgré des progrès récents [ 7] dans la compréhension des mécanismes moléculaires mis en jeu dans cette voie de signalisation, initialement étudiée par des approches génétiques chez la drosophile, plusieurs zones d’ombre persistent.
| Figure 1. Le signal Hedgehog. A. À l’état basal, la protéine à 12 régions transmembranaires Patched (Ptc) exerce une inhibition tonique sur Smoothened (Smo). Les facteurs transcriptionnels de la famille Gli ne sont pas transloqués dans le noyau et n’activent pas leurs gènes cibles. B. Quand Sonic Hedgehog (Shh) se lie à Ptc, l’inhibition de Smo est levée et l’activation de la voie de signalisation en aval de Smo permet le passage nucléaire de Gli et l’activation des gènes cibles. |
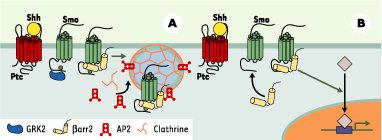
Dans l’un des deux articles mentionnés plus haut [5], il est rapporté que deux protéines, connues pour contrôler les 7TM couplés aux protéines G, étaient capables d’interagir avec Smo une fois que l’inhibition exercée par Ptc sur ce dernier était levée à la suite de la liaison de Shh. Une de ces protéines est la kinase GRK2, qui phosphoryle Smo, l’autre est la bétaarr2. Comme pour les 7TM classiques, la translocation de bétaarr2 vers Smo conduit à son internalisation via les puits recouverts de clathtrine (Figure 2A). L’interaction entre bétaarr2 et Smo pourrait aussi être la première étape d’une nouvelle voie de signalisation en aval de Smo impliquant bétaarr2 (Figure 2B). Cette hypothèse est démontrée dans le deuxième article [6]. En utilisant des morpholino-antisens ciblant la bétaarr2 du poisson zèbre, les auteurs ont montré que l’inhibition d’expression de bétaarr2 était associée à des anomalies phénotypiques très proches de celles qui sont observées lors de la mutation du gène Smo. De plus, l’expression de gènes cibles de la voie Shh, étudiée par hybridation in situ avec des sondes spécifiques, est éteinte dans les embryons injectés avec les morpholino-bétaarr2. Enfin, l’activation constitutive de la voie Shh en aval de Smo peut rétablir un phénotype normal dans les embryons injectés avec des morpholino-antisens anti-bétaarr2.
Malgré le fait que les mécanismes moléculaires mis en jeu restent en grande partie à élucider, les données publiées dans ces deux articles indiquent que bétaarr2 contrôle la voie de signalisation de Shh chez le poisson zèbre pendant l’embryogenèse et que cette régulation est probablement relayée par l’interaction de bétaarr2 avec Smo.
Nul doute que les béta-arrestines ne vont pas encore arrêter de nous surprendre…
| Figure 2. Rôles de GRK2 et bétaarr2 dans la voie de signalisation Hedgehog. A. La liaison de Sonic Hedgehog (Shh) à Patched (Ptc) et l’activation de Smoothened (Smo) qui en résulte conduisent à l’interaction de Smo avec la kinase GRK2 qui le phosphoryle. La bétaarr2 est transloquée vers Smo et des interactions moléculaires s’établissent alors entre bétaarr2 et des protéines de la machinerie d’endocytose comme la protéine adaptatrice AP2 et la clathrine. Le complexe Smo-bétaarr2 s’accumule dans les puits recouverts et est internalisé. B. Au cours du développement embryonnaire du poisson zèbre, bétaarr2 est un intermédiaire de la voie de signalisation Shh en aval de Smo et en amont de l’activation transcriptionnelle. Les mécanismes moléculaires mis en jeu restent encore à élucider. |