| |
| Med Sci (Paris). 2005 October; 21(10): 849–853. Published online 2005 October 15. doi: 10.1051/medsci/20052110849.Le complexe GIT-PIX : Une plate-forme de régulation des GTPases ARF et Rac/Cdc42 Maria Zeniou-Meyer,1 Jean-Paul Borg,2 and Nicolas Vitale1* 1CNRS UPR-2356, Neurotransmission et sécrétion neuroendocrine, Centre de neurochimie, 5 rue Blaise Pascal 67084 Strasbourg, France 2Pharmacologie moléculaire, Institut de cancérologie de Marseille, UMR 599, Inserm, Institut Paoli-Calmettes, 27, boulevard Leï Roure, 13009 Marseille, France |
Les protéines G monomériques constituent une superfamille de protéines de plus de 100 membres qui existent chez les eucaryotes, de la levure à l’homme. Grâce à leur nature de commutateur moléculaire, cyclant entre une forme inactive liée au GDP et une forme active liée au GTP, les protéines G monomériques jouent un rôle déterminant dans la régulation temporelle, mais aussi spatiale, de nombreuses fonctions cellulaires. Les effets biologiques pléiotropes d’une GTPase donnée sont attribués à sa capacité d’interagir et de moduler différents effecteurs cellulaires. L’existence de réseaux de signalisation complexes liés aux protéines G permet en outre l’existence de multiples points de convergence, offrant ainsi la possibilité d’effets coopératifs ou antagonistes en fonction des cascades de signalisation impliquées. L’action des GTPases s’établit dans le cadre d’un réseau d’effecteurs, mais également de régulateurs. En effet, l’étape limitante de la réaction d’échange GDP/GTP est la dissociation du GDP de la forme inactive de la protéine G. Cette réaction est extrêmement lente et requiert d’être stimulée par un facteur d’échange nucléotidique (GEF) dont l’activité est souvent régulée en amont. Ces facteurs d’échange interagissent en premier lieu avec la protéine G liée au GDP, puis catalysent la dissociation du GDP pour former un complexe binaire qui va ensuite lier le GTP. Les formes inactives des protéines G des familles Rho/Rac/Cdc42 et Rab interagissent également avec des protéines GDI (GDP dissociation inhibitor) qui régulent le cycle d’échange GDP/GTP, ainsi que leur translocation entre le cytosol et la membrane. L’activité GTPase provoquant l’hydrolyse du GTP, est intrinsèque aux protéines G monomériques mais d’intensité variable, très faible pour la majorité, voire quasiment nulle pour les GTPases ARF. Cette réaction est catalysée par les GAP (GTPase activating protein) qui forment une troisième famille de protéines régulatrices des protéines G. |
PIX : une famille de facteurs d’échange pour les GTPases Rac/Cdc42 Le premier membre de la famille des protéines PIX (PAK-interacting exchange factor) aussi appelées Cool (cloned out of library) a été identifié par sa capacité à interagir avec des séquences riches en résidus proline grâce à son domaine SH3 [
1]. La famille PIX contient deux membres chez les mammifères : αPIX et βPIX. βPIX existe sous deux formes, β1 et β2, qui se distinguent par la présence d’une extrémité coiled-coil en position carboxyterminale dans β1. Le messager de β1PIX peut, en outre, subir un épissage alternatif pour produire trois variants (a, b, c) [
2]. De plus, la forme β1PIX-a peut être exprimée sous une forme longue de 85 kDa et une forme courte de 50 kDa [
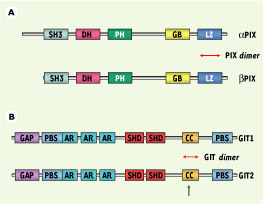
3]. Toutes ces isoformes partagent la même organisation avec un domaine SH3, un domaine DH (Dbl homology) qui catalyse l’échange nucléotidique sur Rac et Cdc42, un domaine PH (pleckstrin homology) de liaison aux phospholipides, un domaine GB permettant l’interaction avec les protéines GIT et un domaine leucine zipper impliqué dans l’homodimérisation de PIX (Figure 1). L’association de PIX avec un compartiment membranaire et secondairement son activité d’échange pour Rac/Cdc42 semblent être également régulées par phosphorylation sur les résidus sérine 525 et thréonine 526 et par son interaction avec des phospholipides.  | Figure 1.
Organisation schématique des protéines PIX et GIT. Chaque domaine est représenté par un rectangle de couleur différente dont la dimension n’est pas représentative de la taille du domaine. A. Pour aPIX et βPIX : SH3 : domaine d’homologie avec Src 3 ; DH : domaine d’homologie avec la protéine Dbl ; PH : domaine d’homologie avec la pleckstrine ; GB : domaine de liaison à GIT ; LZ : domaine leucine zipper. Le domaine de dimérisation des protéines PIX est indiquée par la double flèche rouge. B. Pour GIT1 et GIT2 : GAP : domaine GTPase-activating protein ; AR : domaines ankyrine ; SHD : Spa2 homology domain ; CC : domaine coiled-coil ; PBS : site de liaison à la paxilline. Le domaine de dimérisation des protéines GIT est indiqué par la double flèche rouge. La flèche verte indique le site d’épissage majeur de GIT2. |
Le domaine SH3 de PIX lie une séquence riche en résidus proline de PAK (p21-activated serine threonine kinase) et le complexe PAK-PIX a été décrit au niveau des points focaux des jonctions adhérentes en contact avec les matrices extracellulaires [
4]. Le domaine leucine zipper semble nécessaire à l’initiation du remodelage du cytosquelette et à la formation de replis membranaires [
5]. PIX présente une activité GEF pour Rac et Cdc42 in vitro et in vivo et joue un rôle dans la motilité cellulaire et la formation de neurites in vitro [4,
6]. Enfin, une mutation dans le gène codant pour aPIX provoque une forme non syndromique de retard mental chez l’homme, une donnée qui souligne la place importante de ce facteur d’échange dans le développement neuronal [
7]. |
GIT : une famille de protéines GAP pour les GTPases ARF Originellement identifiées par leur capacité à interagir avec GRK2, une sérine/thréonine kinase couplée aux protéines G hétérotrimériques [
8], les protéines GIT ont ensuite été isolées de façon indépendante par différents groupes qui ont démontré leur interaction avec d’autres partenaires (PIX, FAK et paxilline). Cela a permis d’obtenir un grand nombre d’informations sur les protéines GIT, mais a également installé une certaine confusion dans la nomenclature de cette famille de protéines. En résumé, il existe deux gènes GIT qui ont été appelés respectivement, GIT1/Cat-1/p95-APP1 et GIT2/KIAA0148/Cat-2/p95-PKL/p95-APP2. Les gènes GIT1 et GIT2 sont localisés au niveau des régions chromosomiques 17p11.2 et 12q24.1 humaines [
9]. À ce jour, ces locus n’ont pas été associés à des maladies. Tandis que GIT1 semble être uniquement exprimé sous sa forme longue (761 à 770 acides aminés selon l’espèce), GIT2 présente un épissage alternatif important produisant une forme courte et une forme longue [9,
10]. Le domaine fonctionnel le plus caractéristique des protéines GIT est le domaine GAP pour les GTPases de la famille ARF (Figure 1). Ce domaine, situé en position aminoterminale, contient une séquence consensus en doigt de zinc (CX2CX16CX2C) ainsi qu’un résidu arginine important pour la catalyse de l’activité d’hydrolyse du GTP par les GTPases [
11]. De fait, in vitro, les protéines recombinantes GIT1 et GIT2 lient une quantité stœchiométrique de zinc et ont une activité GAP pour les différents membres de la famille ARF [
12]. Comme pour d’autres ARF-GAP, cette activité enzymatique est régulée par des phospholipides [12]. Trois domaines ankyrine sont retrouvés en position carboxyterminale du domaine GAP. Pour d’autres ARF-GAP, il a été postulé que ces domaines servent de support à la structure en doigt de zinc responsable de l’activité GAP [
13]. Deux séries de 30 résidus constituent ensuite des domaines SHD (Spa2 homology domain) qui sont responsables de la liaison aux protéines PIX [
14,
15]. Ces domaines SHD semblent aussi interagir directement avec la kinase des points d’adhérence focaux FAK [14]. On retrouve ensuite un domaine coiled-coil qui permet une dimérisation des protéines GIT [
16]. Finalement, deux autres domaines de liaison au domaine LD4 de la paxilline (PBS, paxillin binding site) ont été identifiés [10,
17]. La première fonction cellulaire identifiée de GIT1 est son rôle dans le recyclage de certains récepteurs couplés aux protéines G hétérotrimériques (RCPG) qui utilisent la voie d’endocytose par puits de clathrine, mais également dans celui d’autres récepteurs tels que le récepteur de l’EGF (epidermal growth factor) [9,
18]. Cet effet semble lié à la capacité de GIT1 à réguler le cycle de la GTPase ARF6 en favorisant la forme liée au GDP [
19]. Une autre fonction très étudiée de GIT est son implication dans la motilité cellulaire. La capacité de GIT1 à promouvoir la migration cellulaire semble corrélée à sa compétence pour déplacer la paxilline des points focaux en arrière de la cellule en migration et à faciliter la localisation de PIX et PAK au niveau de nouvelles structures adhésives en avant de la cellule, ainsi qu’à sa capacité à coordonner le transport vésiculaire dans cette direction [14]. Par ailleurs, les protéines GIT1 semblent impliquées avec Rac et PAK dans la formation des protrusions [
20]. L’implication de GIT dans la formation des synapses et la morphologie des dendrites a également été suggérée [
21]. Sur le plan physiopathologique, une étude récente vient de mettre en évidence une interaction entre GIT1 et la protéine hungtingtine et a démontré la dégradation spécifique de GIT1 au cours du développement de la maladie de Huntington [
22]. Ainsi, les protéines GIT semblent intervenir dans des fonctions cellulaires impliquant des modulations du réseau cytosquelettique et une dynamique vésiculaire importante. GIT pourrait donc participer à la régulation de ces deux aspects de la vie cellulaire. |
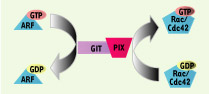
Le complexe GIT-PIX : association transitoire ou plate-forme stable ? De nombreuses études ont montré l’existence de complexes protéiques impliquant les protéines GIT, PIX et PAK dans des lignées cellulaires et des tissus de natures variées [9, 10, 15, 20]. Ceux-ci peuvent contenir GIT1 ou GIT2, αPIX ou βPIX et PAK1 ou PAK2 ou PAK3. Ces complexes modulaires contiennent donc à la fois une GAP pour les ARF, une GEF pour Rac/Cdc42 et une sérine/thréonine kinase capable de fixer et d’être activée par Rac/Cdc42. Ainsi, ces complexes peuvent théoriquement lier ces protéines G et promouvoir leur activation/désactivation. Les protéines GIT et PIX ayant des localisations subcellulaires diversifiées et discrètes (contacts focaux, jonctions cellulaires), le complexe PIX-GIT présent dans un compartiment subcellulaire donné, pourrait, tel un aiguillage, induire le changement d’une voie de signalisation ARF-dépendante vers une voie dépendante de Rac/Cdc42 (Figure 2).  | Figure 2.
Le complexe GIT/PIX et les conséquences moléculaires de son assemblage. Les protéines GIT et PIX peuvent interagir pour former un complexe protéique. Au sein de ce complexe, GIT peut inactiver la GTPase monomérique ARF grâce à sa capacité à stimuler l’hydrolyse du GTP (activité GAP). PIX est, quant à lui, un facteur d’échange nucléotidique (GEF) pour les protéines G Rac/Cdc42 et peut donc les activer. Par conséquent, l’assemblage du complexe GIT/PIX dans un compartiment cellulaire donné pourrait induire le changement d’une voie de signalisation dépendante de ARF vers une voie dépendante de Rac/Cdc42. |
À ce jour, la plupart des études se fondent sur le modèle d’une inter-action GIT-PIX qui serait régulée et assument donc que les deux protéines se dissocient pour jouer leurs rôles de façon indépendante [10, 14, 20]. Cependant, une étude récente démontre l’existence d’un complexe oligomérique très stable constitué des protéines GIT et PIX [16]. En effet, des expériences de filtration sur gel et d’immunoprécipitation ont permis de montrer que des protéines recombinantes GIT et PIX forment des homo- et des hétérodimères. De plus, un oligomère composé de molécules natives de PIX et GIT a été mis en évidence à partir d’extraits cellulaires. Cependant, la taille précise de ce complexe, sa stœchiométrie et sa distribution subcellulaire restent totalement inconnues à ce jour. Dans ce contexte, il devient primordial de déterminer si les protéines sous forme d’oligomère présentent les mêmes activités d’échange pour Rac/Cdc42 et GAP pour les protéines ARF. |
Le suppresseur de tumeur Scribble recrute le complexe GIT-PIX et régule son activité La purification de complexes protéiques par des techniques biochimiques couplées à l’identification des protéines par spectrométrie de masse est une technique très utilisée pour obtenir des informations fonctionnelles sur une protéine donnée. Au cours d’expériences visant à purifier les complexes protéiques associés au suppresseur de tumeur Scribble, nous avons isolé le complexe βPIX-GIT1 et démontré l’inter-action directe entre ces protéines [
23]. Scribble a été originellement identifié chez la drosophile comme une protéine présente dans les jonctions cellulaires et impliquée dans l’homéostasie épithéliale de par sa probable activité dans le trafic vésiculaire ou la compartimentalisation subcellulaire de récepteurs de surface. Le complexe Scribble-βPIX-GIT1 est présent dans les tissus épithéliaux et neuronaux et est localisé dans les jonctions cellulaires et les compartiments pré- et postsynaptiques. Dans un modèle de cellules neuro-endocrines (cellules de phéochromocytome PC12), le complexe βPIX-GIT1 est recruté à la membrane plasmique à la suite d’une élévation de la concentration intracellulaire de calcium et y est retenu grâce à son interaction avec Scribble. Le complexe membranaire Scribble-βPIX-GIT1 ainsi formé promeut la sécrétion régulée de vésicules d’exocytose dont le contenu (hormones et polypeptides) participe à la communication cellulaire. La localisation sous-membranaire de ce complexe pourrait indiquer une connexion à des récepteurs de surface en contact avec le milieu extérieur. De fait, nous avons dernièrement démontré que le récepteur de la thyrotropine (TSHR) couplé aux protéines G hétérotrimériques est régulé par le complexe Scribble-βPIX-GIT1 [
24]. Une interaction directe entre les domaines PDZ de Scribble et l’extrémité carboxyterminale TVL (Thr-Val-Leu) de TSHR a été mise en évidence. Des expériences d’extinction par interférence ARN ont permis de suggérer que ce complexe joue un rôle primordial dans le recyclage de TSHR, probablement par l’intermédiaire d’ARF6 qui est activée après à une liaison de la thyrotropine sur son récepteur. Cette GTPase possède des propriétés régulatrices sur des enzymes modulant la composition lipidique des membranes et sur l’état de polymérisation du cytosquelette d’actine [
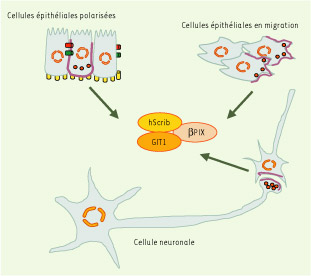
25]. Étant donné l’implication de GIT1 dans le recyclage de différents types de récepteurs, il paraît très prometteur de tester l’implication du complexe Scribble-βPIX-GIT1 dans le cycle de ces récepteurs. On peut s’attendre à ce que le cycle des récepteurs présentant une séquence consensus de liaison aux domaines PDZ en position carboxyterminale fasse également intervenir Scribble ou d’autres protéines à domaine PDZ. Une fois encore, Scribble pourrait donc jouer un rôle d’ancrage à la membrane pour les activités GAP et GEF du complexe PIX-GIT et ainsi moduler l’endocytose et le recyclage de TSHR. Ainsi, c’est probablement en modulant le niveau d’activation d’ARF6 et de Rac/Cdc42 que le complexe Scribble-βPIX-GIT1 module les fonctions sécrétoire, endocytique et de recyclage. L’ensemble de ces résultats apporte de la consistance à l’hypothèse selon laquelle l’altération de la polarité cellulaire observée dans le cadre d’une perte de fonction de Scribble pourrait être liée à un défaut d’adressage vésiculaire. Plus généralement, ils indiquent que le complexe Scribble-βPIX-GIT1 joue un rôle important dans l’homéostasie de la membrane plasmique en contrôlant l’apport de vésicules dans différents contextes cellulaires (Figure 3).  | Figure 3.
Localisation subcellulaire du complexe hScrib/βPIX/GIT1 dans les cellules polarisées. Le complexe (en mauve) est retrouvé au niveau des membranes basolatérales dans les cellules épithéliales polarisées, au front de migration des cellules épithéliales en migration et dans les régions pré- et postsynaptiques des neurones. Ces zones représentent des sites d’apport membranaire très actifs (vésicules rouges). |
|
Chez la drosophile, la perte de fonction de Scribble entraîne une prolifération accentuée des cellules épithéliales et la formation de tumeurs néoplasiques. L’expression de l’orthologue humain de Scribble restaure la polarité et entraîne une régression importante des tumeurs. La mise en évidence d’un lien direct entre le suppresseur de tumeur Scribble et le complexe GIT-PIX, un régulateur du niveau d’activation des GTPases Rac/Cdc42 et ARF, ouvre de nouvelles perspectives quant à la compréhension des mécanismes de tumorigenèse. En effet, l’existence d’un complexe macromoléculaire contenant un nombre modulable de molécules GIT et PIX permet à la cellule de concentrer en un point précis une plate-forme de régulation de l’état de polymérisation du cytosquelette et de la dynamique des membranes. Ces résultats illustrent la richesse des voies de signalisation mises en œuvre pour permettre le maintien de l’homéostasie cellulaire et permettent d’entrevoir l’identification de cibles thérapeutiques visant à pallier des déséquilibres pathologiques comme les cancers. Il est cependant indéniable que la compréhension de ces mécanismes dans leur ensemble nécessitera des études portant sur les multiples facettes du complexe macromoléculaire GIT-PIX. |
M. Zeniou-Meyer est allocataire d’une bourse postdoctorale du CNRS. Les auteurs remercient tous leurs collaborateurs ayant contribué aux travaux rapportés dans cet article. Nous remercions également Marie-France Bader et Philippe Chavrier pour leur lecture critique du manuscrit.
|
1. Oh WK, Yoo JC, Jo D, et al. Cloning of a SH3 domain-containing proline-rich protein, p85SPR, and its localization in focal adhesion. Biochem Biophys Res Commun 1997; 235 : 794–8. 2. Kim S, Kim T, Lee D, et al. Molecular cloning of neuronally expressed mouse betaPix isoforms. Biochem Biophys Res Commun 2000; 272 : 721–5. 3. Bagrodia S, Taylor SJ, Jordon KA, et al. A novel regulator of p21-activated kinases. J Biol Chem 1998; 273 : 23633–6. 4. Manser E, Loo TH, Koh CG, et al. PAK kinases are directly coupled to the PIX family of nucleotide exchange factors. Mol Cell 1998; 1 : 183–92. 5. Kim S, Lee SH, Park D. Leucine zipper-mediated homodimerization of the p21-activated kinase-interacting factor, beta Pix. Implication for a role in cytoskeletal reorganization. J Biol Chem 2001; 276 : 10581–4. 6. Shin EY, Shin KS, Lee CS, et al. Phosphorylation of p85 beta PIX, a Rac/Cdc42-specific guanine nucleotide exchange factor, via the Ras/ERK/PAK2 pathway is required for basic fibroblast growth factor-induced neurite outgrowth. J Biol Chem 2002; 277 : 44417–30. 7. Kutsche K, Yntema H, Brandt A, et al. Mutations in ARHGEF6, encoding a guanine nucleotide exchange factor for Rho GTPases, in patients with X-linked mental retardation. Nat Genet 2000; 26 : 247–50. 8. Premont RT, Claing A, Vitale N, et al. Beta2-adrenergic receptor regulation by GIT1, a G protein-coupled receptor kinase-associated ADP ribosylation factor GTPase-activating protein. Proc Natl Acad Sci USA 1998; 95 : 14082–7. 9. Premont RT, Claing A, Vitale N, et al. The GIT family of ADP-ribosylation factor GTPase-activating proteins. Functional diversity of GIT2 through alternative splicing. J Biol Chem 2000; 275 : 22373–80. 10. Turner CE, Brown MC, Perrotta JA, et al. Paxillin LD4 motif binds PAK and PIX through a novel 95-kD ankyrin repeat, ARF-GAP protein : a role in cytoskeletal remodeling. J Cell Biol 1999; 145 : 851–63. 11. Donaldson JG, Jackson CL. Regulators and effectors of the ARF GTPases. Curr Opin Cell Biol 2000; 12 : 475–82. 12. Vitale N, Patton WA, Moss J, et al. GIT proteins, a novel family of phosphatidylinositol 3, 4, 5-trisphosphate-stimulated GTPase-activating proteins for ARF6. J Biol Chem 2000; 275 : 13901–6. 13. Goldberg J. Structural and functional analysis of the ARF1-ARFGAP complex reveals a role for coatomer in GTP hydrolysis. Cell 1999; 96 : 893–902. 14. Zhao ZS, Manser E, Loo TH, Lim L. Coupling of PAK-interacting exchange factor PIX to GIT1 promotes focal complex disassembly. Mol Cell Biol 2000; 20 : 6354–63. 15. Bagrodia S, Bailey D, Lenard Z, et al. A tyrosine-phosphorylated protein that binds to an important regulatory region on the cool family of p21-activated kinase-binding proteins. J Biol Chem 1999; 274 : 22393–400. 16. Premont RT, Perry SJ, Schmalzigaug R, et al. The GIT/PIX complex : an oligomeric assembly of GIT family ARF GTPase-activating proteins and PIX family Rac1/Cdc42 guanine nucleotide exchange factors. Cell Signal 2004; 16 : 1001–11. 17. Mazaki Y, Hashimoto S, Okawa K, et al. An ADP-ribosylation factor GTPase-activating protein Git2-short/KIAA0148 is involved in subcellular localization of paxillin and actin cytoskeletal organization. Mol Biol Cell 2001; 12 : 645–62. 18. Claing A, Perry SJ, Achiriloaie M, et al. Multiple endocytic pathways of G protein-coupled receptors delineated by GIT1 sensitivity. Proc Natl Acad Sci USA 2000; 97 : 1119–24. 19. Claing A, Chen W, Miller WE, et al. Beta-arrestin-mediated ADP-ribosylation factor 6 activation and beta 2-adrenergic receptor endocytosis. J Biol Chem 2001; 276 : 42509–13. 20. Di Cesare A, Paris S, Albertinazzi C, et al. p95-APP1 links membrane transport to Rac-mediated reorganization of actin. Nat Cell Biol 2000; 2 : 521–30. 21. Zhang H, Webb DJ, Asmussen H, Horwitz AF. Synapse formation is regulated by the signaling adaptor GIT1. J Cell Biol 2003; 161 : 131–42. 22. Goehler H, Lalowski M, Stelzl U, et al. A protein interaction network links GIT1, an enhancer of huntingtin aggregation, to Huntington’s disease. Mol Cell 2004; 15 : 853–65. 23. Audebert S, Navarro C, Nourry C, et al. Mammalian Scribble forms a tight complex with the betaPIX exchange factor. Curr Biol 2004; 14 : 987–95. 24. Lahuna O, Quellari M, Achard C, et al. Thyrotropin receptor trafficking relies on the hScrib-betaPIX-GIT1-ARF6 pathway. EMBO J 2005; 24 : 1364–74. 25. Gasman S, Chasserot-Golaz S, Bader MF, Vitale N. Regulation of exocytosis in adrenal chromaffin cells : focus on ARF and Rho GTPases. Cell Signal 2003; 15 : 893–9. |