| |
| Med Sci (Paris). 2005 November; 21(11): 907–909. Published online 2005 November 15. doi: 10.1051/medsci/20052111907.Guerre des sexes chez une fourmi : reproduction clonale des mâles et des reines Arnaud Estoup* and Denis Fournier* INRA, Centre de Biologie et de Gestion des Populations, Campus International de Baillarguet, 34988 Montferrier/Lez, France. Behavioral and Evolutionary Ecology, CP 160/12, Université Libre de Bruxelles, Belgique MeSH keywords: Animaux, Fourmis, Femelle, Fécondation, Génotype, Guyana, Haploïdie, Mâle, Répétitions microsatellites, Parthénogenèse, Reproduction, Spécificité d'espèce |
La reproduction sexuée est indispensable à la survie de nombreuses espèces végétales et animales et représente le mode de reproduction le plus répandu dans le monde du vivant. Elle est néanmoins la source de conflits évolutifs majeurs tant entre sexes qu’au sein des génomes. Une étude à laquelle ont participé des chercheurs de l’INRA, du CNRS, de l’IRD, et de l’Université de Lausanne, a mis en évidence chez une espèce de fourmi, Wasmannia auropunctata, un système de reproduction unique. Les reines sont des clones de leur mère, les mâles sont des clones de leur père et seules les ouvrières, stériles, sont issues d’une reproduction sexuée entre reines et mâles. Dans ce système de reproduction, la transmission des gènes d’une génération à l’autre semble avoir été optimisée au prix d’une étonnante guerre des sexes entre reines et mâles. |
La petite fourmi de feu Wasmannia auropunctata est originaire des forêts d’Amérique centrale et du Sud (Figure 1). Introduite par l’homme, elle a envahi la ceinture tropicale, aux Antilles, en Afrique et dans les milieux insulaires du Pacifique [
1]. Son invasion parmi les autres espèces locales représente une menace pour la biodiversité. C’est pour étudier les facteurs évolutifs à l’origine de ce succès invasif que nous avons analysé à l’aide de marqueurs génétiques hypervariables (c’est-à-dire des microsatellites [
2]) les structures populationnelles et reproductives de cette espèce.  | Figure 1.
Wasmannia auropunctata: reines, ouvrières et larves (photo © Christian König). |
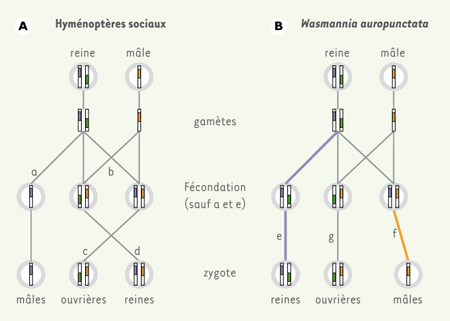
Chez les fourmis, comme chez tous les hyménoptères sociaux, les reines pondent deux types d’œufs: des œufs haploïdes, non fécondés, qui ne contiennent par conséquent que le patrimoine génétique de la mère, et des œufs fécondés, diploïdes, qui contiennent pour moitié le patrimoine génétique de la mère et pour l’autre le patrimoine génétique du père (Figure 2). Les œufs haploïdes donneront naissance à des mâles, alors que les œufs diploïdes conduiront soit à la production de reines qui assureront la reproduction, soit à la production d’ouvrières, souvent stériles, qui assureront les soins aux jeunes. Le passage vers la voie royale ou vers la voie ouvrière est piloté par des gènes qui sont eux-mêmes sous l’influence de l’environnement. De par ce déterminisme haplo-diploïde du sexe, les mâles n’ont pas de père et leur unique moyen pour transmettre leurs gènes à la génération suivante implique la production de femelles reproductrices via la reproduction sexuée (Figure 2). Nos recherches menées sur le mode de reproduction de W. auropunctata ont mis en lumière un système de reproduction particulier et unique: les mâles ont un père mais pas de mère, et les reines ont une mère mais de père. Le détail de ces résultats a été récemment publié dans la revue Nature [
3].  | Figure 2.
Système reproducteur «classique» des hyménoptères sociaux (A) et de la fourmi Wasmannia auropunctata
(B). Classiquement, les mâles sont issus d’œufs non fécondés (a: parthénogenèse arrhénotoque) et ont, par conséquent, une copie unique d’origine maternelle de chaque gène. Les femelles, elles, sont issues d’œufs fertilisés diploïdes (b) et peuvent se développer soit en femelles stériles (c), soit en femelles reproductrices (d). Chez W. auropunctata, les nouvelles reines (e) sont génétiquement identiques à leur mère (parthénogenèse thélytoque), les mâles (f) sont génétiquement identiques à leur père (vraisemblablement via un mécanisme d’élimination du génome maternel) et seules les ouvrières (g) sont issues d’une reproduction sexuée classique. |
|
Des fourmis issues de 34 nids répartis dans 5 sites en Guyane ont été collectées et génotypées à 11 locus microsatellites. L’analyse génétique de 142 reines a montré que leurs génomes étaient toujours identiques au sein d’un nid, et pour 3 sites sur les 5 étudiés. Ces résultats révèlent que les reines sont issues d’une reproduction clonale par parthénogenèse améiotique, c’est-à-dire sans ou avec de très rares événements de recombinaison (Figure 2). Un système de reproduction clonale des reines a récemment été décrit chez une autre espèce de fourmi, Cataglyphis cursor [
4], mais, chez cette espèce, l’occurrence de nombreux cas de recombinaison indique un mécanisme de type parthénogenèse automictique [4]. |
Des ouvrières produites par sexualité Les génotypes des ouvrières comporte à chaque locus analysé un des deux allèles portés par les reines, mais également un allèle nouveau. En disséquant la spermathèque des reines (réceptacle où sont stockés les spermatozoïdes après que la reine a été inséminée) et en génotypant son contenu spermatique, on s’aperçoit que ce nouvel allèle correspond à celui observé pour le sperme de la spermathèque. Les ouvrières sont donc issues d’une reproduction sexuée classique (Figure 2). |
Les mâles se clonent eux-mêmes Le génotypage du sperme contenu dans les spermathèques révèle également que toutes les reines d’un nid ont été fécondées par des mâles portant strictement le même génotype à chacun des 11 locus microsatellites étudiés. Par ailleurs, des analyses complémentaires montrent que les fils ont le même génotype que les pères, et sont haploïdes. L’ensemble de ces résultats révèle que les mâles sont également issus d’un processus de clonage faisant cette fois-ci intervenir uniquement le génome paternel (Figure 2). Le mécanisme cytogénétique à l’origine du clonage des mâles reste à élucider. Il est possible que cette reproduction clonale se fasse par élimination de la partie maternelle du génome lors de la fécondation de l’ovule par un spermatozoïde haploïde. L’individu qui en résulte est donc un mâle haploïde, possédant strictement le même génotype que son père, à l’exception du génome mitochondrial maternel. De nombreuses espèces d’insectes, de poissons et d’amphibiens possèdent un système de reproduction similaire mais fondé sur l’élimination du génome paternel [
5,
6], alors que, chez la petite fourmi de feu, c’est le génome maternel qui est éliminé. Le mécanisme pour expliquer la clonalité mâle de W. auropunctata pourrait être défini comme de l’androgenèse, pour peu que la définition de ce terme, restreinte aux organismes diploïdes [
7], soit étendue aux organismes haploïdes. L’androgenèse a été démontrée chez trois espèces diplo-diploïdes [7]. Chez le phasme Bacillus grandii, un ovule ayant dégénéré la totalité de son génome sous forme de globules polaires est fécondé par deux spermatozoïdes haploïdes. Chez plusieurs espèces de palourdes d’eau douce du genre Corbicula, un ovule dégénéré est fécondé par un gamète diploïde produit certainement sans méiose. Enfin, le cyprès Cupressus dupreziana se reproduit via une cellule mâle diploïde qui se développe dans un cône femelle mais sans fusionner avec un ovule. |
Les facteurs évolutifs à l’origine de la mise en place du système de reproduction unique de W. auropunctata sont en cours d’étude. Il est possible que le profil reproductif observé reflète un cas extrême de conflit entre sexes. Ainsi, dans la bataille évolutive qui oppose les sexes pour la transmission des gènes d’une génération à l’autre, les reines de la petite fourmi de feu pourraient avoir adopté un mode de reproduction clonal afin d’optimiser la transmission de leurs gènes. Ce système reproducteur pose un problème sérieux pour les mâles qui se retrouvent dans un cul-de-sac évolutif, leurs gènes n’étant jamais transmis au fil des générations. En une apparente réponse à ce conflit entre sexes, les mâles transmettent leur génome à leurs fils, également par clonalité. Quant au maintien de la reproduction sexuée pour la production d’ouvrières, elle permet de produire une force ouvrière génétiquement diversifiée à même de mieux résister aux attaques de parasites et aux fluctuations de l’environnement [
8]. Dans la mesure où ces ouvrières sont stériles, cette reproduction sexuée n’aboutit pas au mélange des gènes mâles et femelles à la génération suivante. Cette absence de flux de gènes entre mâles et femelles conduit à une différenciation génétique nette des pools alléliques des deux sexes. Cette évolution séparée des deux génomes suscite de nombreuses questions dont celle d’une classification des deux sexes en deux espèces différentes (et pour la première fois d’une espèce dont tous les individus seraient des mâles), puisque mâles et femelles ont des trajectoires évolutives séparées et n’ont pas de descendance fertile [
9]. Dans ce système, les deux sexes demeurent affiliés non pas par des échanges de gènes mais par une surprenante exploitation parasitique des femelles par les mâles et par la production en commun d’ouvrières stériles assurant le fonctionnement de la colonie. |
1. Wetterer JK, Porter SD. The little fire ant, Wasmannia auropunctata: distribution, impact, and control. Sociobiology 2003; 42 : 1–41. 2. Fournier D, Foucaud J, Loiseau A, et al. Characterization and PCR multiplexing of polymorphic microsatellite loci for the invasive ant Wasmannia auropunctata. Mol Ecol Notes 2005; 5 : 239–42. 3. Fournier D, Estoup A, Orivel J, et al. Clonal reproduction by males and females in the little fire ant. Nature 2005; 435 : 1230–4. 4. Pearcy M, Aron S, Doums C, Keller L. Conditional use of sex and parthenogenesis for worker and queen production in ants. Science 2004; 306 : 1780–2. 5. Simon JC, Delmotte F, Rispe C, Crease T. Phylogenetic relationships between parthenogens and their sexual relatives: the possible routes to parthenogenesis in animals. Biol J Linnean Soc 2003; 79 : 151–63. 6. Normark BB. The evolution of alternative genetic systems in insects. Annu Rev Entomol 2003; 48 : 397–423. 7. McKone MJ, Halpern SL. The evolution of androgenesis. Am Naturalist 2003; 161 : 641–56. 8. Cole BJ, Wiernasz DC. The selective advantage of low relatedness. Science 1999; 285 : 891–3. 9. Queller D. Males from mars. Nature 2005; 435 : 1167–8. |