La maladie de Parkinson (MP) est une affection neurodégénérative progressive, comportant cliniquement la triade bradykinésie, rigidité et tremblement au repos. La prévalence de cette maladie dépasse 2 % chez les personnes âgées de plus de 65 ans. La MP est caractérisée par la perte massive et préférentielle des neurones dopaminergiques de la substantia nigra pars compacta, le plus souvent associée à des inclusions cytoplasmiques éosinophiles, les corps de Lewy, présents dans les neurones survivants.
L’identification de rares familles dans lesquelles la MP ségrègeait selon un mode mendélien a permis d’énormes progrès dans la compréhension de la physiopathologie de cette maladie, notamment grâce à l’identification et à la caractérisation des gènes responsables de ces formes monogéniques. Le gène LRRK2 (leucine-rich repeat kinase 2) est le dernier-né de cette liste croissante de gènes.
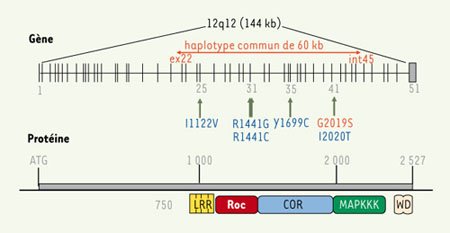
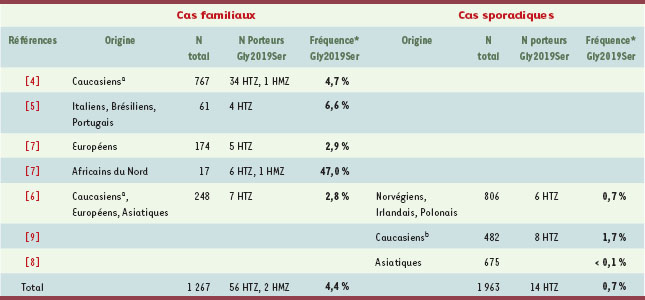
Le gène LRRK2, localisé sur le chromosome 12 initialement dans une famille japonaise [ 1], a été identifié récemment par deux groupes indépendants [ 2, 3] qui ont rapporté six mutations faux-sens différentes (Figure 1). La plupart de ces mutations sont rares, à l’exception de la mutation Arg1441Gly commune aux familles parkinsoniennes d’origine basque [2], d’où le nom de « Dardarine » donné initialement à LRRK2, du mot basque dardara signifiant « tremblement ». Le gène de 144 kb qui code LRRK2, est constitué de 51 exons et s’exprime dans différents tissus, y compris le système nerveux central. La protéine de 2 527 acides aminés appartient à la superfamille de protéines appelées ROCO qui sont des Ras/GTPases. À côté des deux domaines ROC (Ras of complex proteins) et COR (C-terminal of Roc), communs à toutes les protéines de cette superfamille, on trouve aussi d’autres domaines fonctionnels conservés : 12 répétitions riches en leucine (LRR) et un domaine WD40. LRRK2 possède aussi un domaine tyrosine kinase (MAPKKK pour mitogen activated protein kinase kinase kinase). L’importance de LRRK2 dans l’étiologie de la MP a été soulignée récemment par l’identification d’une mutation fréquente, Gly2019Ser, dans l’exon 41, décrite dans des formes familiales de MP, présentant une transmission autosomique dominante. Alors que sa fréquence varie de 3 % à 6 % dans des cas familiaux de MP, originaires d’Europe [ 4– 7], elle atteint plus de 40 % chez des patients d’origine nord-africaine [7]. En revanche, elle semble être très rare dans la population asiatique (< 0,1 %) [ 8] (Tableau I). De façon intéressante, la mutation Gly2019Ser est également détectée chez 1 % à 2 % des cas apparemment sporadiques [ 9], représentant la mutation la plus commune, identifiée jusqu’à présent dans la MP. L’analyse de familles avec cette mutation suggère l’existence d’une pénétrance incomplète, dépendante de l’âge, ce qui remet en cause la distinction entre cas familiaux et cas apparemment sporadiques de la MP. De même, ce phénomène pourrait également expliquer la présence de quelques rares témoins sains, sans histoire familiale connue de la maladie et porteurs de la mutation Gly2019Ser [7] parmi les milliers de témoins sains testés.
| Figure 1.
Le gène qui code LRRK2 (leucine-rich repeat kinase 2)
est localisé sur le chromosome 12 en q12. Il s’étend sur une région de 144 kb et contient 51 exons. La localisation exonique de toutes les mutations pathogéniques identifiées par le groupe de Paisan-Ruiz et al. [2] et de Zimprich et al. [3], ainsi que la mutation la plus fréquente de LRRK2, G2019S (en rouge) sont indiquées. Toutes ces mutations sont localisées dans les domaines fonctionnels prédits de la protéine LRRK2 : LRR (leucine rich repeat) ; ROC (Ras of complex proteins) ; COR (C-terminal of Roc) ; MAPKKK (mitogen activated protein kinase kinase kinase). L’haplotype commun partagé par les porteurs de la mutation Gly2019Ser (en rouge) s’étend sur une région minimale de 60 kb limitée par des marqueurs situés dans l’exon 22 et l’intron 45 du gène codant LRRK2. |
| Tableau I.
Fréquence de la mutation Gly2019Ser (exon 41 du gène codant pour LRRK2) dans les formes familiales et sporadiques de la maladie de Parkinson. HTZ : hétérozygote ; HMZ : homozygote. aAmérique du Nord ; bAngleterre ; *Fréquence allélique de la mutation Gly2019Ser. |
Les porteurs de la mutation Gly2019Ser de LRRK2 partagent un même haplotype, suggérant un effet fondateur unique. En typant 21 marqueurs dans la région 12q12, comprenant 17 marqueurs de type microsatellite et 4 SNP (single nucleotide polymorphism) intragéniques, dans 13 familles américaines et européennes porteuses de la mutation Gly2019Ser, l’équipe de Kachergus [ 6] a identifié un haplotype commun s’étendant sur une région de 145-154 kb. Notre étude, portant sur 13 autres familles d’origine européenne et nord-africaine, a permis de réduire cette région à 60 kb et de retrouver non seulement cet effet fondateur dans d’autres pays européens, mais aussi de l’étendre à l’Afrique du nord (Figure 1). En combinant nos données à celles de Kachergus, nous avons pu dater l’origine de cette mutation au XIIIe siècle [ 10]. Ces observations sont d’une grande importance car, contrairement au concept initial, elles montrent que même les formes tardives de MP ont une composante génétique non négligeable.
En raison de la forte prévalence des mutations identifiées dans le gène et en particulier de la mutation Gly2019Ser dans l’exon 41, LRRK2 est d’une importance majeure, à la fois pour le diagnostic moléculaire et le conseil génétique chez des patients ayant une histoire familiale de MP, et voire même chez des cas apparemment isolés. Lorsque les paramètres de transmission, en particulier la pénétrance, seront mieux connus, il sera alors possible de répondre à des demandes de tests présymptomatiques émanant d’apparentés de porteurs de la mutation.
Cependant, le rôle pathogène de LRRK2 reste à élucider, en particulier le caractère de dominance observé pour les mutations de ce gène. En effet, les rares porteurs homozygotes de la mutation Gly2019Ser ont un phénotype identique à celui des porteurs hétérozygotes, ce qui n’est en faveur ni d’un mécanisme de gain de fonction, ni de celui d’une perte de fonction [7].
Enfin, une autre caractéristique des porteurs de mutations de LRRK2 est le phénotype associé. Bien que le tableau clinique ressemble à celui d’un syndrome parkinsonien typique, l’âge de début de la maladie est remarquablement variable, allant de 35 à 78 ans. La neuropathologie des cas avec mutations de LRRK2 est très polymorphe, allant d’une dégénérescence pure de la substantia nigra sans corps de Lewy à une accumulation d’α-synucléine sous forme de corps de Lewy limités au tronc cérébral ou s’étendant dans le cortex en passant par des cas avec accumulation de protéine tau. Ces observations remettent ainsi en cause les critères de diagnostic neuropathologique de la MP et le rôle des inclusions intracytoplasmiques dans la dégénérescence des neurones de la substantia nigra. Ainsi, la grande variabilité clinique et neuropathologique associée aux mutations de LRRK2 suggère que l’altération d’une même voie métabolique peut conduire à une dégénérescence neuronale qui peut revêtir des caractères histopathologiques très différents.