| |
| Med Sci (Paris). 2006 January; 22(1): 81–83. Published online 2006 January 15. doi: 10.1051/medsci/200622181.Un deficit en noradrénaline à l’origine des troubles respiratoires dans un modèle animal du syndrome de Rett Laurent Villard* and Jean-Christophe Roux* Inserm U.491, Faculté de Médecine La Timone,27, boulevard Jean Moulin, 13385 Marseille Cedex 5, France MeSH keywords: Animaux, Système cardiovasculaire, Modèles animaux de maladie humaine, Évolution de la maladie, Humains, Souris, Système nerveux, Norépinéphrine, Prévalence, Maladies de l'appareil respiratoire, Syndrome de Rett |
Ce syndrome a été décrit pour la première fois en 1966 par le pédiatre autrichien Andréas Rett. Pendant plus de trente ans, le syndrome de Rett (SR) restera une énigme embarrassante pour les chercheurs et douloureuse pour les familles de malades. Il s’agit d’une sévère encéphalopathie d’origine génétique qui touche essentiellement les filles avec une prévalence d’environ 1/15 000 naissances [
1,
2]. Il s’agit également du syndrome entraînant le plus grand nombre de retards mentaux profonds chez les femmes. Cette encéphalopathie progressive est sporadique dans plus de 99 % des cas. Les individus atteints présentent un développement normal in utero et pendant les 6 à 18 premiers mois après la naissance. Ce développement s’arrête par la suite avec une perte de certaines acquisitions comme le langage et la marche, suivie d’un arrêt brutal du développement du cerveau (installation d’une microcéphalie acquise) associé à un profond handicap mental. Les autres signes cliniques associés sont des troubles locomoteurs, une mauvaise régulation thermique, une mauvaise circulation sanguine et des phases d’hyperventilation suivies de périodes d’apnées profondes indiquant de probables déficits du système nerveux autonome. Des études haplotypiques réalisées chez quelques rares cas de sœurs et demi-sœurs atteintes du syndrome de Rett finirent cependant par préciser la localisation du gène responsable sur le chromosome X. Les premières mutations chez des enfants atteints du SR ont été rapportées en 1999 [
3]. Le gène responsable s’appelle MeCP2. Il code pour une protéine (methyl-CpG-binding-protein 2) ayant une fonction supposée de répresseur transcriptionnel. Des mutations de tous types ont été retrouvées depuis dans ce gène, chez plus de 90 % des patientes présentant un syndrome de Rett typique [
4]. Ces mutations sont le plus souvent d’origine paternelle et surviennent de novo. MeCP2 appartient à une famille de protéines capables de s’associer à l’ADN méthylé pour moduler l’activité du génome. Étant donnée cette fonction présomptive, plusieurs équipes ont entrepris d’analyser le transcriptome des patientes atteintes de syndrome de Rett à la recherche des gènes dérégulés en espérant que cela permettrait d’expliquer la pathologie. Malheureusement, ces travaux n’ont pas permis de mettre en évidence des dérèglements significatifs [
5]. Des études menées par notre équipe ont confirmé ces résultats, y compris en utilisant des lignées clonales exprimant uniquement la forme mutée de la protéine. MeCP2 n’est donc peut-être pas le régulateur global de la transcription que l’on croit, et il nous a paru nécessaire d’explorer des voies alternatives de recherche. |
Les modèles murins du syndrome de Rett Afin de progresser dans la compréhension de la physiopathologie du SR, il était important de pouvoir disposer d’un modèle animal. Sous l’impulsion de la Fondation américaine du syndrome de Rett (RSRF), trois équipes ont engendré des modèles de souris invalidées pour le gène Mecp2 et qui présentent des phénotypes très proches [
6–
8]. Dans les trois modèles, les souris sont normales à la naissance et les premiers signes cliniques apparaissent environ 5 semaines plus tard chez les mâles. Il s’agit d’une « nervosité » marquée, de troubles moteurs et d’épisodes de dysfonctionnement respiratoire. Les femelles hétérozygotes sont normales pendant les 4 premiers mois après la naissance puis elles montrent une hypoactivité, une démarche chancelante et des épisodes de respiration anormale. Par ailleurs, les souris mâles meurent vers le 2e mois et des analyses histologiques ont montré une réduction de la taille et du poids du cerveau, en accord avec ce que l’on sait du phénotype chez l’homme. Ces travaux indiquent que les signes cliniques pré sentés par ces souris sont très similaires à ceux rencontrés chez les patientes atteintes du syndrome de Rett et que ces animaux sont potentiellement un « bon » modèle. |
Les souris déficientes en Mecp2 ont des troubles respiratoires Un certain nombre d’anomalies fonctionnelles observées chez les enfants atteints de syndrome de Rett indiquent clairement que le système nerveux autonome est affecté. L’existence de troubles ventilatoires chez les patientes atteintes du syndrome de Rett est largement documentée [
9,
10]. En revanche, l’origine de ces troubles est encore inconnue. Dans ce contexte, nous avons démarré des travaux concernant la maturation périnatale du réseau nerveux contrôlant la respiration chez les souris déficientes en Mecp2, en collaboration avec l’équipe du Dr Hilaire (CNRS, Marseille, France) et du Dr Ramirez (University of Chicago, États-Unis). Ces travaux viennent d’être publiés [
11]. Nous avons tout d’abord étudié in vivo la maturation de la respiration chez la souris déficiente en Mecp2. Nos résultats montrent que la respiration est normale à la naissance et au cours du premier mois postnatal. Les semaines suivantes, les souris commencent à présenter des apnées qui vont augmenter dramatiquement en nombre et en intensité jusqu’à la mort de l’animal, vers l’âge de deux mois. Nous avons voulu pousser l’analogie avec le SR un peu plus loin. En effet, nous savons que les filles atteintes du syndrome de Rett ont une respiration qui s’améliore au cours du sommeil, même lorsqu’elles rencontrent des problèmes respiratoires importants pendant l’éveil. Nous avons voulu simuler un état de sommeil chez la souris déficiente en Mecp2 en réalisant une anesthésie légère. Nos résultats montrent une normalisation de la respiration, ce qui indique probablement que le générateur du rythme respiratoire est capable de fonctionner correctement. Ainsi, les dysfonctionnements respiratoires in vivo chez les souris déficientes en Mecp2 pourraient être dus à des insuffisances touchant des boucles de régulation. |
Un déficit noradrénergique à l’origine des troubles Afin de comprendre l’origine des troubles fonctionnels, nous avons disséqué les structures bulbo-pontiques impliquées dans le contrôle respiratoire et mis en évidence que les souris déficientes en Mecp2 ont des déficits profonds en noradrénaline à l’âge de 1 mois, juste avant que les premiers symptômes n’apparaissent. Par la suite, lorsque les souris présentent une respiration anormale, caractérisée par des apnées récurrentes, les contenus en noradrénaline et sérotonine sont tous deux déficitaires. Étant donné le rôle clé que jouent les bioamines dans le contrôle respiratoire, nous pensons avoir identifié une des causes probables des troubles respiratoires. Différentes possibilités peuvent expliquer ces déficits bioaminergiques, par exemple une réduction du nombre de neurones ou une diminution de leur activité. Nos données histologiques indiquent que le nombre de neurones catécholaminergiques A1C1 et A2C2 marqués est réduit (de 30 % à 40 %) dans le bulbe rachidien des souris déficientes en Mecp2 (Figures 1 et 2), alors que le nombre de neurones sérotoninergiques est conservé, ce qui suggère une possible baisse d’activité de ces derniers dans les stades tardifs de la maladie. Nos travaux actuels consistent à décrypter les mécanismes pouvant conduire à cette importante atteinte cellulaire. Ces résultats permettent de valider le modèle murin pour l’étude des troubles respiratoires dans le syndrome de Rett et mettent en évidence pour la première fois des anomalies au niveau cellulaire dans ce modèle.  | Figure 1.
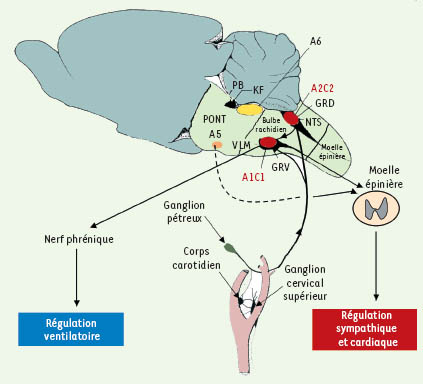
Représentation schématique des voies nerveuses respiratoires et cardiovasculaires. A1, A2, A5, A6 : groupes de neurones noradrénergiques du tronc cérébral. C1 et C2 : groupe de neurones adrénergiques du tronc cérébral.
NTS : nucleus tractus solitarius. VLM :
ventrolateral medulla. GRV : groupe respiratoire ventral. GRD : groupe respiratoire dorsal. Les groupes A1C1 et A2C2 présentés en rouge sont les groupes catécholaminergiques sévèrement touchés chez les souris déficientes en Mecp2. |
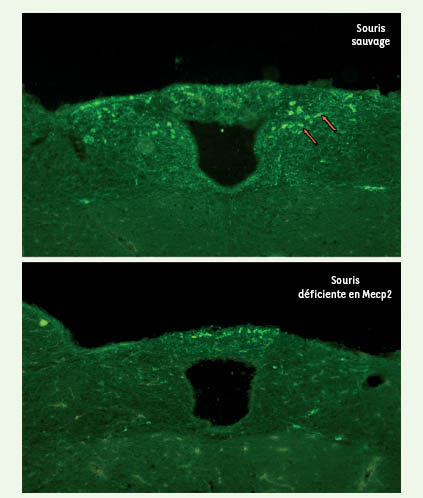
 | Figure 2.
Marquage immunohistofluorescent pour la protéine tyrosine hydroxylase qui permet de localiser les neurones catécholaminergiques. Les flèches montrent l’emplacement des neurones catécholaminergiques du groupe A2C2 chez la souris sauvage. Grâce à ce marquage, nous avons pu mettre en évidence, dans les structures bulbo-pontiques, un déficit du nombre de neurones catécholaminergiques A1C1 et A2C2 chez la souris déficiente en Mecp2. |
|
Peut-on envisager de corriger les troubles respiratoires ? Nous avons également pu montrer que l’activité rythmique respiratoire étudiée in vitro était perturbée chez les souris déficientes en Mecp2, mais qu’il était possible de restaurer une activité normale grâce à une application de noradrénaline. Ces résultats nous ont conduits à envisager l’utilisation in vivo d’agents pharmacologiques afin de stimuler spécifiquement les neurones noradrénergiques touchés. Les travaux préliminaires réalisés dans notre équipe, à Marseille (France), montrent qu’il est effectivement possible d’améliorer la fonction respiratoire in vivo chez les souris déficientes en Mecp2. Ils pourraient déboucher à moyen terme sur des essais cliniques chez les filles atteinte de SR en collaboration avec les cliniciens locaux impliqués dans le diagnostic et la prise en charge des enfants atteints de SR depuis plusieurs années (Pr Anne Moncla et Pr Josette Mancini). L’Association française du syndrome de Rett (AFSR) est également directement impliquée dans les études qui sont menées actuellement dans notre équipe. On mesurera mieux l’importance des enjeux si l’on considère que 25 % des enfants atteints meurent subitement en raison de problèmes cardio-respiratoires aigus [9]. |
1. Weaving LS, Ellaway CJ, Gecz J, et al. Rett syndrome : clinical review and genetic update. J Med Genet 2005; 42 : 1–7. 2. Hagberg B. Rett syndrome : clinical peculiarities and biological mysteries. Acta Paediatr 1995; 84 : 971–6. 3. Amir RE, Van den Veyver IB, Wan M, et al. Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein2. Nat Genet 1999; 23 : 185–8. 4. Gilgenkrantz S, Bourdon V. MeCP2 et retard mental. Med Sci (Paris) 2001; 17 : 811–3. 5. Traynor J, Agarwal P, Lazzeroni L, et al. Gene expression patterns vary in clonal cell cultures from Rett syndrome females with eight different MECP2 mutations. BMC Med Genet 2002; 3 h 12. 6. Guy J, Hendrich B, Holmes M, et al. A mouse Mecp2-null mutation causes neurological symptoms that mimic Rett syndrome. Nat Genet 2001; 27 : 322–6. 7. Chen RZ, Akbarian S, Tudor M, et al. Deficiency of methyl-CpG binding protein-2 in CNS neurons results in a Rett-like phenotype in mice. Nat Genet 2001; 27 : 327–31. 8. Shahbazian M, Young J, Yuva-Paylor L, et al. Mice with truncated MeCP2 recapitulate many Rett syndrome features and display hyperacetylation of histone H3. Neuron 2002; 35 : 243–54. 9. Julu PO, Kerr AM, Apartopoulos F, et al. Characterisation of breathing and associated central autonomic dysfunction in the Rett disorder. Arch Dis Child 2001; 85 : 29–37. 10. Elian M, Rudolf ND. EEG and respiration in Rett syndrome. Acta Neurol Scand 1991; 83 : 123–8. 11. Viemari JC, Roux JC, Tryba AK, et al. Mecp2 deficiency disrupts norepinephrine and respiratory systems in mice. J Neurosci 2005; 25 : 11521–30. |