| |
| Med Sci (Paris). 2006 February; 22(2): 110–111. Published online 2006 February 15. doi: 10.1051/medsci/2006222110.Implication du processus de néogenèse lymphoïde dans le rejet chronique Olivier Thaunat,1* Anne-Christine Field,1 Jean-Baptiste Michel,2 and Antonino Nicoletti1 1Inserm U.681, Université Paris VI, UPMC, Institut Biomédical des Cordeliers, 15, rue de l’École de Médecine, 75270 Paris Cedex 06, France 2Inserm U.698, Hôpital Xavier Bichat, 46, rue Henri Huchard, 75877 Paris Cedex 18, France MeSH keywords: Animaux, Aorte abdominale, Choristome, Fibrose, Rejet du greffon, Humains, Tissu lymphoïde, Lymphopoïèse, Rats, Rats de lignée BN, Rats de lignée LEW, Lymphocytes auxiliaires Th1 |
La transplantation consiste à remplacer l’organe défectueux d’un patient par celui d’un autre individu. Cette idée, bien que très ancienne, n’est devenue une réalité clinique que depuis le milieu des années 1960. L’obstacle majeur auquel se sont heurtés les pionniers de la transplantation d’organe est le rejet. Il résulte de la capacité du système immunitaire du receveur à discriminer comme étranger le tissu transplanté provenant d’un donneur de la même espèce génétiquement différent. Tandis que les progrès constants dans le domaine de l’immunosuppression ont permis de contrôler efficacement le rejet aigu, la demi-vie des greffons ayant survécu à la première année a stagné, traduisant notre impuissance devant le processus de rejet chronique, devenu la première cause de perte des greffons. Notre incapacité à développer des stratégies thérapeutiques efficaces contre le rejet chronique est en bonne partie expliquée par notre ignorance de sa physiopathologie. Sa définition reste en effet essentiellement histologique : survenue retardée d’une fibrose oblitérante progressive des structures canalaires du greffon, avec destruction du parenchyme et perte de fonction. La traduction clinico-histologique du rejet chronique dépend bien sûr de l’organe transplanté (rein, cœur, poumon…), cependant comme tous ces organes sont vascularisés, la composante vasculaire du rejet chronique (souvent appelée artériosclérose du greffon) est une constante. C’est ce caractère « universel » qui justifie que de très nombreuses équipes aient fait le choix de focaliser leurs travaux sur le rejet chronique vasculaire. |
Le rejet chronique vasculaire Un modèle largement utilisé pour étudier le rejet chronique vasculaire (RCV) consiste à réaliser une transplantation orthotopique de l’aorte abdominale sous-rénale entre deux souches de rat histo-incompatibles (BN → LEW) [
1]. Les lésions observées au niveau des greffons aortiques sont tout à fait superposables à celles observées au niveau des artères des organes détransplantés pour rejet chronique terminal chez l’homme. Ces lésions associent une prolifération intimale oblitérative, une disparition des cellules musculaires lisses de la média et une infiltration inflammatoire périvasculaire adventitielle. Des travaux préliminaires nous ont appris que le développement des lésions de RCV, dans ce modèle, se déroulait en deux phases. La première se rapproche d’un rejet aigu : elle fait intervenir une réponse cellulaire cytotoxique responsable de la destruction rapide de l’endothélium du greffon. Elle est suivie par des processus de cicatrisation qui vont conduire à une prolifération néointimale oblitérative constituée par les CML (cellules musculaires lisses) du receveur (chimérisme). Les effecteurs cellulaires de cette première phase sont incapables d’atteindre les cibles allogéniques portées par les CML de la média qui sont protégées par les lames élastiques. Pour les détruire, le système immunitaire du receveur développe dans un deuxième temps une réponse humorale. Les alloanticorps traversent les lames élastiques, se fixent sur les molécules du complexe d’histocompatibilité de la classe I (CMH-I) allogéniques à la surface des CML médiales et induisent leur apoptose [
2,
3]. L’importance de l’infiltrat inflammatoire adventitiel, disproportionné par rapport au faible nombre de cibles allogéniques présentes dans cette couche, et son caractère très chronologiquement corrélé aux évènements se déroulant dans les autres couches de la paroi artérielle, nous ont conduit à émettre l’hypothèse que cet infiltrat adventitiel pourrait jouer un rôle important dans le développement des lésions de rejet chronique vasculaire. |
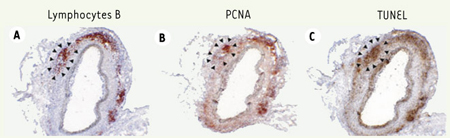
Un processus de néogenèse lymphoïde Nous avons isolé l’adventice des greffons aortiques par microdissection, mis en suspension les cellules de l’infiltrat et analysé sa composition par cytométrie en flux [
4]. Les lymphocytes T constituent la population principale. Initialement (J10), l’infiltrat est majoritairement constitué de lymphocytes T CD8+ et présente une polarisation marquée vers le phénotype Th1 (T helper 1). Progressivement, la proportion de lymphocytes T CD4+ augmente et une polarisation vers le phénotype Th2 (T helper 2) est observée à un mois. La population lymphocytaire T CD4+ semble fournir une aide au développement d’une réponse humorale alloimmune locale (néogenèse lymphoïde) [
5]. En effet, nous avons observé, un mois après la transplantation, la présence dans l’adventice des greffons de nodules lymphocytaires B (Figure 1A) qui sont le siège d’une prolifération (Figure1B) et d’une apoptose intenses (Figure 1C), très évocatrices de centres germinatifs ectopiques.  | Figure 1.
Coupe transversale de greffon aortique un mois après la transplantation. PCNA : proliferating cell nuclear antigen ; TUNEL : terminal deoxynucleotidyl transferase-mediated dUTP nick end labelling. |
Le caractère fonctionnel de ces centres germinatifs adventitiels a été documenté par des techniques d’organoculture en condition hyperoxique qui ont permis de démontrer qu’ils sont le siège de la production d’alloanticorps. Enfin, nous avons mis en évidence un tissu lymphoïde secondaire ectopique au sein de greffons humains (reins et cœurs) détransplantés pour rejet chronique terminal, démontrant la réalité du processus de néogenèse lymphoïde en transplantation clinique. Ces résultats démontrent que les greffons sont non seulement la cible mais aussi le site où la réponse allo-immune s’élabore. De futurs travaux devront vérifier si la néogenèse lymphoïde est une cible thérapeutique intéressante pour prévenir le rejet chronique. |
1. Mennander A, Tiisala S, Halttunen J, et al. Chronic rejection in rat aortic allografts. An experimental model for transplant arteriosclerosis. Arterioscler Thromb 1991; 11 : 671–80. 2. Plissonnier D, Henaff M, Poncet P, et al. Involvement of antibody-dependent apoptosis in graft rejection. Transplantation 2000; 69 : 2601–8. 3. Plissonnier D, Nochy D, Poncet P, et al. Sequential immunological targeting of chronic experimental arterial allograft. Transplantation 1995; 60 : 414–24. 4. Thaunat O, Field AC, Dai J, et al. Lymphoid neogenesis in chronic rejection : evidence for a local humoral alloimmune response. Proc Natl Acad Sci USA 2005; 102 : 14723–8. 5. Kratz A, Campos-Neto A, Hanson MS, et al. Chronic inflammation caused by lymphotoxin is lymphoid neogenesis. J Exp Med 1996; 183 : 1461–72. |