| |
| Med Sci (Paris). 2006 March; 22(3): 259–265. Published online 2006 March 15. doi: 10.1051/medsci/2006223259.Durée de vie, génétique et axe somatotrope Laurent Kappeler,* Carlos De Magalhaes Filho, Yves Le Bouc, and Martin Holzenberger Inserm U.515, Hôpital Saint-Antoine, 184, rue du Faubourg Saint-Antoine, 75571 Paris Cedex 12, France |
La gérontologie expérimentale a généré des modèles animaux du vieillissement fort intéressants. Un des premiers fut la restriction calorique (RC) qui est jusqu’à présent le traitement le plus efficace pour augmenter la durée de vie chez les mammifères [
1]. La RC produit un grand nombre d’effets biologiques, notamment un retard de croissance, une forte baisse de la fertilité et la modification de l’expression de nombreux gènes. On a ensuite découvert que des souris présentant une mutation des gènes Pit-1 ou Prop1, altérant le développement hypophysaire, vivaient bien plus longtemps que les souris normales. Ceci a réorienté une partie de la recherche sur le vieillissement vers l’endocrinologie [
2,
3]. Cependant, les altérations panhypopituitaires induites par les mutations de Pit-1 et Prop1 sont très vastes et concernent, comme la restriction alimentaire, des fonctions endocriniennes hautement intégratives, notamment la croissance, le métabolisme et la fertilité. Une impulsion majeure est venue des criblages systématiques chez Caenorhabditis elegans pour identifier des gènes liés à la longévité, travaux pionniers de Cynthia Kenyon. Son groupe a montré que des mutations ponctuelles de certains gènes pouvaient augmenter considérablement la durée de vie. Une fois caractérisés, il est apparu que la majorité de ces gènes appartenait à la voie de signalisation IGF (insulin-like growth factor)/insuline qui s’est donc révélée être un facteur majeur de régulation de la durée de vie chez les nématodes [
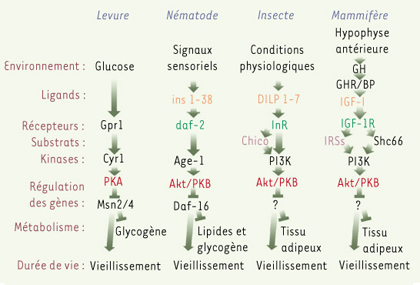
4]. La mutation des gènes homologues chez la drosophile, et un peu plus tard chez la souris, a confirmé que ce mécanisme de régulation est très conservé au cours de l’évolution animale (Figure 1).  | Figure 1.
Régulation de la durée de vie par les voies de signalisation IGF/insuline chez les eucaryotes. Chez la levure, les nématodes et les insectes, des signaux sensoriels ou certaines conditions physiologiques induisent la voie de signalisation IGF/insuline et augmentent croissance et mortalité. Des mutations dans ces voies entraînant une perte de fonction, prolongent la durée de vie et augmentent le stockage de glycogène et de lipides. Chez la souris, l’IGF-I ( insulin-like growth factor 1) active des voies homologues à celles qui régulent la durée de vie chez S. cerevisiae, C. elegans ou D.
melanogaster. Cependant, de nombreuses composantes de la voie de signalisation IGF, impliquées dans la régulation de la longévité chez des organismes simples, attendent encore confirmation expérimentale chez les mammifères. Gpr1 : G-protein-coupled receptor 1 ; PKA : protéine kinase A ; Akt/PKB : protéine kinase B ; DILP 1-7 : drosophila insulin-like peptide 1-7 ; InR : insulin-like receptor ; PI3K : phosphatidyl inositol-3 kinase ; GH : growth hormone ; GHR/BP : growth hormone receptor ; IGF-1R : insulin-like growth factor-1 receptor ; IRSs : insulin receptor substrate (d’après [
38]). |
Depuis, le rôle exact de cette voie de signalisation IGF/insuline dans la régulation de la durée de vie est l’objet de recherches intensives et nous nous focaliserons sur un élément clé : l’IGF-1R (insulin growth factor 1 receptor) et le système IGF des mammifères (Figure 2). Ce récepteur IGF a été montré comme étant un promoteur de la croissance somatique et, comme son homologue daf-2 chez le nématode, son inactivation complète et constitutive chez la souris est incompatible avec la vie : les souris avec une mutation nulle homozygote d’IGF-1R souffrent d’un retard sévère du développement fœtal et meurent à la naissance d’une insuffisance respiratoire [
5]. Cependant, des souris ayant un déficit seulement partiel d’IGF-1R présentent un retard de croissance postnatal et sont viables [
6]. L’inactivation hétérozygote chez la souris (IGF-1R+/−
), qui réduit le nombre de récepteurs de moitié, prolonge la durée de vie en moyenne de 26 % par rapport à son contrôle sauvage [
7] et reproduit ainsi le phénotype des mutations daf-2 du nématode. Les souris IGF-1R+/−
ont un métabolisme énergétique, une nutrition et une activité physique normales. Leur fertilité et leur reproduction sont également inchangées. Cependant, elles montrent une résistance accrue au stress oxydatif qui est une cause majeure du vieillissement. La carence en IGF-1R entraîne une diminution importante de l’activation des voies de signalisation Akt et Erk1/2 MAP kinases. De plus, la protéine p66Shc (une des isoformes de Shc et substrat majeur d’IGF-1R), déjà impliquée dans le contrôle de la résistance au stress oxydatif et de la durée de vie chez la souris [
8], est faiblement activée dans les cellules IGF-1R+/−
[7]. Cela confirme le lien mécanistique important entre signalisation IGF et résistance au stress oxydatif [7]. 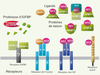 | Figure 2.
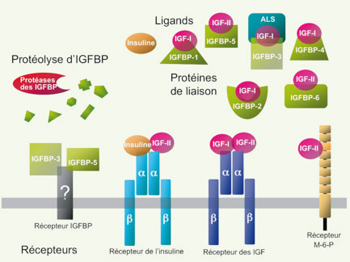
Protéines de la famille IGF (insulin-like growth factor). Les ligands, récepteurs, protéines de liaison (IGFBP) du système IGF et les fragments protéolytiques de ces derniers sont représentés. L’IGF-I interagit avec l’IGF-1R (récepteur des IGF) et les différents IGFBP, plus particulièrement l’IGFBP-3. L’IGF-II interagit avec l’IGF-1R, le M-6-PR, l’IR (principalement avec l’isoforme IR-A, démuni de la séquence correspondant à l’exon 11) et l’IGFBP, plus particulièrement l’IGFBP-6. L’insuline interagit avec le récepteur de l’insuline (IR). Quelques IGFBP, notamment IGFBP-3 et -5, pourraient exercer leurs effets via leur propre récepteur, encore hypothétique, indépendamment de leur capacité à moduler la signalisation IGF-1R ou IR via la séquestration d’IGF. ALS : acid-labile subunit (d’après [ 38]). |
Entre-temps, des études faites chez C. elegans ont montré que la durée de vie pourrait être régulée de façon « non-cellule-autonome » et suggèrent que le système nerveux jouerait un rôle central dans ce processus. En effet, manipuler la signalisation daf-2 dans le système nerveux, ou détruire certains neurones sensoriels, peut significativement augmenter la longévité du nématode [
9,
10]. Cela plaiderait en faveur d’une régulation endocrine de la durée de vie, probablement par des molécules sécrétées qui induisent une plus forte résistance des cellules de l’organisme au stress oxydatif. Ainsi, INS-7, un des ligands de daf-2, pourrait lui-même être un effecteur endocrine [
11]. Cette hypothèse de régulation endocrine de la longévité a été rapidement transposée chez la mouche où la production de l’hormone DILP-2 (une des sept insulin-like de la drosophile) par des neurones spécialisés est sous contrôle endocrine. La perturbation de la signalisation DILP-2 dans le corps adipeux de la tête déclenche des altérations endocrines agissant à distance sur des neurones spécialisés, diminuant ainsi les niveaux de DILP-2 circulantes et augmentant la longévité [
12]. |
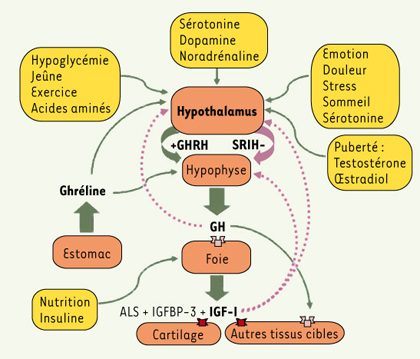
Axe somatotrope et vieillissement Chez les mammifères, la voie de signalisation IGF-I fait partie intégralement de l’axe somatotrope où l’IGF-I sécrétée par le foie et par d’autres tissus relaie nombre d’effets de la GH. Celle-ci est sécrétée par les cellules somatotropes de l’hypophyse et finement régulée par deux neuropeptides hypothalamiques, la somatolibérine (GHRH) qui la stimule, et la somatostatine (SRIH) qui l’inhibe (Figure 3), ainsi que par une hormone secrétée par l’estomac : la ghréline, stimulatrice de la GH. L’hypophyse sert de relais entre le système nerveux central et la périphérie et achemine par voie endocrine les signaux qui régulent croissance, reproduction, métabolisme et réponses au stress. En plus des cellules somatotropes, l’hypophyse contient les cellules lactotropes (PRL), gonadotropes (LH, FSH), thyréotropes (TSH) et corticotropes (ACTH), également contrôlées par des neuropeptides ou mononamines hypothalamiques spécifiques. 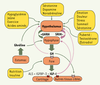 | Figure 3.
Régulation de l’axe somatotrope chez l’homme. L’hormone de croissance (GH) est sécrétée par l’hypophyse de manière épisodique selon un rythme ultradien en réponse aux neuropeptides de l’hypothalamus GHRH (somatolibérine) et SRIH (somatostatine). Elle agit principalement sur la synthèse et la libération d’IGF-I hépatique (qui relaie nombre de ses effets sur la croissance), d’IGFBP-3 (IGF binding protein-3) et d’ALS (acid-labile subunit) qui augmentent la demi-vie de l’IGF-I circulante. Elle agit aussi directement sur certains organes qui possèdent, en plus du récepteur à l’IGF-I (en rouge), celui de la GH (orange). Il existe un rétrocontrôle négatif central et hypophysaire par la GH et l’IGF-I (pointillés). Plusieurs facteurs centraux et périphériques régulent cet axe à différents niveaux (boîtes jaunes). Les flèches vertes indiquent un effet stimulateur, les violettes un effet inhibiteur. |
Divers modèles d’inactivation de gènes de l’axe somatotrope ont été étudiés. Les premiers, mentionnés plus haut, étaient les souris Ames et Snell, mutées sur des gènes impliqués dans la différenciation hypophysaire (Pit-1 et Prop1 respectivement), ayant ainsi un déficit en GH et en IGF-I, mais aussi en PRL et en TSH. Ces souris mutantes, bien que naines, hypothermiques et stériles, présentant une insulinémie et une glycémie diminuées, ont une durée de vie augmentée d’environ 40 % [3,
13]. Une autre souris, avec une mutation inactivant le récepteur au GHRH, essentiel à la différenciation des cellules somatotropes de l’hypophyse et donc à la production de GH, est naine, présente une puberté retardée et une longévité augmentée de 24 % [13]. Par ailleurs, l’inactivation ciblée du récepteur de la GH augmente aussi la longévité de 26 % [
14]. Ces dernières souris restent également petites, sont hypofertiles et présentent une diminution du glucose, de l’insuline et de l’IGF-I circulants. Dans tous ces modèles, les régulations de la croissance, de la reproduction et de la longévité semblent indissociablement liées. Seule l’inactivation partielle, chez la souris IGF-1R+/−
, permet une augmentation de la longévité sans modification majeure de la taille ou de la fertilité [7]. En conclusion, l’inhibition de la voie de signalisation IGF ou de ses régulateurs en amont, augmente la longévité chez les mammifères. Cependant, pour dissocier les effets de l’axe somatotrope sur la longévité de ceux sur la croissance et la reproduction, l’inactivation doit se situer au niveau de l’IGF-1R, ou en aval. |
Comme mentionné ci-dessus, la méthode la plus efficace pour accroître la longévité est la restriction calorique qui entraîne aussi une diminution en IGF-I plasmatique et une augmentation de la sensibilité à l’insuline. Ces deux hormones, issues d’une duplication génétique relativement récente chez les vertébrés, pourraient constituer une passerelle entre métabolisme, croissance, reproduction et longévité. Certaines données impliquent effectivement la signalisation de l’insuline dans la régulation de la longévité. Chez les mammifères, l’insuline et l’IGF-I produisent leurs effets biologiques en se liant sur leur récepteur respectif, IR et IGF-1R. Ces deux récepteurs à activité tyrosine kinase ont une structure hétérotétramérique de type α2β2 (Figure 2). Bien que leur abondance respective varie en fonction des tissus, ces deux récepteurs sont exprimés à la surface de la plupart des cellules, et des récepteurs hybrides fonctionnels, composés d’αβIR et d’αβIGF-1R, ont été décrits. Clairement distincts dans leur spécificité envers les ligands au niveau extracellulaire, les deux récepteurs vont phosphoryler globalement les mêmes protéines de signalisation intracellulaire. Ils activent avant tout les IRS (insulin receptor substrates 1 à 4) qui servent d’adaptateurs pour recruter les voies de transduction PI3K/Akt et Ras/MAPK, mais également des protéines Shc. Malgré cette « ressemblance », les signalisations IGF/IGF-1R et insuline/IR produisent des effets assez distincts. En effet, les souris IR−/−, de taille pratiquement normale, développent à la naissance une acidocétose diabétique dont elles meurent quelques jours après. Les IGF-1R−/− souffrent, quant à elles, de sévères problèmes de croissance et de différenciation cellulaire et meurent à leur naissance d’une insuffisance respiratoire. Cela suggère un recrutement différent des voies IRS, Akt et MAPK par l’insuline et l’IGF-I [
15]. L’insuline semble être impliquée dans la régulation du vieillissement comme l’ont montré plusieurs modèles de souris à durée de vie augmentée autres que la RC. Hypo-insulinémie et glycémie diminuées ont été observées chez les souris Ames et mises sur le compte d’une sensibilité accrue à l’insuline. Les souris hétérozygotes pour l’invalidation de l’IR (IR+/−
) ont une meilleure résistance au stress oxydant induit par hyperoxie [
16] (leur durée de vie n’est pas encore connue). En revanche, l’inactivation totale de l’IR, spécifiquement dans le tissu adipeux, augmente la longévité de 18 % [
17]. Ces souris ont 30 à 50 % de masse grasse en moins et une baisse de 70 % de leur insulinémie à jeun. Avec l’âge, ces souris maintiennent une tolérance au glucose contrairement aux contrôles. Chez l’homme, les niveaux élevés en insuline prédisposent au diabète de type 2 et à bon nombre de pathologies qui en découlent. À l’inverse, les niveaux bas en insuline sont associés à une mortalité diminuée [
18] et retrouvés plus fréquemment chez les populations centenaires [
19]. Cependant, très peu de données sont disponibles concernant un rôle direct de la voie de signalisation insuline dans la régulation de la durée de vie. D’autres données suggèrent que l’importance de l’insuline pour le vieillissement ne viendrait pas de ses niveaux circulants, comme cela semble être le cas pour l’IGF-I, mais plutôt de la sensibilité cellulaire à l’insuline et du maintien de cette sensibilité avec l’âge. |
De façon surprenante, et même presque inquiétante, la plupart des phénotypes à longévité accrue chez la souris impliquent les voies de signalisation IGF/insuline. Le dernier exemple de cette série est Klotho. En 1997, Kuro-o et al. décrivirent une souris ayant une faible espérance de vie (deux mois en moyenne, au lieu de 24), un vieillissement accéléré et des pathologies semblables à celles observées chez l’homme âgé : athérosclérose, ostéopénie, calcifications ectopiques et emphysème pulmonaire [
20,
21]. Ce phénotype est dû à l’insertion d’un transgène au niveau du promoteur du gène Klotho, inactivant ainsi son expression. Le gène Klotho (KL) code pour une protéine transmembranaire libérée dans la circulation sanguine après son clivage ou directement produite sous forme sécrétée par épissage alternatif. Chez l’homme (86 % d’homologie du gène KL avec celui de la souris), certains polymorphismes de Klotho sont associés à une faible espérance de vie et à des pathologies semblables à celles retrouvées chez la souris KL
−/−, notamment ostéoporose, risque de maladies coronaires et infarctus. Le vieillissement accéléré des souris KL
−/− concerne tous les tissus bien que cette protéine ne soit produite principalement que dans les reins, les plexus choroïdes du cerveau et l’hypophyse. L’action anti-vieillissement de la protéine Klotho impliquerait donc un mode de fonctionnement hormonal. Deux études récentes ont confirmé et détaillé ce mécanisme, tout en montrant directement le pouvoir anti-vieillissement de Klotho [
22,
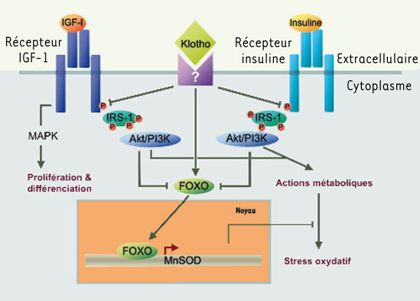
23]. Dans la première étude, les chercheurs ont surexprimé le gène Klotho chez la souris (taux circulants de Klotho doublés) et ont ainsi réussi à prolonger l’espérance de vie de ces animaux de 31 % par rapport aux contrôles chez les mâles et de 19 % chez les femelles. Les auteurs ont démontré que l’augmentation de la durée de vie par Klotho était indépendante de la prise alimentaire et de la croissance, connues pour modifier à elles seules la longévité (voir plus haut). Les souris surexprimant Klotho ont une glycémie et un métabolisme lipidique normaux, mais présentent une résistance à l’insuline (chez les mâles) et à l’IGF-I. Au niveau cellulaire, la liaison insuline/IR et la liaison IGF-I/IGF-1R ne sont pas modifiées. En revanche, la protéine Klotho supprime, de manière dose dépendante, l’autophosphorylation de ces récepteurs qui est l’état caractéristique de leur activation. Ainsi, les voies de signalisation intracellulaire dépendant d’IR et d’IGF-1R sont inhibées, comme l’indiquent la baisse de l’activation des protéines IRS-1 et -2 et la diminution de l’association PI3K-IRS. Cet effet inhibiteur de la phosphorylation est spécifique de l’IR et de l’IGF-1R puisque d’autres récepteurs à activité kinase, comme l’EGFR ou le PDGFR, ne sont pas affectés chez les souris surexprimant Klotho. La seconde étude montre que Klotho intervient aussi en aval des récepteurs, dans la voie IGF/insuline. En effet, Klotho active les facteurs de transcription FOXO impliqués dans le contrôle de l’expression d’enzymes anti-oxydantes dont la manganèse superoxyde dismutase (MnSOD). Cette enzyme permet de réduire les taux cellulaires d’espèces réactives de l’oxygène et de protéger ainsi l’organisme contre cette cause majeure du vieillissement. En conclusion, la protéine Klotho, du nom de la déesse grecque qui file la trame de la vie, ralentit le vieillissement en inhibant la signalisation IGF/insuline et en augmentant la résistance au stress oxydatif (Figure 4). 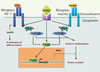 | Figure 4.
Mode d’action de Klotho. La liaison de Klotho à son récepteur putatif induit l’inhibition de la phosphorylation des récepteurs IGF et insuline, ce qui empêche l’activation du complexe IRS-1/PI3K et de la cascade de signalisation en aval. D’autre part, Klotho entraîne la translocation des facteurs de transcription FOXO dans le noyau, permettant l’expression d’enzymes anti-oxydantes comme la MnSOD (manganèse superoxyde dismutase). IRS-1 : insulin receptor substrate-1 ; PI3K : phosphatidyl inositol-3 kinase ; Akt : protéine kinase B/Akt ; MAPK : mitogen-activated protein kinase. |
|
Ces résultats mènent directement à la question de la régulation de la longévité chez l’homme. Il existe effectivement quelques évidences indirectes d’un lien entre croissance humaine et longévité et deux études génétiques semblent impliquer plus particulièrement l’IGF et l’insuline dans le contrôle du vieillissement humain. Nous avons trouvé, il y a quelques années, dans une très grande cohorte d’hommes espagnols, une régression négative entre la croissance et la durée de vie moyenne [
24]. D’autres ont analysé les données de larges cohortes de joueurs de baseball américain et mis en évidence une corrélation négative fortement significative entre la taille de ces sujets et leur durée de vie [
25]. Le problème est que toute corrélation éventuelle entre taille et longévité est généralement masquée par d’importants changements antagonistes qui se superposent. Dans les sociétés modernes, l’espérance de vie a beaucoup augmenté grâce à l’hygiène et à la prévention des maladies. Dans le même temps, la taille moyenne augmente dans la population générale à la suite des progrès socioéconomiques et de l’amélioration quantitative et qualitative de l’alimentation humaine (tendance séculaire de croissance). Des taux d’IGF-I circulants inférieurs à la normale ont souvent été documentés chez des populations humaines de sujets âgés, mais ce phénomène a plutôt été interprété comme une conséquence et moins comme une cause de la longévité. Récemment, une étude a montré que l’IGF-I libre et la durée de vie étaient co-régulés chez l’homme par un groupe de gènes incluant ceux de l’IGF-1R et de la PI3KCB [
26]. Une autre étude a indiqué qu’une diminution de la signalisation IGF/insuline chez l’homme était associée à une durée de vie plus longue que la moyenne [
27]. Mais très peu de mutations d’IGF-1R ont été décrites chez l’homme et rien n’est pour l’instant connu sur les traits qui pourraient indiquer, chez les rares sujets atteints, une éventuelle altération de leur vieillissement. |
Vieillissement humain et hormone de croissance Réciproquement, on peut se demander si une suractivité de l’axe somatotrope est associée à une diminution de la durée de vie humaine. De nombreuses études ont montré que l’acromégalie évolutive (tumeur hypophysaire sécrétant de la GH) était associée à une augmentation de la mortalité. L’indice de mortalité standardisé (rapport entre la mortalité observée dans la population acromégale et la mortalité attendue dans la population générale) est de 1,5 à 3,3 [
28]. Les décès d’origines cardio ou cérébrovasculaire et tumorale y sont plus fréquents [
29]. Parmi les différents facteurs influençant cette morbidité et mortalité, on note la durée de l’affection avant son diagnostic et son traitement et la qualité du contrôle de l’hypersécrétion somatotrope. Différentes études montrent que l’IGF-I est un facteur prédictif majeur de mortalité chez les patients acromégales et que la normalisation de l’IGF-I permet d’améliorer leur pronostic vital en ramenant leur espérance de vie à un niveau comparable à celui de la population générale [
30–
32]. Chez l’enfant, un traitement substitutif par la GH recombinante (environ 0,2 mg/kg/semaine) est instauré dans les cas de déficits hypophysaires pour éviter un retard statural, qui, pour certains, pourrait être très important (taille aux alentours de 1,30 m). De plus, un traitement par la GH est également proposé de façon consensuelle dans des retards staturaux sans déficit de sécrétion en GH, c’est-à-dire dans les syndromes de Turner (taille adulte moyenne de 1,40-1,45 m sans traitement), dans les retards de croissance associés à un retard de croissance intra-utérin ou dans les retards de croissance induits par une insuffisance rénale. Les doses proposées, souvent supérieures, améliorent de façon non négligeable le pronostic statural. Dans le cadre d’un retard de croissance induit par une anomalie du récepteur de la GH (syndrome de Laron), un traitement par l’IGF-I recombinant est indiqué. Depuis quelques années, une thérapeutique GH substitutive est proposée chez l’adulte, que ce soit un déficit en GH d’origine génétique, ou acquis après lésion, chirurgie ou radiothérapie de l’hypophyse [
33]. Le retentissement d’un déficit GH chez l’adulte concerne, en particulier, les troubles lipidiques qui semblent être à l’origine de la diminution de l’espérance de vie par complications cardiovasculaires. Un traitement substitutif a donc été proposé chez ces patients adultes pour éventuellement améliorer le pronostic cardiovasculaire, mais également l’anabolisme protéique, la lipolyse, et la qualité de vie. Tout cela a laissé penser qu’il s’agissait d’un traitement de confort : composition corporelle, capacités physiques et qualité de vie. Il semble maintenant admis que dans les déficits en GH, ce traitement substitutif (à doses plus faibles que chez l’enfant : environ 0,04 à 0,08 mg/kg/semaine) puisse être réellement nécessaire, notamment pour la minéralisation osseuse et peut-être aussi pour la protection des risques cardiovasculaires [33,
34]. Des études à plus long terme sont nécessaires pour confirmer l’intérêt de ces traitements sur l’incidence des fractures et la morbidité/mortalité cardio et cérébrovasculaire. L’expérience clinique, encore limitée chez les sujets de plus de 60 ans, nécessite des essais thérapeutiques supplémentaires. Le traitement substitutif par GH doit bénéficier chez l’adulte comme chez l’enfant de l’utilisation de la détermination sérique de l’IGF-I comme marqueur de surveillance d’efficacité, mais aussi comme marqueur de sécurité pour éviter un surdosage, qui comme le suggèrent certaines études, ne serait pas dénué de risques. En effet, même si des données concernant le suivi de nombreux patients pédiatriques et adultes sont rassurantes quant aux effets indésirables, une analyse rétrospective récente appelle à encore plus de vigilance et à suivre les effets thérapeutiques de la GH à l’aide de marqueurs comme l’IGF-1 pour ne pas dépasser les valeurs physiologiques [
35]. Après la puberté, l’activité physiologique de l’axe somatotrope diminue progressivement : la production de GH et d’IGF-I diminue d’année en année pour assurer, après 60-70 ans, des concentrations d’IGF-I inférieures à la moitié de celles observées à l’âge de 20 ans. Cela a incité à proposer un traitement dit « substitutif » chez les sujets âgés sains. Les résultats concernant différents paramètres, dont la qualité de vie, sont très contradictoires et controversés. Des études ont montré que l’effet de la GH sur l’anabolisme protéique musculaire, malgré des augmentations significatives de l’IGF-I sérique, n’améliorait pas l’effet que produisait à lui seul l’exercice musculaire régulier chez ces sujets âgés sains. En parallèle, différentes études ont montré que les valeurs sériques d’IGF-I situées dans les valeurs physiologiques hautes de la population normale étaient associées à un risque accru de cancer, notamment du sein et de la prostate [
36], mais aussi de pathologies cardiovasculaires [
37]. Ces dernières pathologies sont également clairement décrites dans les acromégalies évolutives induisant des concentrations sériques élevées d’IGF-I. Ainsi, une activité somatotrope déficiente ou excessive entraîne les mêmes conséquences cardiovasculaires par des mécanismes différents. Une activité excessive est de plus associée à un risque accru de cancer. La sagesse thérapeutique incite donc à se situer dans la moyenne de ces paramètres biologiques. Cela pourrait être interprété comme si l’Évolution avait sélectionné une activité de l’axe somatotrope intense pendant l’enfance et la période pubertaire afin d’induire une croissance staturo-pondérale et une taille adulte adaptées au milieu environnant, mais aussi une activité somatotrope diminuant par la suite, permettant d’augmenter la longévité de l’espèce. |
Il est utile de traiter un déficit en GH durant l’enfance, mais également à l’âge adulte, et il est conseillé de respecter les valeurs physiologiques de son effecteur IGF-I. Il semble, en revanche, contre-indiqué chez l’adulte sain et à plus forte raison lors du vieillissement, de vouloir rétablir les valeurs observées à l’âge de 20 ans. |
Footnotes |
1. McCay CM, Crowell MF. Prolonging the lifespan. Scientific Monthly 1934; 39 : 405–14. 2. Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Dwarf mice and the ageing process. Nature 1996; 384 : 33. 3. Bartke A, Wright JC, Mattison JA, et al. Extending the lifespan of long-lived mice. Nature 2001; 414 : 412. 4. Kenyon C. A conserved regulatory system for aging. Cell 2001; 105 : 165–8. 5. Liu JP, Baker J, Perkins AS, et al. Mice carrying null mutations of the genes encoding insulin-like growth factor I (Igf-1) and type 1 IGF receptor (Igf1r). Cell 1993; 75 : 59–72. 6. Holzenberger M, Hamard G, Zaoui R, et al. IGF-I receptor gene dosage generates a sexually dimorphic pattern of organ-specific growth deficits, affecting fat tissue in particular. Endocrinology 2001; 142 : 4469–78. 7. Holzenberger M, Dupont J, Ducos B, et al. IGF-1 receptor regulates life span and resistance to oxidative stress in mice. Nature 2003; 421 : 182–7. 8. Migliaccio E, Giorgio M, Mele S, et al. The p66shc adaptor protein controls oxidative stress response and life span in mammals. Nature 1999; 402 : 309–13. 9. Wolkow CA, Kimura KD, Lee MS, Ruvkun G. Regulation of C. elegans life-span by insulinlike signaling in the nervous system. Science 2000; 290 : 147–50. 10. Alcedo J, Kenyon C. Regulation of C. elegans longevity by specific gustatory and olfactory neurons. Neuron 2004; 41 : 45–55. 11. Murphy CT, McCarroll SA, Bargmann CI, et al. Genes that act downstream of DAF-16 to influence the lifespan of Caenorhabditis elegans. Nature 2003; 424 : 277–84. 12. Hwangbo DS, Gershman B, Tu MP, et al. Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body. Nature 2004; 429 : 562–6. 13. Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Lifespan extension and delayed immune and collagen aging in mutant mice with defects in growth hormone production. Proc Natl Acad Sci USA 2001; 98 : 6736–41. 14. Coschigano KT, Holland AN, Riders ME, et al. Deletion, but not antagonism, of the mouse growth hormone receptor results in severely decreased body weights, insulin, and insulin-like growth factor I levels and increased life span. Endocrinology 2003; 144 : 3799–810. 15. Entingh-Pearsall A, Kahn CR. Differential roles of the insulin and insulin-like growth factor-I (IGF-I) receptors in response to insulin and IGF-I. J Biol Chem 2004; 279 : 38016–24. 16. Baba T, Shimizu T, Suzuki Y, et al. Estrogen, insulin, and dietary signals cooperatively regulate longevity signals to enhance resistance to oxidative stress in mice. J Biol Chem 2005; 280 : 16417–26. 17. Blüher M, Kahn B, Kahn CR. Extended longevity in mice lacking the insulin receptor in adipose tissue. Science 2003; 299 : 572–4. 18. Roth GS, Lane MA, Ingram DK, et al. Biomarkers of caloric restriction may predict longevity in humans. Science 2002; 297 : 811. 19. Paolisso G, Barbieri M, Rizzo MR, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol 2001; 37 : 149–56. 20. Kuro-o M, Matsumura Y, Aizawa H, et al. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature 1997; 390 : 45–51. 21. Nabeshima Y. Challenge of overcoming aging-related disorders. J Dermatol Sci 2000; 24 (suppl 1) : S15–21. 22. Kurosu H, Yamamoto M, Clark JD, et al. Suppression of aging in mice by the hormone Klotho. Science 2005; 309 : 1829–33. 23. Yamamoto M, Clark JD, Pastor JV, et al. Regulation of oxidative stress by the anti-aging hormone Klotho. J Biol Chem 2005; 280 : 38029–34. 24. Holzenberger M, Martín-Crespo RM, Vicent D, Ruiz-Torres A. Decelerated growth and longevity in men. Arch Gerontol Geriat 1991; 13 : 89–101. 25. Samaras TT, Storms LH. Impact of height and weight on life span. Bull WHO 1992; 70 : 259–67. 26. Bonafe M, Barbieri M, Marchegiani F, et al. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity : cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab 2003; 88 : 3299–304. 27. van Heemst D, Beekman M, Mooijaart SP, et al. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell 2005; 4 : 79–85. 28. Chanson P. Complications cardiovasculaires de l’acromégalie. In : Chanson P, ed. Les conséquences de l’acromégalie. Cachan : Éditions Médicales Internationales, 2001: 27–41. 29. Orme SM, McNally RJ, Cartwright RA, Belchetz PE. Mortality and cancer incidence in acromegaly : a retrospective cohort study. United Kingdom acromegaly study group. J Clin Endocrinol Metab 1998; 83 : 2730–4. 30. Holdaway IM, Rajasoorya RC, Gamble GD. Factors influencing mortality in acromegaly. J Clin Endocrinol Metab 2004; 89 : 667–74. 31. Beauregard C, Truong U, Hardy J, Serri O. Long-term outcome and mortality after transsphenoidal adenomectomy for acromegaly. Clin Endocrinol 2003; 58 : 86–91. 32. Biermasz NR, Dekker FW, Pereira AM, et al. Determinants of survival in treated acromegaly in a single center : predictive value of serial insulin-like growth factor I measurements. J Clin Endocrinol Metab 2004; 89 : 2789–96. 33. Drake WM, Howell SJ, Monson JP, Shalet SM. Optimizing GH therapy in adults and children. Endocrine Rev 2001; 22 : 425–50. 34. Maison P, Griffin S, Nicoue-Beglah M, et al. Impact of growth hormone (GH) treatment on cardiovascular risk factors in GH-deficient adults : a metaanalysis of blinded, randomized, placebo-controlled trials. J Clin Endocrinol Metab 2004; 89 : 2192–9. 35. Swerdlow AJ, Higgins CD, Adlard P, Preece MA. Risk of cancer in patients treated with human pituitary growth hormone in the UK, 1959-85 : a cohort study. Lancet 2002; 360 : 273–7. 36. Chan JM, Stampfer MJ, Giovannucci E, et al. Plasma insulin-like growth factor-I and prostate cancer risk : a prospective study. Science 1998; 279 : 563–6. 37. Raynaud-Simon A, Lafont S, Berr C, et al. Plasma insulin-like growth factor I levels in the elderly : relation to plasma dehydroepiandrosterone sulfate levels, nutritional status and mortality. Gerontology 2001; 47 : 198–206. 38. Dupont J, Holzenberger M. Biology of insulin-like growth factors in development. Birth Defects Res C Embryo Today 2003; 69 : 257–71. |