Le paludisme représente la première endémie parasitaire au monde. Elle cause près de 2,5 millions de décès par an, dont une grande majorité d’enfants en bas âge et de femmes enceintes. Le paludisme cérébral (PC) (ou neuropaludisme) est une forme grave de l’infection à Plasmodium falciparum, caractérisé par une accumulation plus importante d’hématies parasitées par P. falciparum, de leucocytes mononucléés et de plaquettes au niveau des microvaisseaux cérébraux, ainsi que par une activation endothéliale systémique et un nombre accru de microparticules (MP) endothéliales circulantes (pour revue, voir [ 1]).
De nombreuses études ont démontré le rôle clé de certaines cytokines pro-inflammatoires dans le développement du PC, comme le tumor necrosis factor (TNF) et plus récemment la lymphotoxine α (LT). Ces deux cytokines appartiennent à la même famille, et leur interaction avec le même récepteur, le TNFR2, conduit à l’activation de l’endothélium [ 2], caractérisée par une augmentation d’expression de molécules d’adhérence, mais aussi une libération de quantités accrues de MP.
Nous avons testé les propriétés anti-inflammatoires d’une nouvelle molécule nommée LMP-420 dans un modèle in vitro de lésion cérébrale développé dans notre laboratoire. La stimulation de cellules endothéliales cérébrales humaines par TNF ou LT conduit à une augmentation de l’expression des molécules ICAM-1 (intercellular adhesion molecule 1) et VCAM-1 (vascular cell adhesion molecule 1), deux molécules dont l’expression est plus élevée à la surface de l’endothélium cérébral chez les patients décédés de PC comparativement aux témoins [ 3, 4]. Cependant, lorsque les cellules endothéliales sont stimulées en présence de LMP-420, une inhibition significative de cette augmentation d’expression est observée.
ICAM-1 et VCAM-1 étant des récepteurs utilisés par les hématies parasitées par P. falciparum lors de la cytoadhérence, nous avons étudié l’impact de cette inhibition sur l’adhérence des hématies parasitées à la surface de l’endothélium activé. En présence de TNF comme de LT, le nombre de parasites spécifiques à ICAM-1 qui cytoadhèrent à l’endothélium se trouve significativement augmenté, du fait de l’augmentation du nombre de récepteurs disponibles à la surface de la cellule endothéliale. En revanche, si le LMP-420 est ajouté en même temps que le TNF ou la LT, l’adhérence parasitaire due à ICAM-1 se trouve abrogée.
Une étude réalisée au Kenya par Newbold et al. a montré que l’adhérence des hématies parasitées à ICAM-1 était supérieure chez les enfants atteints de PC [ 5]. Une baisse de cette cytoadhérence par LMP-420 pourrait donc influencer favorablement l’évolution de la maladie chez les jeunes patients.
Enfin, nous avons testé les effets de LMP-420 sur l’augmentation de la vésiculation endothéliale, qui se traduit par la production de MP. En effet, nous avons montré au cours d’une étude précédente que l’activation endothéliale par TNF et LT conduit à une libération significativement plus importante de MP par ces cellules in vitro, que celle observée au repos dans les conditions physiologiques. Il a été également démontré que cette vésiculation endothéliale accrue est nettement plus importante chez les patients décédés de PC que chez les témoins [ 6]. Dans notre modèle, lorsque les cellules endothéliales cérébrales humaines sont stimulées par TNF ou LT en présence de LMP-420, on observe dans les deux cas une inhibition hautement significative de la production de MP endothéliales, celles-ci retrouvant leur niveau de production observé dans les conditions physiologiques [ 7].
Nos résultats montrent que LMP-420, nouveau composé purinique de bas poids moléculaire possède une activité anti-inflammatoire capable d’inhiber l’activation endothéliale et l’augmentation d’expression d’ICAM-1, l’adhérence parasitaire spécifique à ce récepteur, et enfin la production de MP endothéliales, trois caractéristiques associées à la forme mortelle de PC pédiatrique [7]. Outre ses propriétés anti-inflammatoires, LMP-420 est capable d’inhiber jusqu’à 98 % de la production monocytaire de TNF, tant dans sa forme soluble que dans la forme membranaire. En admettant que ce composé soit actif et bien toléré in vivo, et surtout que la lésion ne soit pas irréversible lors de l’administration au patient, LMP-420 pourrait inhiber au moins deux étapes cruciales de la pathogénie du PC : la production excessive de TNF par les monocytes en réponse à l’infection parasitaire, et également l’effet de cette cytokine ainsi que de la LT sur l’endothélium (Figure 1). Par ailleurs, de très récentes données font état d’une activité anti-agrégante de la molécule sur les plaquettes humaines. Comme le rôle des plaquettes dans les lésions cérébrales du PC a été démontré dans le modèle murin (résultats expérimentaux revus dans [2]), puis récemment confirmé chez l’homme au cours de plusieurs études, il est également envisageable qu’un traitement par LMP-420 puisse diminuer les dérèglements de l’hémostase et limiter l’accumulation plaquettaire intracérébrale associée à la forme mortelle de PC pédiatrique [ 8]. Enfin, outre son action inhibitrice dans la production de TNF par les monocytes, LMP-420 abroge également la sécrétion de MCP-1 (monocyte chemoattractant protein-1) par ces mêmes cellules, mais également la production de LT par les lymphocytes Th1. Si, contrairement à la LT, le rôle de MCP-1 n’a pas été associé aux lésions cérébrales du PC jusqu’à présent, il n’est pas exclu que le traitement par LMP-420 limite le recrutement et l’accumulation de leucocytes mononucléés observé au cours du PC murin [ 9] et humain [8], conduisant à une diminution potentiellement bénéfique de la réponse inflammatoire pathogénique.
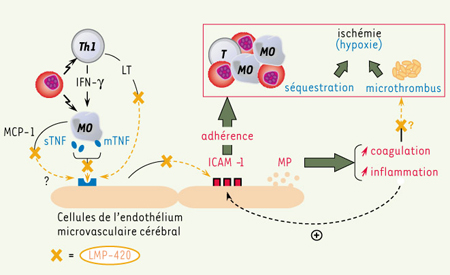
| Figure 1.
La réponse immune de l’hôte conduit, lors de l’infection à
P. falciparum
, à une expansion préférentielle de la population Th1. L’activation monocytaire qui en résulte directement (par contact avec le parasite) ou indirectement (par activation via l’IFN-γ libéré par les lymphocytes Th1) conduit à la surexpression de TNF membranaire et à la libération de TNF soluble circulant. De ces deux formes de la cytokine, la forme transmembranaire est la principale responsable de l’activation de l’endothélium microvasculaire cérébral via le TNFR2, tout comme la LT libérée par les lymphocytes T. L’activation systémique qui en résulte a pour effet la surexpression de molécules d’adhérence comme ICAM-1 à la surface cellulaire, augmentant les sites d’adhérence pour les hématies parasitées, les monocytes et les plaquettes à la surface endothéliale. En outre, cette activation conduit à une libération accrue de microparticules endothéliales, dont les propriétés procoagulantes et pro-inflammatoires peuvent alors respectivement jouer un rôle dans l’hypercoagulabilité décrite en cas de PC, mais aussi aggraver la réponse inflammatoire endothéliale. Un traitement par LMP-420 pourrait potentiellement : (1) inhiber la production de TNF et de LT par les cellules immunitaires de l’hôte dans les phases précoces de l’infection ; (2) abroger l’effet de ces cytokines pro-inflammatoires sur l’activation endothéliale ; et enfin (3) avoir un effet anti-coagulant dans les phases plus tardives de la lésion microvasculaire cérébrale. |
Si les mécanismes d’action précis de LMP-420 restent encore à élucider, il semble que la molécule agit sur les voies de signalisation du facteur transcriptionnel NFκB, et plus particulièrement sur la sous-unité RelA (p65) (Figure 2) de l’hétérodimère. En effet, le traitement par LMP-420 de la lignée promonocytaire-monocytaire humaine s’est montré inefficace sur l’inhibition de production de TNF, avec une IC50 plus de 1 000 fois supérieure à celle observée sur les monocytes humains fraîchement purifiés. Une analyse ultérieure a montré que cette lignée promonocytaire était dépourvue de la sous-unité p65 à l’état basal, ce qui pourrait expliquer leur résistance à LMP-420.
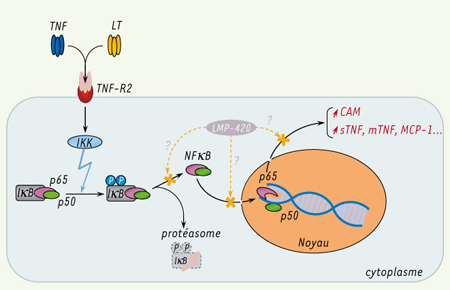
| Figure 2.
La liaison du TNF et de la LT à leur récepteur commun, TNFR-2, conduit à l’activation par divers effecteurs de la kinase d’IκB (ou complexe IKK). Celle-ci entraîne la phosphorylation d’IκB en deux sérines amino-terminales, signal requis pour sa protéolyse qui permet de libérer le facteur de transcription NFκB. NFκB (p50/p65 dans ce cas) entre alors dans le noyau et active l’expression de certains gènes, notamment ceux codant les molécules d’adhérence cellulaires (cell adhesion molecules, CAM) pour les cellules endothéliales, mais aussi dans le cas des monocytes, codant l’expression du TNF soluble (sTNF) et membranaire (mTNF), ainsi que MCP-1. Différentes voies effectrices de LMP-420 sont proposées ici, mais des études in vitro actuellement en cours permettront d’expliquer plus précisément son mécanisme d’action. |
LMP-420 présente d’autres avantages : son très petit poids moléculaire pourrait lui conférer une accessibilité accrue au cerveau au travers de la barrière hémato-encéphalique ; son stockage ne nécessite pas de réfrigération, puisqu’il s’agit d’une molécule de type organique. Enfin, LMP-420 présente une toxicité extrêmement faible. En effet, ce composé fait partie de la famille des purines analogues des nucléosides, une classe de composés utilisée depuis des dizaines d’années chez l’homme, et son administration répétée pendant 15 semaines n’entraîne aucun effet toxique chez l’animal. L’ensemble de ces résultats fait du LMP-420 une nouvelle voie thérapeutique du PC ciblant les mécanismes pathogéniques de réponse cellulaire de l’hôte lors de l’infection par P. falciparum. Seules des études in vivo, actuellement en cours chez la souris, seront en mesure de déterminer son efficacité et sa stabilité au cours des différentes étapes de la lésion microvasculaire cérébrale.