La formation du système nerveux des vertébrés débute au moment de la gastrulation avec l’induction et la formation de la plaque neurale sur la face dorsale de l’embryon. C’est en fin de gastrulation, au sein de la plaque neurale que se différencieront les neurones primaires.
Au stade blastula et jeune gastrula (7 à 9 heures après la fécondation), l’ectoderme de l’amphibien Xenopus laevis peut évoluer vers un destin épidermique ou neural. Les travaux de la dernière décennie ont montré que l’ectoderme se détermine en épiderme en réponse à l’activation de la voie de signalisation BMP4 et prend un destin neural lorsque cette voie est inhibée par des facteurs secrétés par le mésoderme dorsal, tels que noggin, chordin ou follistatine. L’induction neurale se ferait donc selon un mécanisme « par défaut », qui ne nécessiterait que l’inhibition de la voie BMP4 et ne conduirait pas à l’activation d’une cascade de transduction spécifique [ 1].
Ce modèle, bien que largement admis, présente des limites. Il a été principalement établi à partir d’expériences réalisées sur des ectodermes isolés et jamais sur l’embryon entier. Le modèle d’induction neurale « par défaut » n’est pas généralisable à l’embryon de poulet ou d’ascidie où l’induction neurale nécessite un signal instructif faisant, entre autres, intervenir la voie de signalisation FGF [ 2]. Des résultats récents obtenus sur l’embryon de xénope montrent que la répression de la voie de signalisation BMP4 est requise pour supprimer le destin épidermique mais qu’elle n’est pas suffisante pour induire le destin neural [ 3].
Nous nous intéressons aux voies de signalisation calcium-dépendantes qui contrôlent les phases précoces de la formation du système nerveux chez l’amphibien. Par des techniques d’imagerie calcique, associées à des approches de biologie cellulaire et moléculaire, nous avons montré que le calcium joue un rôle crucial dans la transduction du signal neuralisant via des canaux calciques potentiel-dépendant sensibles aux dihydropyridines (DHP) [ 4, 5].
Ainsi dans l’embryon de xénope, depuis le stade blastula (stade 8) jusqu’à la fin de la gastrulation (stade 13-14), il se produit des variations de calcium spontanées et transitoires [ 6, 7]. Ces variations sont restreintes à l’ectoderme dorsal et l’inhibition de ces variations transitoires, soit par le BAPTA (un chélateur de calcium), soit par un antagoniste des canaux Ca2+ sensibles aux DHP, perturbe l’induction neurale et inhibe l’expression de gènes proneuraux comme Zic3. De plus, appliqué sur des ectodermes isolés, le facteur neuralisant noggin provoque une augmentation de calcium intracellulaire ([Ca2+]i) via l’activation de canaux Ca2+ sensibles aux DHP (figure 1C). Certains facteurs de transcription sont des cibles privilégiées du calcium. Ainsi le gène c-fos est activé pendant l’induction neurale, qu’elle soit déclenchée par noggin ou par une augmentation de [Ca2+]i [ 8]. Deux gènes proneuraux, XlPOU2 et Zic3 (Zinc finger protein of cerebellum 3), sont également activés à la suite de la stimulation de l’ectoderme par noggin ou par une variation de [Ca2+]i, qu’elle soit induite par les DHP ou par la caféine. Inversement, le blocage des signaux calciques inhibe l’expression des gènes proneuraux [ 9, 10].
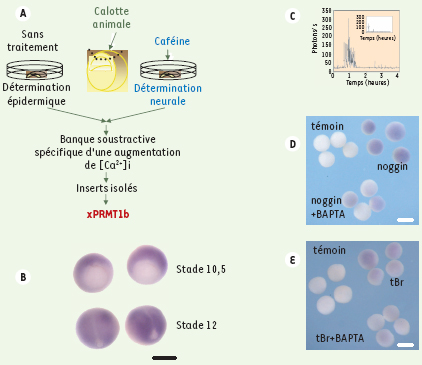
| Figure 1.
Identification du gène codant pour une arginine N-méthyl-transférase de type I, xPRMT1b, à partir d’une banque soustractive réalisée entre des ectodermes induits par une augmentation de [Ca2+]i provoquée par la caféine et des ectodermes non induits. A. Principe de l’expérience : l’ectoderme ou calotte animale est prélevé au stade blastula. B. Expression de xPRMT1b détectée par hybridation in situ en début de gastrulation (stade 10.5, l’encoche blastoporale est vers le haut) et en fin de gastrulation (stade 12, partie antérieure vers le haut). À ce stade, l’expression de xPRMT1b est restreinte à la plaque neurale (échelle 0,5 mm). C. L’inducteur neural noggin provoque une augmentation de [Ca2+]i inhibée par la nifédipine, antagoniste des canaux calciques sensibles aux dihydropyridines (encart). D. noggin induit l’expression de xPRMT1b selon un mécanisme calcium-dépendant : le BAPTA (chélateur de calcium) réduit fortement cette expression. E. La surexpression dans les cellules de l’ectoderme d’un récepteur non fonctionnel de BMP4 (tBR), conduit à l’inhibition de la voie de détermination épidermique et oriente les cellules vers un destin neural. L’expression de xPRMT1b induite dans ces conditions est réduite en présence de BAPTA (échelle D, E : 0,2 mm). |
Nos résultats montrent que le calcium est nécessaire et suffisant pour déterminer les cellules de l’ectoderme dans la voie neurale. Nous avons recherché des gènes précoces de la détermination neurale contrôlés par le calcium. Grâce à une banque soustractive d’ADNc, réalisée à partir d’ectodermes isolés induits par une augmentation de [Ca2+]i provoquée par la caféine versus non induits (Figure 1A), nous avons sélectionné une trentaine de gènes précoces contrôlés par le calcium et qui s’expriment dans les futurs territoires neuraux [ 11]. Nous avons plus particulièrement porté notre attention sur une arginine N-méthyl-transférase, xPRMT1b. Nos expériences ont été réalisées à la fois sur des ectodermes isolés et sur des embryons in toto [ 12].
Sur les ectodermes isolés, l’expression de xPRMT1b est induite par une augmentation de [Ca2+]i provoquée soit par la caféine, soit par l’inhibition de la signalisation BMP par noggin, soit par l’expression d’un récepteur BMP4 non fonctionnel (tBR). Dans ces deux derniers cas, elle est inhibée spécifiquement par le BAPTA (Figure 1D, E). Nous avons également montré que xPRMT1b est un gène de réponse directe à l’augmentation de [Ca2+]i car son expression en présence de caféine ne nécessite pas de synthèse de protéines de novo.
Par hybridation in situ, nous avons suivi dans l’embryon in toto le profil d’expression spatio-temporel de xPRMT1b. L’ARN messager de xPRMT1b est détecté dès le début de la gastrulation, dans tout l’ectoderme ainsi que dans le mésoderme dorsal. Son expression est ensuite restreinte aux territoires neuraux dans les stades plus tardifs (Figure 1B). Les antagonistes des canaux Ca2+ sensibles aux DHP inhibent l’expression de xPRMT1b. L’expression de xPRMT1b dans l’embryon résulte donc d’une entrée de calcium par les canaux Ca2+ sensibles aux DHP.
Le rôle de xPRMT1b au cours de l’induction neurale a été abordé par gain (surexpression de l’ARN messager) et perte de fonction (approche morpholino) [ 13]. Le messager de xPRMT1b est injecté dans l’embryon au stade 2 cellules, puis l’ectoderme est isolé au stade blastula et l’expression de marqueurs neuraux est analysée par RT-PCR. xPRMT1b induit l’expression de gènes précoces impliqués dans la détermination neurale de l’ectoderme (Zic3 et Neurogenine) ainsi que de marqueurs de détermination (Engrailed2 et N-CAM) et de différenciation neurale (N-tubuline). En présence de cycloheximide, l’expression de Zic3 est maintenue, tandis que l’expression d’Engrailed2 est inhibée. Cela démontre que Zic3 est une cible directe de xPRMT1b, alors que l’expression d’Engrailed2 nécessite une synthèse protéique. L’expression des marqueurs neuraux induite par une augmentation [Ca2+]i est fortement réduite dans les ectodermes isolés à partir d’embryons injectés avec un morpholino contre xPRMT1b. Dans l’embryon, la perte de fonction de xPRMT1b par injection de morpholino contre xPRMT1b bloque le développement de la partie antérieure du système nerveux. Ces résultats suggèrent que l’enzyme xPRMT1b est un lien direct entre l’augmentation de calcium intracellulaire et les événements en aval de l’induction neurale.
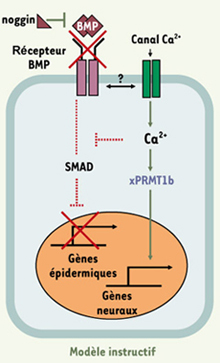
Nos travaux permettent de donner la première évidence de l’expression tissu-spécifique d’une arginine N-méthyl-transférase dans un système intégré et de moduler le concept d’induction neurale par défaut (Figure 2). Nous suggérons qu’un mécanisme instructif dépendant du calcium est nécessaire pour orienter les cellules de l’ectoderme vers un destin neural [4].
| Figure 2.
Modèle instructif d’induction neurale. L’inactivation de la voie de signalisation du facteur BMP4 par noggin est requise pour orienter les cellules de l’ectoderme vers un destin neural. Cependant dans l’embryon cette inhibition n’est pas suffisante. Une augmentation de [Ca2+]i est nécessaire pour induire l’expression de xPRMT1b et activer des gènes neuraux précoces comme Zic3 ou XlPOU2 [6]. Le calcium entre par des canaux membranaires sensibles aux dihydropyridines et pourrait aussi agir en réprimant la voie de transduction de BMP4. Les relations entre les récepteurs de BMP4 et le canal calcique sont encore inconnues |