| |
| Med Sci (Paris). 2006 June; 22(6-7): 621–625. Published online 2006 June 15. doi: 10.1051/medsci/20062267621.Myc et compétitions intercellulaires chez la drosophile Olivier Albagli1* and Hélène Pelczar2 1Inserm U790, PR1, Institut Gustave Roussy, 39, rue Camille Desmoulins, 94805 Villejuif, France 2CNRS/Université Paris VI, UMR 7622, 7, quai Saint Bernard, 75005 Paris, France |
Il est probable que la combinaison de deux mécanismes soit à l’origine de la diversification cellulaire et tissulaire au sein d’un organisme. Selon le modèle instructif, les cellules sont intrinsèquement stables, et leur différenciation résulte d’une influence orientatrice de leur environnement, reçue et interprétée grâce à diverses voies de signalisation. Dans le modèle sélectif, les cellules sont intrinsèquement variables, et l’influence de l’environnement consiste à séléctionner, au sein d’une population spontanément hétérogène, les cellules les plus « aptes », par exemple les cellules les plus capables d’utiliser des facteurs de croissance. Mais quelles sont les hétérogénéités intrinsèques déterminant l’aptitude des cellules dans le modèle sélectif ? Parmi, sans doute, d’autres paramètres, le niveau d’expression de d-Myc apparaît prépondérant dans l’aile de drosophile en développement. |
d-Myc et « supercompétitivité » Chez les vertébrés, les proto-oncogènes codant pour les facteurs de transcription bHLH/LZ (basic helix-loop-helix/leucine zipper) de la famille Myc influencent les trois paramètres de la croissance cellulaire : prolifération, taille des cellules et apoptose [
1,
2]. Dans le disque imaginal de l’aile de la drosophile, où l’on peut induire l’expression d’un gène dans une cellule et en observer les conséquences sur le clone formant sa descendance, la surexpression de d-myc (unique gène myc chez cet animal) augmente la taille du clone formé en raison, principalement, d’une augmentation de la taille des cellules (hypertrophie) [2,
3] (Figure 1). La surexpression d’autres protéines régulatrices, comme la phospho-inositide-3-OH kinase (PI3K) ou le couple cycline D/Cdk4 (cyclin-dependent kinase), accroît également la taille des clones correspondants (Figure 1A). Toutefois, une différence essentielle apparaît : alors que la surexpression localisée de PI3K ou de cycline D/Cdk4 entraîne une augmentation de la taille de l’aile, celle de d-Myc n’a pas cet effet. L’explication est que dans le cas de d-Myc, l’augmentation de la taille du clone surexpresseur s’exerce au détriment de son « voisinage », c’est-à-dire des cellules situées dans sa périphérie sur plusieurs rangs cellulaires [
5] : ces cellules meurent, ou poussent très faiblement, compensant ainsi la dilatation de la portion du disque surexprimant d-Myc [
4, 5] (Figure 1B). C’est la confrontation de populations hétérogènes quant à l’expression de d-Myc, et non le niveau absolu de cette expression, qui produit le phénomène : en effet, il n’y a aucune élimination particulière si toutes les cellules du disque sous-expriment (lorsqu’elles contiennent les allèles hypomorphes d-mycP0
ou d-mycP1
) ou surexpriment d-Myc au même niveau [4, 5]. En revanche, une différence même faible suffit, puisque la juxtaposition de deux populations contenant l’une 4 copies et l’autre 2 copies de d-myc entraîne l’extension de la première et l’élimination de la seconde. Le phénotype associé à une expression relativement élevée de d-Myc est baptisé « supercompétitif » [
6], par opposition au phénotype simplement « compétitif » (surcroissance sans élimination des cellules voisines) conféré par la surexpression de PI3K ou du couple cycline D/CDK4.  | Figure 1.
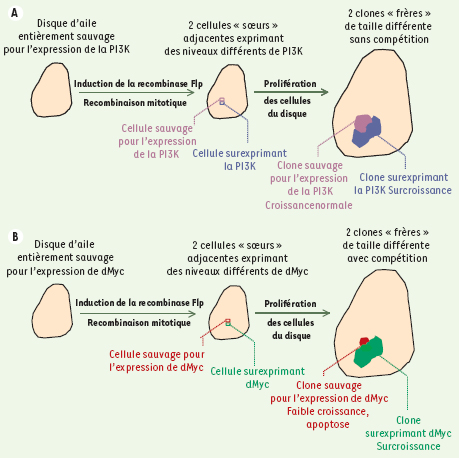
Une hétérogénéité spatiale d’expression de d-Myc, mais pas celle d’autres protéines régulatrices, induit le phénomène de compétition cellulaire. Le disque imaginal de l’aile de drosophile est un épithélium monocouche en prolifération intense pendant la vie larvaire [
16]. On peut y créer artificiellement une différence d’expression stable d’un transgène entre deux cellules voisines, et visualiser comment évolue la descendance de chacune d’elles. A. Au départ, dans l’exemple choisi [ 5], toutes les cellules du disque sont sauvages pour l’expression de la phospho-inositide-3-OH kinase (PI3K). L’induction de la recombinase Flp ( flip-flop) produit une recombinaison mitotique engendrant deux cellules filles, l’une demeurant sauvage, l’autre surexprimant la PI3K. Des marqueurs spécifiquement (ou préférentiellement) exprimés dans l’une ou l’autre cellule fille (protéines de surface ou fluorescentes) permettent de suivre la descendance de chacune d’elles. Au terme d’une période de prolifération, on observe que le clone surexprimant PI3K est plus gros que son voisin sauvage qui a, lui, poussé tout à fait normalement. Il y a donc une croissance différentielle sans compétition, puisque les cellules sauvages sont « indifférentes » à la surcroissance de leur voisines surexprimant PI3K. La taille finale de l’aile sera accrue par la dilatation de sa portion surexprimant PI3K. Le même résulat est obtenu si le couple cycline D/Cdk4 ( cyclin-dependent kinase) est exprimé à la place de PI3K. B. Dans le même type d’expérience, d-Myc induit également une surcroissance du clone surexpresseur. Cependant, il se produit dans ce cas un phénomène de compétition : la croissance du clone sauvage adjacent est nettement affectée, il présente de nombreuses cellules apoptotiques et l’on peut montrer que sa taille est réduite par rapport à celle d’un clone sauvage poussant « loin » (à plus de 10 rangs cellulaires) du clone surexprimant d-Myc [ 5]. Comme la surcroissance du clone surexpresseur est compensée par la perte des cellules sauvages voisines, la taille finale de l’aile sera normale. Plusieurs autres confrontations ont été réalisées : clones de cellules sauvages dans un disque surexprimant d-Myc, clones de cellules sous-exprimant d-Myc dans un disque sauvage, cellules contenant un nombre distinct de copies de d-myc (deux ou quatre) [ 4], cellules sauvages confrontées à des cellules surexprimant d-Myc dans la « bande Dpp » [ 5] (voir Figure 2). Les observations sont les mêmes, ce qui indique que le moteur du phénomène de compétition est une différence d’expression de d-Myc entre cellules voisines, et non le niveau absolu de cette expression. |
|
La juxtaposition, au sein du disque de l’aile, de deux populations de cellules exprimant des niveaux distincts de d-Myc conduit donc à la « surcroissance » des cellules (supercompétitives), qui expriment le plus de protéine, et à la mort de celles qui en expriment le moins : nous appellerons respectivement D-MYC et d-myc ces deux populations. Les cellules d-myc présentent des symptômes apoptotiques, comme l’expression de la forme activée de la caspase 3 [4, 5] ; de plus, leur élimination est nettement diminuée lorsqu’elles expriment un transgène codant pour p35, un inhibiteur baculoviral des caspases [4]. Ces cellules présentent également une induction du gène hid (head involution defective), un médiateur de processus apoptotiques, et ne subissent plus d’apoptose lorsqu’elles sont privées d’une copie de ce gène [5]. Toutefois, la signalisation conduisant à l’apoptose des cellules d-myc n’est pas complètement élucidée : si une étude suggère que l’affaiblissement de la cascade JNK (c-Jun N-terminal kinases) par surexpression des protéines inhibitrices dIAP1 (Drosophila inhibitor of apoptosis protein 1) ou Puc (puckered) bloque l’apoptose [4], une autre ne décèle qu’une protection très partielle quand les cellules du disque sont déficientes pour le gène hep (hemipterous) codant pour le facteur JNKK (Jun kinase kinase)/MKK7 (MAP-kinase kinase 7), un activateur de JNK [5]. Notons enfin que la surexpression de d-Myc augmente également le taux d’apoptose à l’intérieur même du clone : cette apoptose intrinsèque, qui rappelle celle décrite chez les vertébrés [1], est également associée à une induction de hid [5]. |
Myc, synthèse protéique et compétition À plusieurs égards, une faible expression de d-Myc produit un phénotype comparable à celui associé à une série de mutations dominantes appelées Minute. En effet, la confrontation, dans un disque d’aile, de cellules sauvages et de cellules hétérozygotes pour une mutation Minute conduit simultanément à l’élimination de ces dernières et à la surcroissance compensatrice des cellules sauvages adjacentes, supercompétitives dans ce contexte. En outre, comme les mouches d-mycP0
ou d-mycP1
, les mouches Minute, bien que petites et lentes à se développer, sont viables et bien proportionnées [2–5,
7]. Cela indique que les cellules Minute, comme les cellules d-mycP0
ou d-mycP1
, poussent tant bien que mal quand toutes les cellules sont mutantes. Ces ressemblances ne sont sans doute pas fortuites : en effet, les mutations Minute affectent des gènes codant pour différentes protéines ribosomiques [7,
8]. Or, la transcription des ARNr, l’expression de protéines nucléolaires et la taille des nucléoles (sites d’assemblage des ribosomes) sont augmentées par d-Myc lors du développement de la drosophile [8–
10], notamment dans le disque d’aile [8]. De plus, des résultats étayent le lien entre cette activité de d-Myc et le phénotype supercompétitif : le phénotype supercompétitif disparaît si les cellules D-MYC perdent une copie du gène de la protéine ribosomique RpL19 (ribosomal protein) [4] ; l’exagération du signal PI3K, qui ne confère qu’un avantage compétitif [5] et ne protège pas les cellules d-myc [4], n’augmente ni la quantité d’ARNr, ni la taille des nucléoles (même si elle entraîne une hypertrophie cellulaire) [8]. L’avantage supercompétitif apparaît donc, en partie au moins, dû à la capacité de d-Myc d’amplifier de façon globale et coordonnée la synthèse et l’assemblage des constituants ribosomiques. Cette capacité explique sans doute aussi le gigantisme des mouches, notamment de leurs ailes, quand toutes leurs cellules surexpriment d-Myc [5, 8]. |
Une lutte à mort pour Dpp ? L’apoptose des cellules d-myc pourrait résulter d’un signal de mort, peut-être diffusible et encore mystérieux, émis par les cellules D-MYC. Toutefois, le lien entre synthèse protéique et phénotype supercompétitif suggère une explication trophique à ce phénomène. Le facteur diffusible Dpp est sécrété par une étroite bande cellulaire du disque (Figure 2) [5,
11,
12]. Vital, il est produit en quantité limitante, car sa surexpression accroît la taille de l’aile [4,
13]. Le phénotype supercompétitif proviendrait d’un « accaparement » de Dpp par les cellules D-MYC, la synthèse protéique accrue stimulant leur capacité à capter et internaliser Dpp [4, 6]. Cette internalisation augmenterait l’efficacité de Dpp en optimisant la transduction de son signal [4] ou, peut-être, en lui permettant de servir de source d’acides aminés bien ré-utilisés par les cellules D-MYC riches en ribosomes [
14]. Le partage de Dpp entre cellules D-MYC et d-myc deviendrait alors de plus en plus inéquitable (jusqu’à la mort des cellules d-myc) puisque, en retour, le signal Dpp induirait d-Myc (selon des travaux cités mais non publiés [5,
15, 16]) (Figure 2B). En accord avec ce scénario, les cellules d-myc survivent quand elles surexpriment une protéine capable d’y accroître le signal Dpp, c’est-à-dire Dpp lui-même, ou une version constitutive d’un de ses récepteurs, Tkv* (thick veins), ou bien encore Rab5, un stimulateur de l’activité endocytique [4]. Reste cependant à comprendre précisément comment d-Myc faciliterait la capture de Dpp ou la transduction de son signal [8]. Par ailleurs, il n’est pas sûr que les cellules d-myc souffrent d’un affaiblissement du signal Dpp [5], et d’autres facteurs extrinsèques pourraient être âprement disputés [4] : dans ce cas, le « sauvetage » obtenu par la surexpression de Dpp (ou de Tkv*) [5] ne refléterait que sa probable capacité à induire d-Myc dans les cellules d-myc. Enfin, ce modèle n’explique pas l’absence de compétition lorsque les cellules D-MYC et les cellules d-myc sont séparées par la « frontière » limitant les compartiments antérieur et postérieur du disque [5, 16].  | Figure 2.
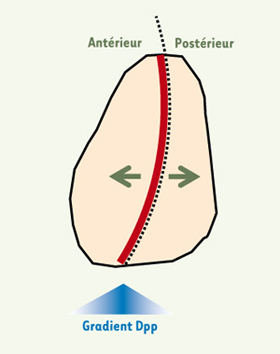
Dpp, un morphogène vital dans le disque d’aile. Dpp ( decapentaplegic), un facteur de croissance de la famille du TGFb ( transforming growth factor β) est sécrété par une étroite « bande » de cellules productrices (ligne continue épaisse) situées près de la frontière (ligne discontinue) séparant les compartiments antérieur et postérieur du disque. Dpp diffuse bidirectionnellement, formant un gradient de concentration de part et d’autre de la « bande » productrice, et agit, dans chaque compartiment du disque, comme un morphogène [ 11, 12] indispensable à la prolifération des cellules [ 13]. Sa surexpression, ou celle d’une version activée d’un de ses récepteurs, Tkv ( thick veins), entraîne une surcroissance des cellules, ce qui indique que Dpp est normalement produit en quantités limitantes [ 13]. |
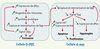 | Figure 3.
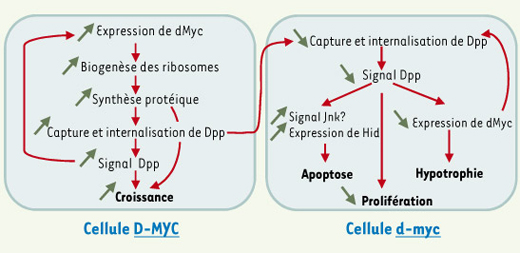
Liens possibles entre expression de d-Myc, biogenèse des ribosomes, capture de Dpp et compétitions intercellulaires. Entre deux cellules voisines, une disparité de quantité de d-Myc peut naître artificiellement (voir Figure 1), ou peut-être spontanément, par exemple à cause d’une fluctuation aléatoire de la transcription du gène. Une expression relativement élevée de d-Myc dans l’une d’elles (cellule D-MYC) stimule la biogenèse des ribosomes, et par conséquent la synthèse protéique, ce qui conduit à une hypertrophie cellulaire. Cette amplification de la synthèse protéique favoriserait la capture de Dpp ( decapentaplegic) et la transduction de son signal [ 4], ce qui stimulerait la croissance de la cellule [ 13] et augmenterait la quantité de d-Myc, vraisemblablement par une régulation post-transcriptionnelle [ 4, 5, 15, 16]. Selon une intéprétation trophique des facteurs de croissance [ 14], on peut imaginer qu’une augmentation du stock intracellulaire d’acides aminés, consécutive à l’internalisation de Dpp, ralentirait la dégradation de d-Myc, permettant ainsi un couplage entre capture d’une source azotée et biogenèse des ribosomes. Notons que même si Dpp stimule la prolifération [ 13], d-Myc modifie la taille, mais pas le temps de doublement, des cellules [ 3]. Parallèlement, la « surcapture » de Dpp par la cellule D-MYC raréfierait cette ressource vitale pour sa voisine, la cellule d-myc, affaiblissant sa croissance et sa viabilité par l’induction de gènes pro-apoptotiques tels que hid ( head involution defective) et, peut-être, par l’activation du signal Jnk [ 4, 5]. Une seule cellule d-myc directement adjacente est montrée ici, mais la compétition s’exerçe en réalité sur plusieurs rangs cellulaires autour de la cellule D-MYC [ 5] ( voir texte). Si l’affaiblissement du signal Dpp diminue l’expression de d-Myc [ 15], la compétition pourrait s’auto-entretenir jusqu’à l’élimination des cellules d-myc. Il est probable que cette correction contribue à la fidélité de l’organogenèse [ 5] : des irrégularités locales du gradient de concentrations de Dpp pourraient par exemple être « tamponnées » si elles créent une disparité spatiale d’expression de d-Myc. Notons, pour la cellule D-MYC, qu’une augmentation (non représentée) de l’expression de hid et de l’apoptose « intrinsèque » accompagne également la surexpression de d-Myc [ 5]. Par ailleurs, il est arbitraire de démarrer le scénario par une augmentation de l’expression de d-Myc dans une cellule, plutôt que par sa diminution. Enfin, ce scénario n’est qu’une possibilité dont plusieurs aspects restent hypothétiques, voire contredits par certaines données expérimentales ( voir texte). |
|
Conclusions et perspectives L’étude de d-myc confirme l’importance des compétitions intercellulaires dans l’organogenèse. En effet, de petites différences spontanées et aléatoires d’expression de d-Myc ou, plus généralement, du contenu en ribosomes entre cellules voisines expliqueraient en partie l’apoptose naturelle du disque d’aile. Cette apoptose assure probablement au développement sa fidélité qualitative, en éliminant les cellules « faibles » [16], mais aussi quantitative, car son inhibition entraîne une plus grande variabilité de la taille des ailes [5]. Les protéines Myc de vertébrés stimulent également la biogenèse des ribosomes [
9,
17]. De plus, d-Myc compense l’absence de c-Myc pour la prolifération de fibroblastes de souris immortalisés [
18], et transforme des cellules primaires de rat, en coopération avec une version activée de H-Ras [
19]. Les données obtenues pour d-Myc peuvent donc éclairer l’oncogenèse chez les vertébrés : elles suggèrent ainsi que la seule surexpression d’une protéine Myc confère un avantage compétitif en augmentant la synthèse protéique, et peut engendrer une excroissance précancéreuse invisible, car formée au détriment des cellules voisines [4, 6] ; la progression tumorale dépendrait alors de la survenue d’autres mutations, réduisant notamment l’apoptose intrinsèque [
20]. Il faut néanmoins se garder de considérer comme évidentes les extrapolations phylogénétiques : l’identité de séquence entre d-Myc et les protéines Myc de vertébrés est, en effet, limitée [19] ; de plus, alors que le nanisme des mouches d-mycPO
ou d-mycP1
s’explique par une hypotrophie cellulaire (cellules petites), celui de leurs équivalents vertébrés, des souris exprimant des niveaux réduits de c-Myc, correspond à une hypoplasie (cellules moins nombreuses) généralisée [18]. Les résultats d’expériences d’invalidation des gènes codant pour les protéines à domaine bHLH Tal (T-cell acute leukemia, également baptisé Scl, stem cell leukemia) et Lyl (lymphoblastic leukemia) rappellent certaines données concernant d-Myc. Ainsi, certains phénotypes sont exacerbés, voire révélés, quand des cellules tal
−/− ou lyl
−/− sont mélangées à des cellules sauvages : injectées seules à des souris irradiées, des cellules médullaires tal
−/− fournissent une descendance érythroïde, alors qu’injectées avec un nombre pourtant très minoritaire de cellules sauvages, elles ne contribuent plus du tout à l’érythropoïèse à long terme [
21] ; de même, le défaut lymphopoïétique des cellules lyl
−/− est bien plus sévère lorsqu’elles sont confrontées à des cellules sauvages in vivo [
22]. Ces deux gènes tal et lyl semblent donc contrôler la compétitivité des cellules, ce qui pourrait expliquer que leur dérégulation contribue à engendrer certaines leucémies T [21, 22]. Enfin, ces résultats confirment que la synthèse protéique, en raison peut-être de la rareté des sources d’acides aminés, est une difficulté importante pour les cellules et, par conséquent, une étape souvent limitante de leur croissance [4, 9, 14]. |
Les auteurs tiennent à remercier vivement le Dr Laura Johnston pour ses nombreux conseils et explications.
|
Footnotes |
1. Pelengaris S, Rudolph B, Littlewood T. Action of Myc in vivo : proliferation and apoptosis. Curr Opin Genet Dev 2000; 10 : 100–5. 2. Johnston LA, Gallant P. Control of growth and organ size in Drosophila. BioEssays 2002; 24 : 54–64. 3. Johnston LA, Prober DA, Edgar BA, et al. Drosophila Myc regulates cellular growth during development. Cell 1999; 98 : 779–90. 4. Moreno E, Basler K. dMyc transforms cells into super-competitors. Cell 2004; 117 : 117–29. 5. de la Cova C, Abril M, Bellosta P, et al.
Drosophila Myc regulates organ size by inducing cell competition. Cell 2004; 117 : 107–16. 6. Secombe J, Pierce SB, Eisenman RN. Myc : a weapon of mass destruction. Cell 2004; 117 : 153–6. 7. Moreno E, Basler K, Morata G. Cell compete for decapentaplegic survival factor to prevent apoptosis in Drosophila wing development. Nature 2002; 416 : 755–9. 8. Grewal SS, Li L, Orian A, et al. Myc-dependent regulation of ribosomal RNA synthesis during Drosophila development. Nat Cell Biol 2005; 7 : 295–302. 9. Oskarsonn T, Trumpp A. The Myc trilogy : lord of RNA polymerases. Nat Cell Biol 2005; 7 : 215–7. 10. Zaffran S, Chartier A, Gallant P, et al. A Drosophila DNA helicase gene, pitchoune, is required for cell growth and proliferation and is a potential target of d-Myc. Development 1998; 125 : 3571–84. 11. Albagli O. Conférence, rumeur ou leçon : comment agissent les morphogènes ? Med Sci (Paris) 1997; 13 : 1347–52. 12. Lecuit T. Histoire d’un morphogène nommé decapentaplegic (dpp). Med Sci (Paris) 1999; 15 : 1279–83. 13. Martin-Castellanos C, Edgar BA. A characterization of the effects of Dpp signaling on cell growth and proliferation in the Drosophila wing. Development 2002; 129 : 1003–13. 14. Kupiec JJ, Sonigo P. Ni Dieu ni gène. Pour une autre théorie de l’hérédité. Paris : Seuil, 2000 : 230 p. 15. Prober DA, Edgar BA. Interactions between Ras1, dMyc and PI3K signaling in the developing Drosophila wing. Genes Dev 2002; 16 : 2286–99. 16. Gallant P. Myc, cell competition and compensatory proliferation. Cancer Res 2005; 65 : 6485–8. 17. Eisenman RN. Deconstructing Myc. Genes Dev 2001; 15 : 2023–30. 18. Trumpp A, Rafaeli Y, Oskarsonn T, et al. c-Myc regulates mammalian body size by controlling cell number but not cell size. Nature 2001; 414 : 768–73. 19. Schreiber-Agus N, Stein D, Chen K, et al.
Drosophila Myc is oncogenic in mammalian cells and plays a role in the diminutive phenotype. Proc Natl Acad Sci USA 1997; 94 : 1235–40. 20. Hemann MT, Bric A, Teruya-Feldstein J, et al. Evasion of the p53 tumor surveillance network by tumour-derived Myc mutants. Nature 2005; 436 : 807–11. 21. Hall MA, Slater NJ, Begley G, et al. Functional but abnormal adult erythropoiesis in the absence of the stem cell leukemia gene. Mol Cell Biol 2005; 25 : 6355–62. 22. Capron C, Lecluse Y, Kaushik AL, et al. The Scl relative Lyl-1 is required for fetal and adult hematopoietic stem cell functions and B cell differentiation. Blood 2006 (sous presse). |