| |
| Med Sci (Paris). 2006 June; 22(6-7): 659–663. Published online 2006 June 15. doi: 10.1051/medsci/20062267659.L’évolution du cerveau humain : de la
matière grasse à la matière grise Stephen C. Cunnane* Chaire de recherche du Canada sur le métabolisme et le vieillissement du cerveau, Centre de recherche sur le vieillissement, Département de médecine, physiologie et biophysiques, Faculté de médecine et sciences de la santé, Université de Sherbrooke, 1036, Belvédère Sud, Sherbrooke (Québec) J1H 4C4, Canada |
On a établi depuis fort longtemps chez l’humain un rapport de cause à effet entre l’évolution du cerveau et sa capacité à fabriquer des outils, la bipédie, la chasse et le raffinement de l’interaction sociale, les talents artistiques et le développement du langage [
1–
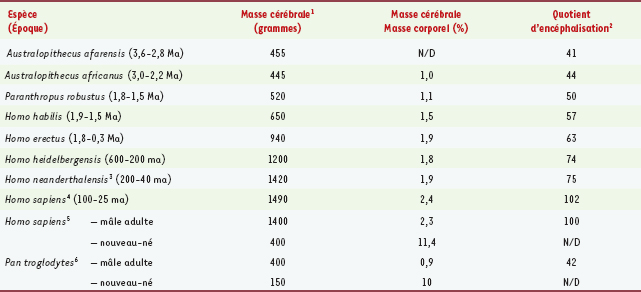
9]. C’est l’augmentation de la taille du cerveau qui, au cours de la période de modernisation pré-humaine, aurait contribué à l’apparition de ces aptitudes qui, à leur tour, auraient vraisemblablement participé à l’amélioration des fonctions cérébrales. De toute évidence, certains primates bipèdes (hominidés) ont appris à fabriquer des outils et des armes de même qu’à chasser gros et petits gibiers dans la savane, dans les régions boisées et ailleurs. Mais dans quel ordre ces étapes ont-elles progressé [1] ? Qu’est-ce qui a précédé ? L’augmentation de la taille du cerveau, l’apparition du langage, le raffinement des rapports sociaux ou la chasse ? Le cerveau humain est environ deux fois plus volumineux que le cerveau des premiers hominidés qui se servaient d’outils (Homo habilis) et dont l’existence remonte à une période comprise entre à 1,5 et 1,9 million d’années. Ce volume correspond presque à trois fois celui de nos tout premiers ancêtres humains, aujourd’hui disparus, mais dont la taille aussi était plus petite, les Australopithèques (Tableau I). Le cerveau humain est aussi environ trois fois plus volumineux que celui de notre cousin qui s’apparente le plus à l’homme, le chimpanzé (Pan troglodytes), mais dont la masse maigre est presque semblable. Il a donc fallu un environnement exceptionnellement favorable pour que le cerveau des hominidés puisse tripler de taille tant chez les premiers pré-humains qu’au sein de la lignée suivante de primates intelligents. Sans doute, aujourd’hui, chez le jeune enfant, une quantité d’énergie phénoménale et un apport nutritionnel disproportionné conditionnent-ils toujours le développement du cerveau.  | Tableau I.
Masses cérébrales d’hominidés ayant subsisté ou disparu par rapport au chimpanzé.
|
|
Exigences du cerveau humain sur le plan métabolique Chez l’adulte, le cerveau pèse environ 1400 grammes, soit à peu près 2,3 % du poids corporel, mais il accapare à peu près 23 % des besoins énergétiques quotidiens de l’organisme [
10]. À la naissance, l’humain possède un cerveau d’environ 400 grammes, soit approximativement 11 % de son poids corporel total. Pourtant, il consomme quelque 74 % de l’énergie alimentaire absorbée par l’organisme [10]. Donc, exprimée en pourcentage d’énergie nécessaire au corps, cette demande d’énergie extrêmement disproportionnée qu’exige le cerveau est encore plus importante chez l’enfant en bas âge que chez l’adulte [10–
12]. Lorsqu’on tente d’expliquer l’augmentation du volume et l’évolution cérébrale humaine, un problème se pose d’emblée : en termes métaboliques et nutritionnels, le cerveau exige considérablement de l’organisme, particulièrement chez les espèces dont le cerveau est proportionnellement plus volumineux compte tenu de leur morphologie. Malgré les similitudes concernant le volume du cerveau à la naissance, il existe une différence majeure entre l’humain et le chimpanzé (ou d’autres primates non humains). Il s’agit de la quasi-absence de réserve de gras corporel chez le jeune chimpanzé [
13]. Au cours de la période finale de la croissance fœtale de même qu’au cours des cinq premières années de la vie, la présence de gras est un facteur essentiel au développement optimal du cerveau humain. La prématurité empêche habituellement la production des réserves de gras nécessaire au moment de la naissance et mène à une augmentation du risque de retard neurologique. Chez l’humain né à terme, on retrouve une masse de 500 grammes de gras dont la plus grande part est emmagasinée dans les tissus sous-cutanés [
14]. Cette masse constitue aussi une réserve essentielle servant à combler la très considérable demande d’énergie du cerveau, déjà fort volumineux et en rapide croissance, du nouveau-né. Chez le fœtus humain, les dépôts de graisse correspondent à 90 % du gain de poids noté juste avant la naissance [
15]. Sur le plan métabolique, il s’agit d’un apport prodigieux qui est directement destiné à répondre à la demande énergétique élevée du cerveau après la naissance. |
Les prématurés (de trois semaines ou davantage par rapport à une grossesse normale de 40 semaines) ou les nouveau-nés de faible poids comptent beaucoup moins de gras que les bébés nés à terme. Dans le cas des naissances prématurées, il n’est d’ailleurs nullement inhabituel aujourd’hui que certaines d’entre elles atteignent dix semaines de prématurité, un mince pourcentage de 10 % de gras seulement s’accumule chez le fœtus humain, proportion bien inférieure en comparaison du pourcentage normal chez le nouveau-né à terme [
16]. Le prématuré, en raison des risques très élevés de ralentissement de son développement neurologique, risque aussi de présenter un volume inférieur du cerveau par rapport au nouveau-né à terme [
17,
18]. Le cerveau du nourrisson demeure donc extrêmement vulnérable et dépend pour s’épanouir de l’apport adéquat de nutriments et d’énergie, et ce autant de façon ponctuelle (manque d’oxygène) que de façon permanente. La vulnérabilité à long terme est beaucoup moins aiguë chez le chimpanzé puisque chez ce dernier, l’augmentation du cerveau n’est pas aussi importante et qu’elle ne se poursuit pas aussi longtemps que chez l’humain. C’est ici qu’entre en jeu la survie des plus adipeux (fattest) utilisée dans le titre d’un livre récent1. La survie des plus adipeux est inspirée de la théorie de la survie des plus adaptés, largement attribuée à Darwin, mais établie en fait par Herbert Spencer. Pour que le volume du cerveau puisse augmenter, les premiers humains les mieux adaptés
(fittest) étaient ceux dont les enfants étaient le plus adipeux (fattest). |
Gras corporel et cétogenèse Le rôle des réserves de gras du nourrisson dans l’expansion du cerveau au cours de la croissance ne se limite pas seulement à constituer une source d’acides gras dont l’oxydation est destinée à répondre aux besoins énergétiques du corps ou du cerveau. Il s’éclaire en considérant que des produits de l’oxydation des acides gras, soit les trois corps cétoniques (ou cétones : β-hydroxybutyrate, acétoacétate et acétone), auraient pu jouer deux rôles métaboliques importants pour l’évolution du cerveau. Premièrement, le cerveau a la propriété d’oxyder les cétones mais non les acides gras d’où elles proviennent [
19,
20]. Chez l’adulte, le glucose est le substrat énergétique préférentiel du cerveau [
21]. En cas de restriction alimentaire, les réserves de glucose corporel (glycogène) comblent les besoins pour une période qui n’excède pas 24 heures [21,
22]. Sans les cétones, les fonctions du cerveau seraient donc rapidement compromises. Cependant, si elles venaient à manquer, les protéines musculaires seraient alors dégradées pour libérer des acides aminés qui pourraient être convertis en glucose. Ainsi, les cétones constituent une réserve essentielle de remplacement du glucose et permettent au cerveau de continuer à bien fonctionner. Deuxièmement, dans leur tissu adipeux, les nouveau-nés humains possèdent une réserve d’acides gras de 10 à 25 fois plus grande que chez tous les primates non humains [13]. Chez le nouveau-né humain, cette réserve d’énergie est utilisée pour produire des cétones d’une manière constante, peu importe si le bébé est à jeun ou non. Par ailleurs, la production des cétones chez l’adulte ne s’observe que lorsqu’il est à jeun. À la mi-grossesse, les cétones représentent non seulement un substrat énergétique alternatif au glucose, mais semblent, de plus, représenter un substrat essentiel puisqu’elles fournissent jusqu’à 30 % des besoins énergétiques cérébraux du fœtus [19]. Troisièmement, le cerveau en développement doit faire appel aux cétones, sources essentielles de carbone pour mener à bien la synthèse du cholestérol et des acides gras nécessaires au fonctionnement membranaire des milliards de neurones élaborant de nouvelles connexions [
23]. Pour se constituer, la membrane neuronale du cerveau exige du cholestérol et des acides gras saturés, lipides qui ne sont fournis qu’en faible quantité par le sang. Par conséquent, une source de carbone (exogène au cerveau) abondante et hydrosoluble est nécessaire et doit pouvoir à la fois servir à la synthèse de ces lipides et parvenir au cerveau. En fait, les cétones forment la source préférentielle de carbone dans la synthèse des lipides dans le cerveau [23,
24]. |
Double fonction des gras : énergie et constitution du tissu membranaire Ce n’est pas tant la composition du cerveau humain qui le rend plus complexe, mais plutôt sa taille et le nombre phénoménal de connexions interneuronales qu’il comporte [17]. Les membranes cellulaires, sièges d’une intense activité électrique (photorécepteur, cerveau, cœur), possèdent un acide gras polyinsaturé caractéristique de la famille oméga-3, l’acide docosahéxaenoique (DHA), dans une proportion plus élevée qu’il n’est nécessaire pour répondre à la demande du cerveau pendant les trois premiers mois de la vie, et ce, quel que soit le contenu du lait ou du régime alimentaire de la mère. De plus, le cerveau reçoit la DHA tant des réserves de gras du nouveau-né que du lait maternel [
25]. Les plantes terrestres ne contiennent pas de DHA et, mis à part le cerveau, les tissus animaux en comportent très peu. Cependant, les crustacés et les poissons font exception : ils sont riches en DHA ainsi qu’en son précurseur, l’acide eicosapentaenoïque. Ainsi, un régime composé de produits tirés du littoral constituerait la meilleure source offerte de DHA et d’autres nutriments essentiels, en particulier l’iode et le fer si propices au développement du cerveau pré-humain et, ultérieurement, humain [16, 17,
26]. Le gras corporel humain offre deux types d’approvisionnement assurés pour le cerveau : (1) les acides gras servant à produire des cétones (composés énergétiques) ainsi que des substrats pour la synthèse des lipides cérébraux [23] ; (2) les acides gras particuliers, comme la DHA, nécessaires aux membranes cérébrales. D’autres mammifères n’ayant strictement aucun gras corporel à la naissance sont privés de la réserve de DHA. Ils ne peuvent donc pas compter sur les avantages que procurent les substrats énergétiques et la DHA qui garantissent le développement normal du cerveau humain. |
Les preuves d’une évolution humaine favorisée par le littoral Le Docteur Kathy Stewart du Musée canadien de la nature à Ottawa a mené des études dont les données témoignent qu’il y a deux millions d’années, le premier Homo (H. habilis) pêchait le poisson-chat et, à une plus petite échelle, la perche [
27,
28]. À cet égard, la représentation d’un saumon adulte, peinture rupestre remontant à quelque 25 000 ans gravée sur la paroi d’une grotte du sud de la France, atteste de l’importance du poisson dans la vie de l’homme de Cro-Magnon (Figure 1). Les aliments provenant des habitats riverains comme les crustacés auraient aussi été les principales denrées d’au moins certains groupes de pré-humains [
29], les Australopithèques. De plus, crustacés, tortues, grenouilles, oisillons, oiseaux aquatiques, œufs et plantes des marais auraient pu constituer une source d’alimentation, mais les fossiles n’en révèlent que peu de traces. Les lacs Turkana et Victoria (Afrique de l’Est) qui couvraient de plus vastes surfaces, il y deux ou trois millions d’années, sont des exemples importants de milieux dont les rivages et leurs ressources pourraient expliquer l’évolution du cerveau des hominidés [26,
30].  | Figure 1.
Image d’un saumon mâle adulte gravé il y a 25 000 ans au plafond d’une grotte dans le Périgord, en France (avec la permission du Dr N. Aujoulat, Centre national de la préhistoire, Périgueux). |
|
C’est à partir des exigences métaboliques et nutritionnelles propres au fonctionnement du cerveau humain actuel qu’il est possible de concevoir l’évolution de cet organe sur des millions d’années. Deux faits en conditionnent l’émergence : l’importance chez le nourrisson du tissu adipeux et du volume du cerveau, deux particularités favorisant l’augmentation et le développement cérébral. Encore est-il nécessaire de disposer de « bons acides gras », produits de dégradation des cétones. La difficulté de réunir ces conditions optimales place l’espèce humaine dans une position de grande vulnérabilité. À cet égard, il semble plausible qu’au cours des phases paléontologiques, l’implantation de milieux humains à proximité du littoral ait permis de répondre à ces conditions relativement restreintes. Les habitats situés à proximité des cours d’eau, soit les rivières, les fleuves, les marais ou la mer, viendraient donc fournir une explication logique à l’apparition de ces importantes caractéristiques humaines. L’évolution du cerveau humain à partir d’un habitat riverain n’exclut pas la chasse opportune, que ce soit des insectes, des charognes ou du gros gibier. Jusqu’à maintenant, elle ne rejette pas non plus l’idée d’un régime composé de fruits, de noix, de racines comestibles ou de termites comme composantes valables du régime alimentaire. Cependant, les régimes excluant les aliments fournis par les milieux riverains n’étaient pas suffisamment abondants, ni assez accessible et ni assez nourrissants à long terme pour permettre l’augmentation du cerveau et la formation d’un important tissu adipeux chez les petits des hominidés (qui allaient devenir des humains). Enfin, si le régime végétarien avait pu permettre une augmentation substantielle du volume du cerveau (chez les primates), cette augmentation se serait également produite chez au moins une autre espèce de primates non humaine. Or, elle ne s’est pas produite. En définitive, tout incomplets qu’ils soient, les fossiles hominidés viennent étayer l’idée qu’un régime fourni par un milieu et un habitat riverains a conféré à certains hominidés un avantage déterminant en donnant l’occasion à leurs petits possédant le plus important tissu adipeux (fattest) de devenir les mieux adaptés (fittest) sur le plan neurologique.  | La clé de l’évolution du cerveau humain, par Andrzej Krauze (© juillet 2006). |
|
Footnotes |
1. Tattersall I. Becoming human: evolution and human uniqueness. New York : Harcourt, Brace and Company, 1998. 2. Aeillo LC, Dean C. Introduction to human evolutionary anatomy. New York : Academic, 1990. 3. Conroy GC. Reconstructing human origins: a modern synthesis. New York : WW Norton, 1997. 4. Falk D. Hominid brain evolution. Looks can be deceiving. Science 1998; 280 : 1714. 5. Jerison H. Evolution of the human brain and intelligence. London : Academic Press, 1973. 6. Johanson D, Edey M. Lucy: the beginnings of mankind. New York : Touchstone Books, 1981. 7. Leakey R. The origin of humankind. New York : Basic Books, 1994. 8. Changeux JP, Chavaillon J. Origins of the human brain. Oxford : Clarendon Press, 1995. 9. Coppens Y, Glaize P. Homo sapiens. Paris : Flammarion, 2004. 10. Holliday M. Metabolic rate and organ size during growth from infancy to maturity and during late gestation and early infancy. Pediatrics 1971; 47 : 169–72. 11. Armstrong E. Relative brain size and metabolism in mammals. Science 1983; 230 : 1302–4. 12. Martin RD. Relative brain size and basal metabolic rate in terrestrial vertebrates. Nature 1981; 293 : 57–60. 13. Widdowson EM. Changes in body proportion and composition with growth. In : Davies JA, Dobbing J, eds. Scientific foundations of pediatrics. London : Heinemann, 1974 : 153–63. 14. Harrington TA, Thomas EL, Modi N, et al. Fast and reproducible method for the direct quantitation of adipose tissue in newborn infants. Lipids 2002; 37 : 95–100. 15. Battaglia FC, Thureen PJ. Nutrition of the fetus and premature infant. Nutrition 1991; 13 : 903–6. 16. Cunnane SC, Crawford MA. Survival of the fattest. Fat babies were the key to evolution of the large human brain. Comp Biochem Physiol 2003; 136A : 17–26. 17. Crawford MA, Costeloe K, Ghebremeskel K, et al. Are deficits of arachidonic and docosahexaenoic acids responsible for the neural and vascular complications of preterm babies ? Am J Clin Nutr 1997; 66(suppl) : S1032–41. 18. Hack M, Breslau N, Weissman B, et al. Effect of very low birth weight and subnormal head size on cognitive abilities at school age. N Engl J Med 1991; 325 : 231–7. 19. Adam PAJ, Raiha N, Rahiala EL, Kekomaki EL. Oxidation of glucose and D-Beta-hydroxybuyrate by the early human fetal brain. Acta Paediatr Scand 1975; 64 : 17–24. 20. Pardridge WM. Blood-brain barrier transport of glucose, free fatty acids, and ketone bodies. In : Vranic M, Efendic S, Hollenberg C, eds. Fuel homeostasis and the nervous system. New York : Plenum Press, 1991 : 43–53. 21. Sokoloff L. Measurement of local cerebral glucose utilization and its relation to local functional activity in the brain. In : Vranic M, Efendic S, Hollenberg C, eds. Fuel homeostasis and the nervous system. New York : Plenum Press, 1991 : 21–42. 22. Kety SS. The general metabolism of the brain in vivo. In : Richter D, ed. Metabolism of the nervous system. London ; Pergamon, 1957 : 221–36. 23. Edmond J. Ketone bodies as precursors of sterols and fatty acids in the developing rat. J Biol Chem 1974; 249 : 72–80. 24. Patel MS, Owen OE. Development and regulation of lipid synthesis from ketone bodies by rat brain. J Neurochem 1977; 28 : 109–14. 25. Cunnane SC, Francescutti V, Brenna JT, Crawford MA. Breast-fed infants achieve a higher rate of brain and whole body docosahexaenoate accumulation than formula-fed infants not consuming dietary docosahexaenoate. Lipids 2000; 35 : 105–11. 26. Broadhurst CL, Wang Y, Crawford MA, et al. Brain-specific lipids from marine, lacustrine or terrestrial food resources ; potential impact on early African Homo sapiens( part B). Comp Biochem Physiol, 2002; 131 : 653–73. 27. Stewart KM. Early hominid utilisation of fish resources and implications for seasonality and behaviour. J Human Evol 1994; 27 : 229–45. 28. Stewart K. A report on the fish remains from Beds I and II sites, Olduvai Gorge, Tanzania. Darmst Beitrag Naturgesch 1996; 6 : 263–9. 29. Walter RC, Buffler RT, Bruggemann JH, et al. Early human occupation of the red sea coast of Eritrea during the last interglacial. Nature 2000; 405 : 65–9. 30. Ellis DV. Wetlands or aquatic ape ? Availability of food resources. Nutr Health 1993; 9: 205–17. 31. Kappelman J. The evolution of body mass and relative brain size in fossil hominids. J Human Evol 1997; 30 : 243–76. 32. Leonard WR, Robertson ML, Snodgrass JJ, Kuzawa CW. Metabolic correlates of human evolution. Comp Biochem Physiol 2003; 136A : 5–16. 33. Ruff CB, Trinkaus E, Holiday TW. Body mass and encephalization in Pleistocene. Homo Nature 1997; 387 : 173–6. |