| |
| Med Sci (Paris). 2006 October; 22(10): 865–871. Published online 2006 October 15. doi: 10.1051/medsci/20062210865.Régulation de p16
INK4a
, senescence et oncogenèse Wei Wen Chien1 and Martine Ffrench2* 1Laboratoire de cytologie analytique, Faculté de médecine, EA3737, 69373 Lyon Cedex 08, France 2Laboratoire d’hématologie, CHLS, 165, chemin du Grand Revoyer, 69495 Pierre-Bénite Cedex, France |
La protéine p16INK4a, un inhibiteur des kinases dépendantes des cyclines (CDK4 et CDK6) de la phase G1 du cycle cellulaire [1], est impliquée dans l’activité transcriptionnelle de la cellule à plusieurs titres : inhibition de la phosphorylation de la protéine du rétinoblastome (pRb), inhibition directe de NFkB [2], régulation de l’activité de Myc [3] et inhibition de CDK7, démontrée in vitro [4]. Les conséquences d’une dérégulation de l’expression du gène INK4a peuvent donc être multiples, comme en témoignent la très fréquente association de sa délétion [5] ou de son inactivation par méthylation [6] avec les processus cancéreux, ou encore l’apoptose rapide provoquée par son hyperexpression [7–9]. |
Protéines p16
INK4a
et p14
ARF
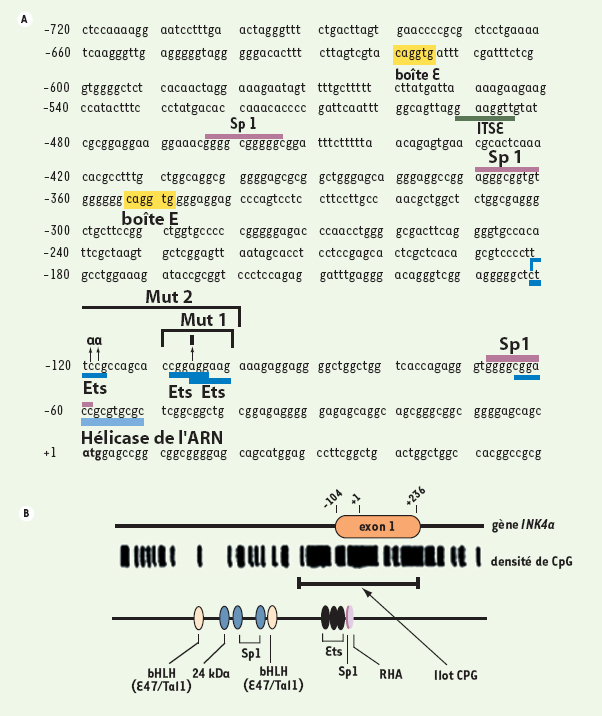
Le locus INK4a/ARF humain, situé sur le chromosome 9 en 9p21, comporte deux gènes, INK4a et ARF, qui expriment respectivement les transcrits α et β : ces transcrits codent pour les protéines p16
INK4a
et p14
ARF
(p19
ARF
chez la souris), distinctes sur les plans structural et fonctionnel [10]. Si l’expression de p16
INK4a
ne varie pas au cours du cycle cellulaire [11], elle est augmentée dans certains cas d’inhibition fonctionnelle de pRb [12], au cours de la sénescence réplicative [11] ou, encore, lors de l’activation de certaines voies oncogéniques induisant une sénescence prématurée [13]. La protéine p14
ARF
, quant à elle, s’associe à MDM2 et régule le cycle cellulaire par stabilisation indirecte de p53, qui active le gène de p21
CIPI
, un autre inhibiteur de CDK [14]. Les voies p16
INK4a
/pRb et p14
ARF
/p53/p21 sont également impliquées dans la réponse aux dommages de l’ADN [15]. Chez la souris, l’invalidation du gène INK4a, à l’inverse de celle du gène ARF, ne provoque pas l’apparition de tumeurs spontanées [16]. Chez l’homme, en revanche, les données expérimentales suggèrent que le gène INK4a, plus que le gène ARF, serait un répresseur de tumeur majeur [17–19]. Par ailleurs, dans un contexte de prédisposition familiale au mélanome, les fibroblastes diploïdes humains (FDH), qui présentent une délétion homozygote de 19 nucléotides dans l’exon 2 du locus INK4a/ARF, expriment une protéine p16
INK4a
non fonctionnelle et une protéine p14
ARF
fonctionnelle : or ces fibroblastes résistent à la sénescence prématurée induite par l’oncogène Ras [18]. Chez l’homme, le contrôle de l’expression de p16
INK4a
constitue donc un pivot essentiel, aussi bien pour la régulation du vieillissement cellulaire que pour la réponse à un stress, en particulier oncogénique. L’analyse séquentielle du promoteur de INK4a montre différents sites consensus pour la fixation de facteurs de transcription (Figure 1A). Par ailleurs, le promoteur et l’exon 1 de INK4a présentent un îlot CpG [6] qui recouvre un certain nombre de ces sites consensus (Figure 1B) ; sa méthylation, anormale, induit l’extinction du gène.
 | Figure 1.Le promoteur de INK4a. A. Séquence de la région promotrice de INK4a (GenBank : X94154) et sites consensus de fixation de ses facteurs régulateurs : sites Ets [ 23], boîtes E [ 25], sites de Sp1 [ 44], site de RHA [ 44] et site de ITSE [ 48]. B. L’extrémité 5’ de INK4a présente un îlot CpG incluant l’exon 1 et 139 pb en amont de celui-ci. L’exon 1 comporte 340 pb : +1 indique le premier nucléotide de traduction ; les 104 premiers nucléotides de l’exon 1 correspondent à une région non codante ; les extrémités de l’exon 1 sont annotées –104 et +236 (GenBank : U12818) [ 6]. |
Bien qu’une régulation post-transcriptionnelle de INK4a ait été décrite [20], l’analyse conjointe de l’ARNm et de la protéine montre que c’est essentiellement au niveau transcriptionnel qu’intervient sa régulation [11, 12, 21] : l’étude de la transcription d’INK4a devrait donc permettre de déterminer les facteurs impliqués dans sa régulation, et donc dans la sénescence cellulaire, facteurs dont le dérèglement serait à l’origine du développement de tumeurs. |
Facteurs activateurs et inhibiteurs de la transcription d’ INK4aActivateurs de la transcription Protéines Ets1 et Ets2 Ets1 et Ets2 (Ets1/2) activent le promoteur de INK4a en réponse à l’activation de la voie Ras/Raf/MEK : de fait, l’activation des oncogènes Ras [ 13] ou Raf [ 22], ou celle de MEK [ 23], induit une sénescence prématurée, avec augmentation de l’expression de p16
INK4a
; l’hyperexpresion des facteurs transcriptionnels Ets1/2 par la voie Ras/Raf/MEK induit la transcription de INK4a, un blocage en phase G1 du cycle cellulaire et la sénescence prématurée des fibroblastes humains [ 23]. Ets1/2 activent le promoteur de INK4a en se liant directement à leurs sites consensus Ets : ainsi, les mutations Mut 1 et Mut 2 qui affectent les sites consensus Ets au niveau du promoteur du gène INK4a(Figure 1A) empêchent l’induction de son activité par Ets2 [ 23]. L’activité du promoteur de INK4a, normalement induite par Ets2 [24], est inhibée par la protéine LMP1 du virus d’Epstein-Barr : Ets2 ne s’associe pas au promoteur de INK4a, et s’accumule dans le cytoplasme alors que sa localisation normale est nucléaire et cytoplasmique. Par ailleurs, l’augmentation de l’expression de p16
INK4a
et la sénescence prématurée provoquée par l’oncogène Ras dans les FDH se trouvent inhibées par l’expression ectopique de LMP1. Protéine bHLH E47 Les facteurs de transcription hélice-boucle-hélice basique (bHLH) possèdent un domaine HLH de dimérisation protéique, ainsi qu’un domaine riche en acides aminés basiques pour leur association avec l’ADN. Les protéines E, bHLH de classe A, sont exprimées de façon ubiquitaire et capables de former des homodimères. Les protéines bHLH de classe B, exprimées avec une spécificité tissulaire, forment des hétérodimères avec les protéines bHLH de classe A. Les dimères de protéines bHLH régulent la transcription des gènes en s’associant, par leur domaine basique, avec une séquence spécifique de l’ADN (CANNTG), nommée boîte E. Le promoteur de INK4a présente deux boîtes E (Figure 1A). Une surexpression de la protéine E47, bHLH de classe A, inhibe la prolifération de certaines lignées tumorales humaines et active le promoteur de INK4a, tandis que la délétion des deux boîtes E abroge cet effet [25]. Par ailleurs, l’inhibition de l’expression de E47 par interférence par l’ARN (utilisation de siRNA) induit une diminution significative de l’expression de p16
INK4a
dans les FDH jeunes, et retarde leur sénescence réplicative [26]. À l’inverse, l’expression ectopique d’une protéine bHLH de classe B, Tal1, inhibe l’activité du promoteur du gène INK4a induite par la protéine E47, en formant avec elle des hétérodimères [27]. Inhibiteurs de la transcription Protéines HLH Id À la différence des protéines bHLH, les protéines HLH Id (Id-1,2,3,4) ne possèdent pas de domaine basique d’association avec l’ADN. Ainsi, Id-1 est nécessaire à la progression des FDH jeunes en G1 [28], et différentes observations indiquent un rôle potentiel inhibiteur de Id-1 sur p16
INK4a
: l’expression de Id-1 est négativement corrélée à celle de p16
INK4a
au cours de la sénescence cellulaire [23,26] ; les fibroblastes embryonnaires de souris (MEF) Id-1+/+ expriment faiblement p16
INK4a
, tandis que les MEF invalidés pour Id-1 (Id-1−/−) l’expriment fortement [29] ; l’hyperexpression de la protéine Id-1 retarde la sénescence réplicative et inhibe l’expression de p16
INK4a
dans les cellules humaines [30, 31] ; enfin, l’augmentation de l’expression d’Id-1 est corrélée avec la diminution de l’expression de p16
INK4a
dans les mélanomes de stade précoce [32]. Il semble que les protéines Id inhibent la transcription de INK4a en se liant aux protéines bHLH ou Ets : en formant des hétérodimères avec E47 par leur domaine HLH, elles inhibent son association avec l’ADN au niveau des boîtes E [33] ; par ailleurs, Id-1 s’associe également à Ets2 [23], la formation des hétérodimères Id/Ets2 diminuant significativement l’activation du promoteur de INK4a par Ets2 lorsque les sites consensus Ets ne sont pas mutés [23]. L’ensemble de ces données suggère donc que la protéine Id-1 inhibe la transcription d’INK4a en empêchant E47 et Ets2 de se lier à leurs sites consensus au niveau du promoteur du gène. Protéine Bmi1 Bmi1 est un répresseur transcriptionnel appartenant au groupe Polycomb (PcG). Les MEF invalidés pour Bmi1 ( Bmi1−/−) présentent un phénotype de sénescence prématurée, avec augmentation de l’ARNm de INK4a et de ARF par rapport aux MEF l’exprimant ( Bmi1+/+) ; l’expression induite de Bmi1 dans les MEF Bmi1−/− corrige ce phénomène [ 34]. Les MEF Bmi-1−/−INK4a+/+ présentent également un phénomène de sénescence prématurée, non observé dans les MEF Bmi1−/−INK4a−/− : le gène INK4a est donc une cible du facteur Bmi1, qui régule négativement sa transcription [ 34]. Une diminution de l’expression de Bmi1 est observée au cours de la sénescence réplicative des fibroblastes humains, et son hyperexpression provoque une diminution de l’expression de p16
INK4a
[35]. Le facteur Bmi1 humain possède en son extrémité aminoterminale un domaine en doigt RING (RF), impliqué dans l’interaction protéique, et un domaine central porteur d’une triple hélice-boucle (HT), ces deux domaines étant tous deux nécessaires à l’inhibition de l’expression de INK4a. De plus, différentes données expérimentales montrent que, chez l’homme, Bmi1 régule la prolifération et la sénescence cellulaire par inhibition de la voie p16
INK4a
/pRb, mais non de la voie p14
ARF
/p53 [35] ; cependant, le mécanisme de cette inhibition est encore très mal connu [36]. Régulation transcriptionnelle d’INK4a au cours de la sénescence cellulaire Dans les fibroblastes diploïdes humains jeunes, l’expression de p16
INK4a
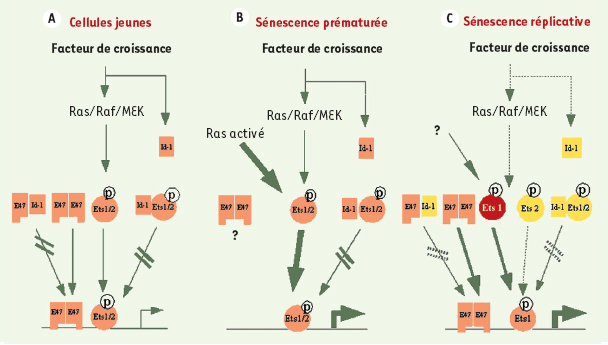
est faible ; en réponse à l’activation de la voie Ras/Raf/MEK, Id-1 contrebalance l’action de Ets1/2 et de E47 sur le promoteur de INK4a [ 23, 26] (Figure 2A).  | Figure 2.Rôle de Id-1, Ets1/2 et E47 sur la transcription de INK4a dans les fibroblastes humains. A. Les cellules jeunes présentent une expression relativement faible de INK4a. Sous l’influence de signaux de prolifération, Id-1 contrebalance, par formation d’hétérodimères, la fonction activatrice des protéines Ets 1/2 (phosphorylées) et E47 [ 23, 26]. B. L’activation de la voie Ras/Raf/MEK entraîne une sénescence prématurée, accompagnée d’une forte expression de INK4a via une forte activation de Ets1/2 [ 13, 23]. C. Au cours de la sénescence réplicative, l’augmentation de l’expression de Ets 1 s’accompagne d’une diminution de l’expression de Id-1, le tout aboutissant à une augmentation de l’expression de INK4a [ 23, 26]. La transition de couleurs (du jaune à l’orange puis au rouge) reflète l’importance de l’expression protéique ; l’épaisseur des flèches reflète l’importance de l’activation ;  : absence d’activation  ; : transcription. |
Lors de la sénescence prématurée provoquée par l’activation de l’oncogène Ras, la forte activation de Ets1/2 entraîne une augmentation de l’expression de p16INK4a (Figure 2B) [13, 23]. Au cours de la sénescence réplicative, l’expression de E47 ne varie pas, celle de Ets1 augmente, tandis que l’expression de Id-1 et de Ets2 diminue ; parallèlement, l’expression de p16
INK4a
augmente. L’absence de MEK activé dans les FDH sénescents suggère que l’activation de Ets2, qui intervient dans les FDH jeunes en réponse à l’activation de la voie Ras/Raf/MEK, n’est pas ici responsable de l’hyperexpression de p16
INK4a
: celle-ci pourrait être liée à une augmentation, non encore expliquée, de Ets1, associée à une diminution de l’expression d’Id-1 et à une diminution de l’interaction entre Id-1 et E47 [23, 26] (Figure 2C). |
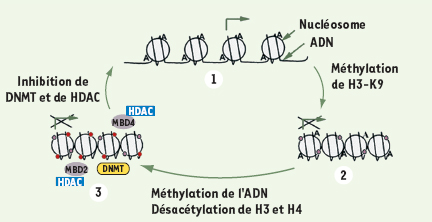
Régulation épigénétique de l’expression de INK4aMéthylation des îlots CpG Le promoteur et l’exon 1 du gène INK4a présentent un îlot CpG [ 6] (Figure 1B) dont la méthylation, sur les résidus cytosine, inhibe la transcription du gène. Cette méthylation d’ INK4a est retrouvée dans de très nombreuses tumeurs [ 6] ; INK4a pourrait donc être une cible privilégiée pour les traitements modulateurs de la méthylation, ou de l’acétylation. Les méthyltransférases de l’ADN (DNMT) sont importantes aussi bien pour la méthylation post-réplicative de l’ADN contenant des îlots CpG hémiméthylés (DNMT1) que pour sa méthylation de novo (DNMT3A/3B) ; de fait, la transcription de INK4a peut être réactivée dans différentes lignées tumorales humaines en inhibant les DNMT, par la 5-aza-2’désoxycytidine (5-aza-CdR) [ 37], ou spécifiquement l’enzyme DNMT1, par des oligonucléotides antisens ou des siRNA [ 38, 39]. Méthylation de l’histone H3 Les cellules HCT116 de cancer du côlon présentent un allèle sauvage de INK4a ( INK4awt) inhibé par méthylation de l’ADN, et un allèle muté ( INK4amut), non méthylé, produisant une protéine tronquée inefficace. L’invalidation des gènes codant pour les méthyltransférases de l’ADN DNMT1 et DNMT3B, par recombinaison homologue ciblée dans ces cellules, lève l’inhibition de INK4awt ; pourtant, au passage 22 après l’invalidation des deux gènes, INK4awt est à nouveau complètement inhibé, alors même que l’ADN n’est pas méthylé. En fait, la déméthylation de l’ADN est suivie de modifications post-traductionnelles des histones, par méthylation et acétylation ; or la méthylation de la lysine 9 de l’histone H3 est capable de provoquer l’extinction de INK4awt. Cette modification précède la méthylation de INK4awt et la désacétylation de H4 (toutes deux sont observées au passage 87), qui serviraient à maintenir la chromatine dans un état de répression spécifique [ 40] (Figure 3). 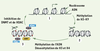 | Figure 3.Régulation épigénétique de INK4a par modifications post-traductionnelles des histones et méthylation de l’ADN. 1. L’absence de méthylation de l’îlot CpG de INK4a et l’acétylation (A) des histones H3 ou H4 autorisent la transcription du gène [ 40]. 2. La méthylation de l’histone 3 sur sa lysine 9 (H3-K9,) inhibe la transcription de INK4a et précède la méthylation de l’ADN (•) [ 40]. 3. La méthylation de l’ADN et l’acétylation des histones entraînent un blocage spécifique de la transcription lié à l’action des complexes répresseurs MBD2/4 (protéines associées aux îlots CpG méthylés) et à la désacétylase d’histone (HDAC) [ 41– 43]. L’inhibition des méthyltransférases de l’ADN (DNMT) et des HDAC rend au promoteur ses capacités transcriptionnelles [ 37– 39, 41]. |
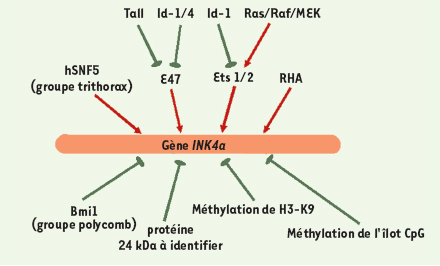
Rôle des protéines MBD2/4 Différentes protéines (MBD1/2/3/4, MeCP1/2) peuvent s’associer par leur domaine MBD ( methyl-CpG binding domain) aux îlots CpG méthylés [ 41, 42]. En absence d’acétylation de H3 et de H4, MBD2 (et MBD4) s’associent au promoteur méthylé de INK4a et recrutent des corépresseurs et des désacétylases d’histone (HDAC), entraînant ainsi une inhibition de la transcription du gène [ 42, 43]. Dans différentes lignées tumorales humaines, le traitement par la trichostatine A (TSA), un inhibiteur d’HDAC qui favorise l’acétylation des histones H3 et H4, mais n’induit pas de changement dans l’association entre MBD2 et le promoteur de INK4a, n’augmente pas l’expression de INK4a. En revanche, une augmentation, certes modérée, de l’expression de INK4a est observée dans les lignées traitées par la 5-aza-CdR, qui provoque une diminution de l’association entre MBD2 et le promoteur de INK4a, et une faible augmentation de l’acétylation des histones H3 et H4. Dans le même sens, un traitement combiné par 5-aza-CdR et TSA conduit à une forte induction de l’expression de INK4a. Les modulations de la méthylation de l’ADN et de l’acétylation des histones coopèrent donc pour réguler l’expression de INK4a [41]. Intervention de l’hélicase A de l’ARN Le promoteur de INK4a comporte trois boîtes GC, sites consensus de fixation du facteur de transcription Sp1. Le rôle de Sp1 dans la protection de l’îlot CpG d’ INK4a contre la méthylation a été examiné : les résultats montrent que le degré de méthylation du promoteur d’ INK4a n’influe pas sur la liaison de Sp1 [ 44]. Lors de cette analyse, une liaison de l’hélicase A de l’ARN humain (RHA) sur le promoteur d’ INK4a a été mise en évidence, au niveau d’une séquence 5’-CGGACCGCGTGCGC-3’ située en aval et chevauchant le site consensus de Sp1 (Figure 1A) ; l’intensité de cette liaison est inversement proportionnelle au degré de méthylation du promoteur, et pourrait être modulée par l’acétylation de la RHA ; de plus, l’expression de RHA exogène peut augmenter l’activité du promoteur de INK4a. Le facteur Sp1 seul n’est donc pas suffisant pour protéger des îlots CpG de la méthylation ; il est possible que la RHA augmente l’accessibilité du promoteur d’ INK4a aux activateurs de la transcription tels que Sp1, le protégeant ainsi contre la méthylation de son îlot CpG [ 44]. Autres modifications épigénétiques Le complexe SWI/SNF, qui appartient à la famille des facteurs du remodelage chromatinien dépendants de l’ATP, rend le génome plus accessible aux protéines associées à l’ADN en affaiblissant le contact entre les nucléosomes et l’ADN. Chez la levure, SWI/SNF modifie la structure du nucléosome en hydrolysant l’ATP grâce à sa sous-unité SWI2/SNF2-ATPase. Le complexe SWI/SNF humain (hSWI/SNF) contient, quant à lui, la protéine BRG1, homologue de SWI2/SNF2 [ 45]. Le gène SNF5 humain ( hSNF5), muté dans les tumeurs malignes rhabdoïdes (MRT) qui code pour une sous-unité du complexe hSWI/SNF, stimule in vitro l’activité BRG1 ; surexprimé de façon expérimentale dans les MRT, le facteur hSNF5 s’associe au promoteur de INK4a et y recrute BRG1, entraînant alors une activation de la transcription de INK4a [ 45]. Les membres du complexe SWI/SNF sont des activateurs, appartenant au groupe trithorax, qui contrebalancent l’action d’inhibiteurs appartenant, quant à eux, au groupe des protéines Polycomb (PcG), telle Bmi1 : hSNF5 et Bmi1 pourraient ainsi fonctionner de façon antagoniste pour la régulation de INK4a. De fait, les protéines PcG regroupent au moins deux complexes protéiques distincts, le complexe répresseur 1 de Polycomb (PRC1) et le complexe ESC-E(Z) [46]. La protéine E(Z) aurait la capacité de méthyler l’histone H3 sur sa lysine 27 (H3-K27), signal de recrutement du complexe PRC1 sur l’élément de réponse à PcG. En bloquant l’accessibilité des facteurs du remodelage chromatinien tels que SWI/SNF, le recrutement de PRC1 s’accompagnerait alors d’une inhibition de l’expression des gènes [46] : la méthylation de H3-K27 pourrait donc interférer avec les rôles, antagonistes, de hSNF5 et Bmi1, ce qui souligne encore la complexité de la régulation transcriptionnelle de INK4a (Figure 4). 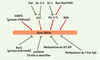 | Figure 4.
Mécanismes régulant la transcription de INK4a.
|
|
L’analyse du promoteur de INK4a montre l’existence d’éléments de réponse pour d’autres facteurs de transcription dont l’action n’a pas encore été démontrée chez l’homme (JunB) [47], ou qui n’ont pas encore été identifiés (ITSE, INK4a transcription silence element) [48]. La dérégulation de nombreux mécanismes et facteurs participant à la régulation de INK4a a été associée au développement de divers types de tumeurs : méthylation aberrante du promoteur [6], inactivation du gène hSNF5 par mutation impliquée dans des tumeurs malignes rhabdoïdes [45], dérégulation de Bmi1 qui, par son interaction avec c-myc, est impliquée dans la lymphomagenèse chez la souris [49] ; forte expression de Tal1 (T-cell acute leukemia 1), impliquée dans la leucémogenèse [27]. L’analyse de la complexité des différents mécanismes de régulation de INK4a et une meilleure compréhension des modulations épigénétiques de son expression devraient permettre de développer l’utilisation rationnelle de nouvelles thérapeutiques, telles que les siARN ou les inhibiteurs de méthylases ou de désacétylases d’histone.
|
Nous remercions les comités de la Ligue contre le cancer de Saône-et-Loire, du Rhône et de la Drôme pour leur soutien financier.
|
Footnotes |
1. Serrano M, Hannon GJ, Beach D. A new regulatory motif in cell-cycle control causing specific inhibition of cyclinD/CDK4. Nature 1993; 366 : 704–7. 2. Wolff B, Naumann M. INK4 cell cycle inhibitors direct transcriptional inactivation of NF-kappaB. Oncogene 1999; 18 : 2663–6. 3. Haas K, Staller P, Geisen C, et al. Mutual requirement of CDK4 and Myc in malignant transformation : evidence for cyclin D1/CDK4 and p16INK4A as upstream regulators of Myc. Oncogene 1997; 10 : 179–92. 4. Serizawa H. Cyclin-dependent kinase inhibitor p16INK4A inhibits phosphorylation of RNA polymerase II by general transcription factor TFIIH. J Biol Chem 1998; 273 : 5427–30. 5. Nobori T, Miura K, Wu DJ, et al. Deletions of the cyclin-dependent kinase-4 inhibitor gene in multiple human cancers. Nature 1994; 368 : 753–6. 6. Merlo A, Herman JG, Mao L, et al. 5’pG island methylation is associated with transcriptional silencing of the tumor suppressor p16/CDKN2/MTS1 in human cancers. Nat Med 1995; 1 : 686–92 7. Sandig V, Brand K, Herwig S, et al. Adenovirally transferred p16INK4/CDKN2 and p53 genes cooperate to induce apoptotic tumor cell death. Nat Med 1997; 3 : 313–9. 8. Kim M, Katayose Y, Rojanala L, et al. Induction of apoptosis in p16INK4A mutant cell lines by adenovirus-mediated overexpression of p16INK4A protein. Cell Death Differ 2000; 7 : 706–11. 9. Ausserlechner MJ, Obexer P, Geley S, et al. G1 arrest by p16INK4A uncouples growth from cell cycle progression in leukemia cells with deregulated cyclin E and c-Myc expression. Leukemia 2005; 19 : 1051–7. 10. Sharpless NE, DePinho RA. The INK4A/ARF locus and its two gene products. Curr Opin Genet Dev 1999; 9 : 22–30 11. Hara E, Smith R, Parry D, et al. Regulation of p16
CDKN2
expression and its implication for cell immortalization and senescence. Mol Cell Biol 1996; 16 : 859–67 12. Li Y, Nicolas MA, Shay JW, et al. Transcriptional repression of the D-type cyclin dependent kinase inhibitor p16 by retinoblastoma susceptibility gene product pRb. Cancer Res 1994; 54 : 6078–82. 13. Serrano M, Lin AW, McCurrach ME, et al. Oncogenic ras provokes premature cell senescence associated with accumulation of p53 and p16INK4a. Cell 1997; 88 : 593–602. 14. Zhang Y, Xiong Y, Yarbrough WG. ARF promotes MDM2 degradation and stabilizes p53 : ARF-INK4a locus deletion impairs both the pRb and p53 tumor suppression pathways. Cell 1998; 92 : 725–34. 15. Shapiro GI, Edwards CD, Ewen ME, et al. p16
ink4a
participates in a G1 arrest checkpoint in response to DNA damage. Mol Cell Biol 1998; 18 : 378–87. 16. Krimpenfort P, Quon K.C, Mooi WJ, et al. Loss of p16Ink4a confers susceptibility to metastatic melanoma in mice. Nature 2001; 413 : 83–6. 17. Serrano M, Lee H, Chin L, et al. Role of the INK4a locus in tumor suppression and cell mortality. Cell 1996; 85 : 27–37. 18. Brookes S, Rowe J, Ruas M, et al. INK4a-deficient human diploid fibroblasts are resistant to RAS-induced senescence. EMBO J 2002; 21 : 2936–45. 19. Drayton S, Rowe J, Jones R, et al. Tumor suppressor p16INK4a determines sensitivity of human cells to transformation by cooperating cellular oncogenes. Cancer Cell 2003; 4 : 301–10 20. Gump J, Stokoe D, McCormick F. Phosphorylation of p16INK4A correlates with Cdk4 association. J Biol Chem 2003; 278 : 6619–22. 21. Mekki Y, Catallo R, Bertrand Y, et al. Enhanced expression of p16ink4a is associated with a poor prognosis in childhood acute lymphoblastic leukemia. Leukemia 1999; 13 : 181–9. 22. Zhu J, Woods D, McMahon M, et al. Senescence of human fibroblasts induced by oncogenic Raf. Genes Dev 1998; 12 : 2997–3007. 23. Ohtani N, Zebedee Z, Huot TJG, et al. Opposing effects of Ets and Id proteins on p16
INK4a
expression during cellular senescence. Nature 2001; 409 : 1067–70. 24. Ohtani N, Brennan P, Gaubatz S, et al. Epstein-Barr virus LMP1 blocks p16
INK4a
-pRb pathway by promoting nuclear export of E2F4/5. J Cell Biol 2003; 162 : 173–83. 25. Pagliuca A, Gallo P, De Luca P, et al. Class A helix-loop-helix proteins are positive regulators of several cyclin-dependent kinase inhibitors’ promoter activity and negatively affect cell growth. Cancer Res 2000; 60 : 1376–82 26. Zheng W, Wang H, Xue L, et al. Regulation of cellular senescence and p16
INK4a
expression by Id1 and E47 proteins in human diploid fibroblast. J Biol Chem 2004; 279 : 31524–32. 27. Hansson A, Manetopoulos C, Jönsson JI, et al. The basic helix-loop-helix transcription factor TAL1/SCL inhibits the expression of the p16INK4A and pT genes. Biochem Biophys Res Commun 2003; 312 : 1073–81. 28. Hara E, Yamaguchi T, Nojima H, et al. Id-related genes encoding helix-loop-helix proteins are required for G1 progression and are repressed in senescent human fibroblasts. J Biol Chem 1994; 269 : 2139–45. 29. Alani RM, Young AZ, Shifflett CB. Id1 regulation of cellular senescence through transcriptional repression of p16/INK4a. Proc Natl Acad Sci USA 2001; 98 : 7812–6. 30. Nickoloff BJ, Chaturvedi V, Bacon P, et al. Id-1 delays senescence but does not immortalize keratinocytes. J Biol Chem 2000; 275 : 27501–4. 31. Tang J, Gordon GM, Nickoloff BJ, et al. The helix-loop-helix protein Id-1 delays onset of replicative senescence in human endothelial cells. Lab Invest 2002; 82 : 1073–9. 32. Polsky D, Young AZ, Busam KJ, et al. The transcriptional repressor of p16INK4a, Id1, is up-regulated in early melanomas. Cancer Res 2001; 61 : 6008–11. 33. Pesce S, Benezra R. The loop region of the helix-loop-helix protein Id1 is critical for its dominant negative activity. Mol Cell Biol 1993; 13 : 7874–80. 34. Jacobs JJL, Kieboom K, Marino S, et al. The oncogene and polycomb-group gene bmi-1 regulates cell proliferation and senescence through the INK4a locus. Nature 1999; 397 : 164–8. 35. Itahana K, Zou Y, Itahana Y, et al. Control of the replicative life span of human fibroblasts by p16 and polycomb protein Bmi-1. Mol Cell Biol 2003; 23 : 389–401. 36. Dellino GI, Schwartz YB, Farkas G, et al. Polycomb silencing blocks transcription initiation. Mol Cell 2004; 13 : 887–93. 37. Costello JF, Berger MS, Huang HS, et al. Silencing of p16/CDKN2 expression in humain gliomas by methylation and chromatin condensation. Cancer Res 1996; 56 : 2405–10. 38. Fournel M, Sapieha P, Beaulieu N, et al. Down regulation of human DNA-(cytosine-5) methyltransferase induces cell cycle regulators p16
INK4a
and p21
WAF/Cipl
by distinct mechanisms. J Biol Chem 1999; 274 : 24250–6. 39. Robert MF, Morin S, Beaulieu N, et al. DNMT1 is required to maintain CpG methylation and aberrant gene silencing in human cancer cells. Nat Genet 2003; 33 : 61–5. 40. Bachman KE, Park BH, Rhee I, et al. Histone modifications and silencing prior to DNA methylation of a tumor suppressor gene. Cancer cell 2003; 3 : 89–95. 41. Magdinier F, Wolffe AP. Selective association of the methyl-CpG binding protein MBD2 with the silent p14/p16 locus in human neoplasia. Proc Natl Acad Sci USA 2001; 98 : 4990–5 42. Kondo E, Gu Z, Horii A, et al. The Thymine DNA glycosylase MBD4 represses transcription and is associated with methylated p16
INK4a
and hMLH1 genes. Mol Cell Biol 2005; 25 : 4388–96. 43. Ng HH, Zhang Y, Hendrich B, et al. MBD2 is a transcriptional repressor belonging to the MeCP1 histone deacetylase complex. Nat Genet 1999; 23 : 58–61. 44. Myöhänen S, Baylin SB. Sequence-specific DNA binding activity of RNA helicase A to the p16
INK4a
promoter. J Biol Chem 2001; 276 : 1634–42. 45. Oruetxebarria I, Venturini F, Kekarainen T, et al. p16
INK4a
is required for hSNF5 chromatin remodeler-induced cellular senescence in malignant rhabdoid tumor cells. J Biol Chem 2004; 279 : 3807–16. 46. Cao R, Wang L, Wang H, et al. Role of histone H3 lysine 27 methylation in polycomb-group silencing. Science 2002; 298 : 1039–43. 47. Passegue E, Wagner EF. JunB suppresses cell proliferation by transcriptional activation of p16(INK4a) expression. EMBO J 2000; 19 : 2969–79. 48. Wang W, Wu J, Zhang Z, et al. Characterization of regulation elements on the promoter region of p16
INK4a
that contribute to overexpression of p16 in senescent fibroblasts. J Biol Chem 2001; 276 : 48655–61. 49. Jacobs JJ, Scheijen B, Voncken JW, et al. Bmi-1 collaborates with c-Myc in tumorigenesis by inhibiting c-Myc-induced apoptosis via INK4a/ARF. Genes Dev 1999; 13 : 2678–90. |


 : absence d’activation
: absence d’activation  ; : transcription.
; : transcription.