| |
| Med Sci (Paris). 2006 November; 22(11): 904–906. Published online 2006 November 15. doi: 10.1051/medsci/20062211904.Voie Wnt/β-caténine et zonation métabolique du foie : un nouvel acteur pour un ancien concept Samira Benhamouche, Thomas Decaens, Christine Perret, and Sabine Colno* Institut Cochin, CNRS UMR 8104, Inserm U567, Université Paris V-René Descartes, Faculté de Médecine, Institut Cochin, 24, rue du Faubourg-Saint-Jacques, 75014 Paris, France MeSH keywords: Humains, Foie, Modèles biologiques, Protéines de type Wingless, bêta-Caténine |
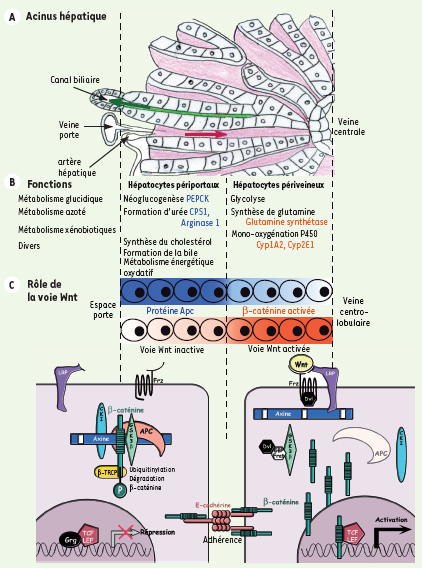
Le rôle fonctionnel du foie est essentiellement métabolique, et consiste à trier et traiter les nutriments bruts provenant de l’intestin par la veine porte, pour biotransformer, synthétiser et sécréter nutriments, énergie, xénobiotiques et hormones qui seront délivrés aux différents organes par la veine hépatique, et à l’intestin par les canaux biliaires. L’unité fonctionnelle hépatique décrite par Kiernan dès 1833, qu’il s’agisse selon les auteurs du lobule, de l’acinus ou de la travée hépatocytaire (Figure 1A et 1B), est orientée par le flux sanguin traversant le foie. La première rangée d’hépatocytes dits périportaux est alimentée en sang mixte provenant de l’artère hépatique et de la veine porte ; elle est en contact avec les canaux biliaires. À l’opposé de la travée hépatocytaire, les hépatocytes dits périveineux entourent une veine centrolobulaire dans laquelle se déverse le sang efférent.  | Figure 1.
Voie Wnt/b-caténine et zonation du foie. A. L’acinus hépatique : les travées d’hépatocytes sont séparées par les sinusoïdes dans lesquels le sang circule de l’espace porte vers la veine centrolobulaire (flèche rouge), alors que la bile synthétisée par les hépatocytes est déversée dans les canaux biliaires (flèche verte).B. Fonctions métaboliques zonées des hépatocytes périportaux et périveineux : quelques exemples de gènes périveineux surexprimés en réponse à un signal β-caténine sont en orange, et les gènes périportaux réprimés en bleu. C. La β-caténine est activée dans la moitié périveineuse de la travée hépatocytaire alors qu’Apc présente un gradient inverse. Côté périportal, en présence d’une quantité importante d’Apc, la voie Wnt est réprimée : un complexe incluant Apc et l’axine permet aux kinases CK1 et GSK3β de phosphoryler la β-caténine et de la diriger ainsi vers l’ubiquitinylation et la dégradation. Dans ce cas, les facteurs de transcription Lef/Tcf sont maintenus inactifs dans le noyau. Côté périveineux, la voie Wnt est activée, ce qui permet une dissociation du complexe de dégradation de β-caténine: la forme non phosphorylée de β-caténine peut alors s’accumuler, se transporter dans le noyau, où, en se liant aux facteurs Lef/Tcf, elle permet la transcription de ses gènes cibles. |
Il y a une trentaine d’années, K. Jungermann montrait, par des immunolocalisations des enzymes clés du métabolisme glucidique, que les hépatocytes étaient spécialisés différemment selon leur localisation le long de l’axe porto-central de la travée hépatocytaire. Il introduisait ainsi le concept dynamique de zonation métabolique [
1], qui permettait d’expliquer comment des fonctions, a priori opposées comme la biosynthèse et la dégradation d’un même nutriment (Figure 1B), pouvaient cohabiter dans le foie. Au cours des dernières décennies cependant, l’identification de la mécanistique pouvant être mise en jeu pour assurer cette compartimentation des fonctions hépatiques fut souvent étudiée mais jamais résolue. C’est en étudiant des souris modélisant une forme fréquente d’hépatocarcinome humain consécutif à une activation aberrante de la voie Wnt/β-caténine que nous avons pu constater que plusieurs protéines normalement exclusivement exprimées dans les hépatocytes périveineux étaient présentes de manière anormale dans les hépatocytes mutés pour la β-caténine [
2–
4]. Il était alors tentant d’émettre l’hypothèse qu’une signalisation Wnt/ β-caténine pouvait être responsable de la mise en place de la zonation dans le foie. |
La voie Wnt/ β-caténine à l’origine de la zonation métabolique du foie Nous avons récemment conforté cette hypothèse [
5], tout d’abord en localisant la forme activée de β-caténine exclusivement dans la moitié périveineuse du foie, alors qu’à l’opposé, le produit du gène suppresseur de tumeur Apc (adenomatous polyposis coli) qui contrôle négativement la voie Wnt n’était détectable qu’en région périportale (Figure 1C). Nous pouvions ensuite analyser les conséquences immédiates de la perte d’Apc dans le foie (à l’aide d’un modèle conditionnel inductible), par puces à ADNc et localisations in situ des cibles moléculaires de β-caténine, et montrer que beaucoup de gènes surexprimés en réponse à un signal β-caténine étaient physiologiquement exprimés dans l’aire périveineuse du foie, alors que plusieurs gènes réprimés étaient d’expression périportale. La démarche inverse consistant à bloquer le signal Wnt/ β-caténine dans un foie normal à l’aide d’un adénovirus codant la protéine Dikkhopf-1 se traduisait au contraire par une absence d’expression des protéines normalement périveineuses, alors que le foie tout entier était envahi par des protéines périportales. Nous démontrions ainsi que la voie Wnt/ β-caténine était capable d’activer dans le foie un programme génétique périveineux, mais aussi de réprimer un programme génétique périportal. Il s’avérait également que parmi les gènes différentiellement exprimés à la suite de la perte d’Apc, nombreux étaient ceux qui avaient trait au métabolisme azoté, une fonction zonée importante du foie. Pour épurer le sang de l’ammoniac produit en grande quantité par les bactéries intestinales, les hépatocytes périportaux l’engagent vers le cycle de l’urée qui est un système de détoxification à haute capacité mais faiblement affine. Les hépatocytes périveineux sont, eux, chargés de « nettoyer » l’ammoniac résiduel via la synthèse de glutamine. Dans les foies invalidés pour Apc, le cycle de l’urée était défectueux du fait d’un déficit en enzymes périportales, enzymes-clés de ce métabolisme comme la carbamoyl-phosphate synthétase 1, et l’arginase 1, alors qu’à l’inverse la synthèse de glutamine était exacerbée du fait d’une forte expression en enzymes périveineuses, comme la glutamine synthétase (Figure 1B). La traduction phénotypique de ces perturbations était une forte hyperammoniémie et une hyperglutaminémie chez ces souris, ces deux molécules fortement toxiques étant probablement responsables de la mort des animaux par encéphalopathie hépatique [5]. Deux autres équipes montraient parallèlement que la synthèse d’enzymes appartenant à la famille des cytochromes P450 était, elle aussi, dépendante de la signalisation β-caténine [
6,
7]. Ces enzymes assurent des fonctions dans le métabolisme des xénobiotiques (drogues, alcools, carcinogènes) ou dans la biosynthèse des hormones, cholestérol et acides biliaires. Par exemple, les enzymes périveineuses Cyp1a2 et Cyp2e1 métabolisent dans le foie le paracétamol sous sa forme active. Or, à la suite de l’invalidation hépatique du gène β-caténine, la perte de Cyp1a2 et Cyp2e1 rendait les souris résistantes à la nécrose centrolobulaire qui fait suite à une intoxication massive par le paracétamol [7]. Ainsi, la voie Wnt/ β-caténine possède un rôle essentiel dans l’homéostasie hépatique en assurant le contrôle d’au moins deux de ses fonctions métaboliques zonées (métabolisme azoté et xénobiotiques). Apc est la molécule qui, par sa surabondance dans l’aire périportale, permet de limiter la signalisation Wnt/ β-caténine à la région périveineuse du foie. Ce rôle critique d’Apc dans un système physiologique où la voie β-caténine est activée a déjà été observé dans l’épithélium intestinal où la forte accumulation d’Apc dans les villosités différenciées, permet de restreindre le signal Wnt/ β-caténine aux cryptes prolifératives et en particulier aux cellules souches intestinales. C’est ainsi qu’Apc avait été défini comme le gardien de l’épithélium intestinal (gate-keeper des Anglo-Saxons), sa perte étant responsable de l’initiation de la cancérogenèse colique [
8]. Même si en cancérogenèse hépatique liée à l’activation d’un signal β-caténine (30-40 % des carcinomes hépatocellulaires [
9]), des mutations du gène suppresseur de tumeur Apc semblent être peu impliquées, nous avons néanmoins montré en modèle murin que la perte d’Apc était capable de conduire au développement de tumeurs hépatiques [
3,
10]. Ce rôle oncogénique de la perte d’Apc, ainsi que l’importance cruciale de cette molécule dans l’homéostasie hépatique (via son rôle dans la zonation) nous permettent de proposer aujourd’hui qu’Apc soit le gardien de la zonation hépatique (zonation-keeper). |
1. Jungermann K, Sasse D. Heterogeneity of liver parenchymal cells. Trends Biochem Sci 1978; 3 : 198–202. 2. Cadoret A, Ovejero C, Terris B, et al. New targets of beta-catenin signaling in the liver are involved in the glutamine metabolism. Oncogene 2002; 21 : 8293–301. 3. Colnot S, Decaens T, Niwa-Kawakita M, et al. Liver-targeted disruption of Apc in mice activates beta-catenin signaling and leads to hepatocellular carcinomas. Proc Natl Acad Sci USA 2004; 101 : 17216–21. 4. Ovejero C, Cavard C, Perianin A, et al. Identification of the leukocyte cell-derived chemotaxin 2 as a direct target gene of beta-catenin in the liver. Hepatology 2004; 40 : 167–76. 5. Benhamouche S, Decaens T, Godard C, et al. Apc tumor suppressor gene is the «zonation-keeper» of mouse liver. Dev Cell 2006 (sous presse). 6. Hailfinger S, Jaworski M, Braeuning A, et al. M. Zonal gene expression in murine liver: lessons from tumors. Hepatology 2006; 43 : 407–14. 7. Sekine S, Lan BY, Bedolli M, et al. Liver-specific loss of beta-catenin blocks glutamine synthesis pathway activity and cytochrome p450 expression in mice. Hepatology 2006; 43 : 817–25. 8. Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer. Cell 1996; 87 : 159–70. 9. De La Coste A, Romagnolo B, Billuart P, et al. Somatic mutations of the beta-catenin gene are frequent in mouse and human hepatocellular carcinomas. Proc Natl Acad Sci USA 1998; 95 : 8847–51. 10. Colnot S, Decaens T, Perret C. Activating a beta-catenin signal in the liver is oncogenic. Med Sci (Paris) 2005; 21 : 355–7. |